



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
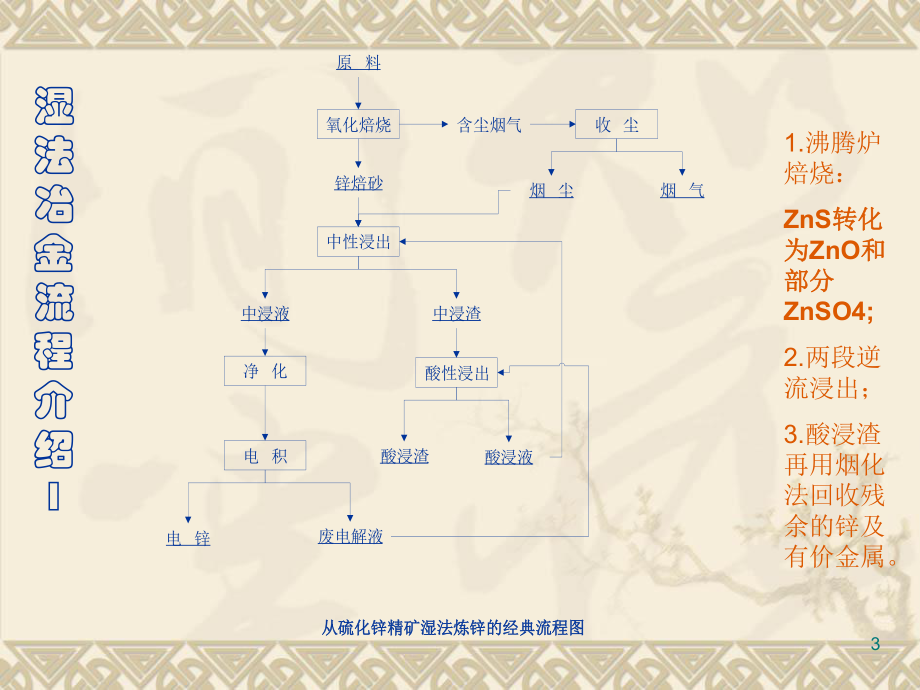
1、湿 法 冶 金第二讲主讲:谢克强 2主要内容用湿法冶金方法从原料制取金属的流程简介;用湿法冶金方法从原料制取金属的流程简介;用湿法冶金方法制取无机材料简介;用湿法冶金方法制取无机材料简介;水溶液热力学水溶液热力学 ; 电解质活度系数电解质活度系数 。3湿法冶金流程介绍1原 料电 积酸性浸出收 尘净 化中性浸出氧化焙烧中浸液电 锌废电解液酸浸渣酸浸液锌焙砂烟 气烟 尘含尘烟气中浸渣从硫化锌精矿湿法炼锌的经典流程图从硫化锌精矿湿法炼锌的经典流程图1.沸腾炉焙烧:ZnS转化转化为为ZnO和和部分部分ZnSO4;2.两段逆流浸出;3.酸浸渣再用烟化法回收残余的锌及有价金属。4湿法冶金流程介绍2铝土矿晶
2、种分解沉降分离溶 出过滤稀释湿磨粗液精液母液晶种氢氧化铝洗液赤泥(送堆场)稠浓赤泥浆拜耳法生产氧化铝的原则流程图拜耳法生产氧化铝的原则流程图苛性钠沉降分离烧结氧化铝赤泥洗涤蒸发蒸发母液1.破碎;2.湿磨;3.高压釜内溶出,得到NaAlO2,Fe2O3等伴生物进入渣相与Al2O3分离;4.晶种分解,加入Al(OH)3晶种, NaAlO2分解得到Al(OH)3;5. Al(OH)3煅烧得到Al2O3。5湿法冶金流程介绍3红土矿溶解三段逆流浸出磁选液固分离、洗涤两段流态化还原浸出渣铁精矿尾液母液(回收钴)镍然混合复盐(回收钴)碱式碳酸镍浸出液处理含镍红土矿的焙砂处理含镍红土矿的焙砂氨浸氨浸氢还原的原
3、则流程图氢还原的原则流程图溶液净化浓缩结晶蒸氨氢还原镍粉Ni(NH3)n2+CO32-NH4OH,(NH4)2CO3(NH4)2SO4+NH31.还原:NiO、CoO、Fe2O3还原为Ni、Co和FeO;2.浸出:钴镍以Ni(NH3)n2+、 Co(NH3)n2+ 、Co(NH3)n3+形态进入溶液,铁成Fe(OH)3沉淀入渣;3.蒸氨:分解得到碱式碳酸盐,并回收NH3和CO2;4.再溶解;6湿法冶金流程介绍4白钨精矿、黑钨精矿过滤除钼机械活化浸出仲钨酸氨NaOH浸出法处理钨矿物原料生产仲钨酸氨的原则流程图浸出法处理钨矿物原料生产仲钨酸氨的原则流程图结 晶解 吸烧 碱滤液净化除硅磷砷阴离子交换
4、树脂吸附纯 Na2WO3溶液沉淀人造白钨酸分解 HCl 氨溶萃 取负钨有机相反 萃NH4OH有机相(NH4)2WO3溶液NH4Cl+,NH4OH滤渣(处理)1.机械活化:热球磨;2.浸出:CaWO3浸出生成Na2WO3;3. 净化除杂:三种工艺,化学沉淀法、萃取法、离子交换法;4.仲钨酸氨溶液结晶得到仲钨酸氨。7湿法冶金流程介绍5原 矿浸出液锌置换浸 出氰化法提金的原则流程图氰化法提金的原则流程图脱 气熔 炼NaCN金 泥金 锭母 液1.浸出:得到Au(CN)2-和Ag(CN)2-;2.脱气:脱其中含氧;3.用锌还原。8湿法冶金制取无机材料介绍1.金属粉末的制取金属粉末的制取l水溶液电解法:制
5、取铜、银、铁、镍等金属粉水溶液电解法:制取铜、银、铁、镍等金属粉末;末;l还原法:制取贵金属粉末。还原法:制取贵金属粉末。2.非金属材料及陶瓷材料粉末制取非金属材料及陶瓷材料粉末制取l沉淀或共沉淀法:制取铁氧体粉末、沉淀或共沉淀法:制取铁氧体粉末、ASCS陶陶瓷粉末、氧化稀土、氧化铪、氧化铀等新型陶瓷粉末、氧化稀土、氧化铪、氧化铀等新型陶瓷材料。瓷材料。9湿法冶金制取无机材料介绍3.电镀法制取新型材料薄膜及电成型电镀法制取新型材料薄膜及电成型 例如:例如:Y钇钇-Ba-Cu合金薄膜、合金薄膜、 Sm钐钐-Ba-Cu合合金薄膜、金薄膜、Cd-Zn-Se硒合金等等。硒合金等等。 电镀法用于制件的成
6、型,如:医疗器械的部电镀法用于制件的成型,如:医疗器械的部件、印刷板等。件、印刷板等。4.化学镀化学镀(亦称非电电镀)亦称非电电镀) 例如:在发动机某些部件表面镀例如:在发动机某些部件表面镀Co-Zn-P膜膜或或Ni-Zn-P膜等,其耐磨性能优于电镀膜。膜等,其耐磨性能优于电镀膜。10水溶液热力学自由能、熵、热焓自由能、熵、热焓3个性质、特征1.体系向自由能减小方向进行;2.溶液的热焓用下式求得: 式中 n溶液中所含物质的种数 溶液热焓,J 溶液中所含物质的摩尔数 溶液中所含物质的偏摩尔热焓,J 数据可在文献热力学手册中找到。热焓表示体系为放热或吸热; 1nisiiHN HsHiNiHiH11
7、水溶液热力学熵3.熵:热力学利用熵(S)和自由能(G或F)状态函数来判断过程自发进行的方向和平衡状态。 过程熵变的基本公式为:下标R表示可逆过程。 由热力学第二定律的原理可以推出,对于孤立体系有 dS0 其中:“”适用于自发过程;“”适用于可逆过程,即平衡状态。RQdST12水溶液热力学自由能、熵、热焓 由于用熵来判断过程的自发性要在孤立体系的条件下进行,这对化学反应和相变来说不太方便,所以热力学又引进了吉布斯自由能G和亥姆霍茨自由能F两个状态函数。它们的定义是: G=H-TS F=U-TS 判断自发和平衡的公式为: 恒温恒压下 dG0 恒温恒容下 dF 0其中:“”为自发;“”为平衡条件。1
8、3水溶液热力学自由能 对于纯物质:表征热力学量用mol量表示(克分子)。 对于水溶液,例如: ZnO(s)+H2SO4(aq)ZnSO4(aq)+H20(l)如果按计算自由能,则为错误算法。 其错误在于:水溶液H2SO4、ZnSO4不能用纯物质自由能进行计算,它们已经是水溶物种。4224()()ZnSOH OZnOH SOFFFFF反应14水溶液热力学自由能 所以,对于水溶液,应该用偏摩尔量来表征,则上述反应正确的写法为:即写成离子反应式,并用下标标明物种。 此时反应自由能为: 0,反应可行; 0反应不可行。222( )()4()()4()2( )2saqaqaqaqlZnOHSOZnSOH
9、O22()(2)ZnHH OZnOFFFFF反应F反应F反应15水溶液热力学自由能 生成自由能 区分原则:单质在25 (298K)自由能为0, 自由能 为生成自由能,否则 为Gibbs自由能。 Gibbs自由能 利用自由能判断反应能否进行,这是热力学需要解决的第一个问题。16水溶液热力学平衡常数 反应进行到什么程度,这是热力学需要解决的第二个问题(平衡常数)。17水溶液热力学平衡常数平衡常数 (单位为焦耳时,R8.314,单位为卡时,R1.987)2( )()()2( )2saqaqlZnOHZnH O 222ZnH OKZnO H()lg2.303FKRT 卡18水溶液热力学平衡常数所以上述
10、反应在298K时的自由能为 K值越大,反应越容易向右方进行。( 35.1 56.77)( 76.10)F 反应(298)()2982.303FKRT 卡15.7 10002.303 1.987 298 11.513=-15.7 kcal19 湿法冶金反应式一般均要写成离子式,并标明物种状态。20电解质的活度、活度系数焓变状态生 成 物温度t1状态生 成 物温度t2状态反 应 物温度t2状态反 应 物温度t1H过程在t2下进行反应在t1下进行反应 焓变过程示意图焓变过程示意图 21电解质的活度、活度系数焓变整个过程的焓变取IIII途径进行计算 是物料温度由t1上升到反应温度t2体系的焓变。 为在
11、温度t2下反应过程的反应热。1234HHHHH 12HHH 1H2H22电解质的活度、活度系数焓变 (1)式中 物料中组元i的摩尔数; 物料中组元i温度由t1上升到t2的焓变。 (2)为求出 首先必须求出物料中各组元的摩尔数。1iiiHm H21,t,iii tHHHimiHiH23电解质的活度、活度系数理想溶液 公式(1)中 若为纯物质(固体或气体),则 可取 , 即标准摩尔焓。而溶液中的溶解物种 与溶剂水的是理想溶液中溶解物种的值,其标准状态为压力p0.1MPa,溶液为理想溶液。 iHiHiHiH0iH24电解质的活度、活度系数理想溶液 溶解物种的标准偏摩尔焓 指的是一个浓度为1mol/L
12、的理想溶液中1mol溶质的焓。理想溶液是不存在的,只有无限稀释的溶液接近于理想溶液。湿法冶金体系的水溶液为非理想溶液,是一种实际存在的溶液。 0iH25电解质的活度、活度系数实际溶液 实际溶液中溶质的偏摩尔量与其标准偏摩尔量是有差距的。实际溶液的偏摩尔量与相同浓度的理想溶液的偏摩尔量之间的差值称为“超额函数”或“剩余函数”,表示实际溶液对理想溶液的偏差。 26电解质的活度、活度系数活度系数实际溶液中组元的偏摩尔焓以下式表示 (3) 式中 超额函数; 实际溶液中组元i的偏摩尔焓; i的标准偏摩尔焓; 实际溶液中i的活度系数。2,ln()Bexiiiip nrHHHRTT exiHiHiHir27
13、电解质的活度、活度系数活度系数由公式(3)得出 (4) 欲用公式(4)计算实际溶液中溶解物种的偏摩尔焓,必须知道 与 =f(T),前者可在手册热力学中找到,后者则必须自行计算。 2,ln()Biiip nrHHRTTiHir28电解质的活度、活度系数活度系数 活度系数可用Pitzer公式计算,但由于浸出过程的溶液是含多种溶质的复杂溶液,故缺乏一些所需要的数据,目前尚难以进行此类计算。因此,不得不采用简化计算方法,即用水溶物种的标准偏摩尔焓进行计算。这样得出的结果自然与真实结果有一定的偏差,但仍有一定的参考价值。29电解质的活度、活度系数活度 理想气体、理想溶液 理想 实际 差异 采用活度描述。
14、活度参与反应的能力。 30电解质的活度、活度系数活度系数所以上面的kT应该为表观平衡常数,用 表示。真正的平衡常数为:活度:Pitzer提出活度系数 。Tk22ZnHk iiici31电解质的活度系数活度系数计算 现有的计算混合电解质溶液中的平均活度系数的公式有皮泽精确式、皮泽简化式、弗兰克汤普桑(Frank-Thompson)弥散晶格理论、斯托凯斯罗宾桑(Stokes-Robinson)的水化理论和格柳考夫(Glueckauf)的改进的离子水化理论以及梅斯纳的半经验公式。 32电解质的活度系数活度系数计算 李以圭、陆久芳等曾用上述几种方法去计算过电解质溶液中离子的活度系数并对其准确性进行了比较。结果表明,改进了的弗兰克汤普桑方程、梅斯纳的半经验计算方法以及简化了的皮泽方程均可用于低离子强度的(I0.51mol/kg)混合电解质溶
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 控制电缆租赁合同5篇
- 秸秆收购合同书
- 货物运输承包合同
- 地砖铺贴合同
- 二零二五年度养老机构与护工人员服务合同及保密条款
- 2025年度股权激励方案实施中的股权转让及工商变更合同
- 2025年度茶叶种植基地生态旅游合作开发合同
- 2025年度绿色能源股份转让与项目运营管理合同
- 原酒购买合同范例
- 占用农田合同范例
- 消防管道清洗方案范本
- 房屋租赁合同标准版范文(4篇)
- 2025年西安印钞有限公司招聘(16人)笔试参考题库附带答案详解
- 2025年招聘会计考试试题及答案
- 4.2做自信的人 课件 2024-2025学年统编版道德与法治七年级下册
- 湖南省2023年普通高等学校对口招生考试英语试卷
- 无人机执照考试知识考题(判断题100个)
- 厨房工作人员培训课件
- 2025年教科版科学五年级下册教学计划(含进度表)
- 地磅地磅安全操作规程
- (已压缩)矿产资源储量技术标准解读300问-1-90

评论
0/150
提交评论