



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、电解与库仑分析法电解与库仑分析法electrolytic and coulometric analysis第一节第一节 电解分析原理与应用电解分析原理与应用 一、一、电解分析基础电解分析基础fundament of electrolytic analysis 二、二、理论分解电压与析出理论分解电压与析出电位电位theoretical decomposition voltage and deposited potential 三、浓差极化与电化学极三、浓差极化与电化学极化化concentration polarization and electrochemical polarization 四、
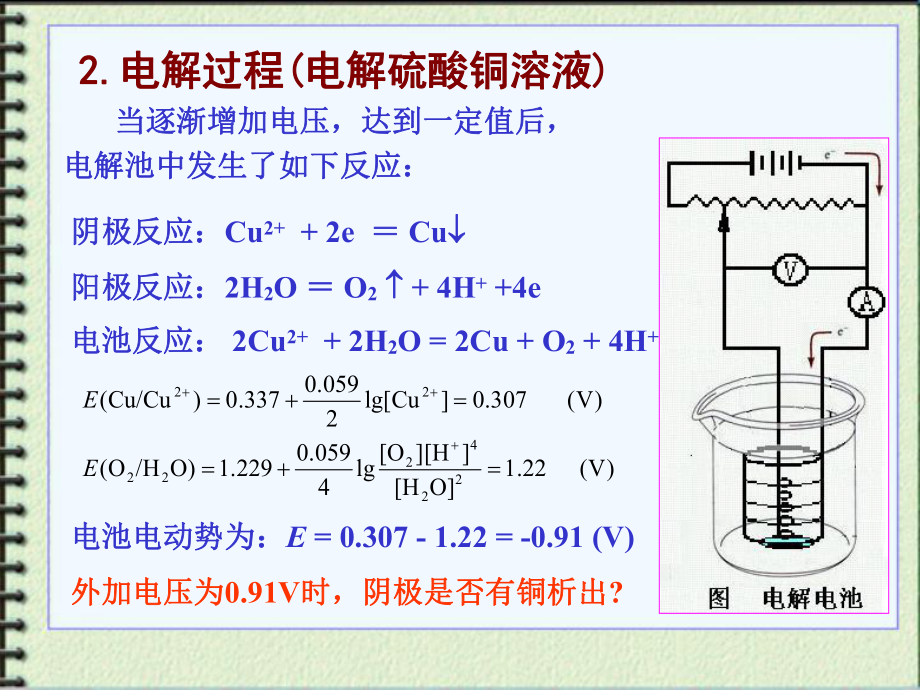
2、电重量分析与电解分四、电重量分析与电解分离离electrogravimetric analysisand electrolytic separationprinciple and applications of electrolytic analysis一、电解分析基础一、电解分析基础 fundament of electrolytic analysis1.1.电解装置电解装置电解电池:电解电池:正极正极( (阳极阳极) )负极负极( (阴极阴极) )2.2.电解过程电解过程( (电解硫酸铜溶液电解硫酸铜溶液) ) 当逐渐增加电压,达到一定值后,当逐渐增加电压,达到一定值后,电解池中发生了如下
3、反应:电解池中发生了如下反应:阴极反应:阴极反应:Cu2+ + 2e Cu 阳极反应:阳极反应:2H2O O2 + 4H+ +4e电池反应:电池反应: 2Cu2+ + 2H2O = 2Cu + O2 + 4H+电池电动势为:电池电动势为:E = 0.307 - 1.22 = -0.91 (V)外加电压为外加电压为0.91V时,阴极是否有铜析出时,阴极是否有铜析出?)V(22. 1OHHOlg4059. 0229. 1)O/HO()V(307. 0Culg2059. 0337. 0)Cu/Cu(22422222EE二、理论分解电压与析出电位二、理论分解电压与析出电位 theoretical de
4、composition voltage and deposited potential 1. 理论分解电压理论分解电压 根据能斯特方程计算,使反应进行,需要提供的最小外加电压(D点) 。2. 实际分解电压(析出电位) 实际开始发生电解反应时的电压,其值大于理论分解电压(D点)。3. 产生差别的原因产生差别的原因E外外 = (E阳阳 + 阳阳)- (E阴阴 + 阴阴) + iR 理论分解电压小于实际分解电压的原因是由于超电位的存在,但超电位是如何产生的呢? 超电位()、电解回路的电压降(iR)的存在。则外加电压应为:三、浓差极化与电化学极化三、浓差极化与电化学极化concentration po
5、larization and electrochemical polarization 产生超电位的原因:产生超电位的原因:电极极化电极极化 电极极化:电极极化:电解时,电极上有净电电解时,电极上有净电流流过时流流过时,电极电位偏离其平衡电位的电极电位偏离其平衡电位的现象。现象。 浓差极化:浓差极化: 电流流过电极,表面电流流过电极,表面形成浓度梯度。使正极电位增大,负极形成浓度梯度。使正极电位增大,负极电位减小。电位减小。 减小浓差极化的方法:减小浓差极化的方法:a.a.减小电流,增加电极面积;减小电流,增加电极面积;b.b.搅拌,有利于扩散搅拌,有利于扩散电化学极化电化学极化electro
6、chemical polarization 电荷迁越相界面的放电所需的超电位。电荷迁越相界面的放电所需的超电位。 产生的原因:电极反应速度慢,电极上聚集了一定的电产生的原因:电极反应速度慢,电极上聚集了一定的电荷。荷。四、电重量分析法与电解分离四、电重量分析法与电解分离electrogravimetric analysis and electrolytic separation 电重量分析法电重量分析法: :利用电解将被测组分从一定体积溶液中完全沉积在阴极上,通过称量阴极增重的方法来确定溶液中待测离子的浓度。1.1.恒电流电重量分析法恒电流电重量分析法 保持电流在2-5A之间恒定,电压变化,最
7、终稳定在H2的析出电位。选择性差,分析时间短,铜合金的标准分析方法。2. 2. 控制阴极电位电重量分析法控制阴极电位电重量分析法 (1)(1)三电极系统三电极系统 自动调节外电压,阴极电位保持恒定。选择性好。自动调节外电压,阴极电位保持恒定。选择性好。(2)A(2)A、B B两物质分离的必要条件两物质分离的必要条件a. Aa. A物质析出完全时物质析出完全时, ,阴极电位未阴极电位未达到达到B B物质的析出电位物质的析出电位( (图图) );b. b. 被分离两金属离子均为一价被分离两金属离子均为一价, ,析析出电位差出电位差0.35 V0.35 Vc. c. 被分离两金属离子均为二价被分离两
8、金属离子均为二价, ,析析出电位差出电位差0.20 V0.20 V 对于一价离子对于一价离子, ,浓度降低浓度降低1010倍倍, ,阴极电位降低阴极电位降低0.059 V0.059 V。 电解时间如何控制?浓度随时电解时间如何控制?浓度随时间变化关系如何?间变化关系如何? 电解时间的控制电解时间的控制 控制阴极电位电重量分析过程中如何控制电解时间控制阴极电位电重量分析过程中如何控制电解时间? ? 电流电流- -时间曲线时间曲线: :KttKtttVDAtcciieii 1010000浓度与时间关系为:浓度与时间关系为: A:电极面积;:电极面积;D:扩散系数;:扩散系数;V:溶液体积;:溶液体
9、积; :扩散层厚度:扩散层厚度电解完成电解完成99.9%99.9%所需的时间为所需的时间为: : t99.9% = 7.0V /DA电解完成的程度与起始浓度无关。与溶液体积电解完成的程度与起始浓度无关。与溶液体积V成正比,成正比,与电极面积与电极面积A成反比。成反比。 当当it/i0=0.001时,认为电解完全。时,认为电解完全。DAXVtXXccXtVDAt43. 01lg10143. 00)(所需时间为:所需时间为:电解完成电解完成 第二节第二节 库仑分析原理与应用库仑分析原理与应用 一、一、电解分析原理与过电解分析原理与过程程principal and general process o
10、f coulometric analysis 二、电量的确定二、电量的确定the quantity of electrical charge 三、电流效率与影响电三、电流效率与影响电流效率的因素流效率的因素current efficiency and factors effected on current efficiency principle and applications of coulometric analysis一、库仑分析原理与过程一、库仑分析原理与过程 库仑分析法:电极反应-电量-物质量相互关系; 库仑分析法的理论基础:法拉第电解定律; 基本要求:电极反应单纯,电流效率100
11、%。1. 1. 法拉第电解定律法拉第电解定律 法拉第第一定律法拉第第一定律: 物质在电极上析出产物的质量物质在电极上析出产物的质量W 与通过电解池的电量与通过电解池的电量Q 成正比。成正比。 法拉第第二定律法拉第第二定律:principle and general process of coulometric analysisnMFQW 式中:式中:M为物质的摩尔质量(为物质的摩尔质量(g),),Q为电量(为电量(1库仑库仑=1安培安培1秒),秒),F为法拉第常数(为法拉第常数(1F=96487库仑),库仑),n为电极反应中转移的电子数。为电极反应中转移的电子数。2.2.装置与过程装置与过程
12、(2)(2)将一定体积的试样将一定体积的试样溶液加入到电解池中,接溶液加入到电解池中,接通库仑计电解。当电解电通库仑计电解。当电解电流降低到背景电流时,停流降低到背景电流时,停止。由库仑计记录的电量止。由库仑计记录的电量计算待测物质的含量。计算待测物质的含量。 (1)(1)预电解预电解, ,消除电活消除电活性杂质。通性杂质。通N N2 2除氧。预电除氧。预电解达到背景电流解达到背景电流, ,不接通不接通库仑计。库仑计。二、电量的确定二、电量的确定 the quantity of electrical charge恒电流:恒电流: Q= i t恒阴极电位:恒阴极电位:电流随时间变化时电流随时间变
13、化时作图法:作图法:tkiQtkidtidtiQktktt303. 210)101 (303. 21000kt000可忽略,则:相当大时,当以以lgit 对对t 作图,斜率作图,斜率 k;截距;截距lg i0;要求电流效率要求电流效率100%库仑计库仑计(1)氢氧库仑计)氢氧库仑计 (电解水电解水) 1F电量产生电量产生氢气氢气11200 mL; 氧气氧气 5600 mL。 共产生共产生 16800 mL气体。气体。(2)库仑式库仑计)库仑式库仑计 电解硫酸铜水溶液。电解硫酸铜水溶液。 电解结束后,反向恒电流电解,电解结束后,反向恒电流电解, 沉积的沉积的Cu全部反应全部反应: Q = i t
14、 (3)电子积分库仑计)电子积分库仑计三、三、 电流效率与影响电流效率的因素电流效率与影响电流效率的因素current efficiency and factors effected on current efficiency 影响电流效率的因素:影响电流效率的因素:(1)溶剂的电极反应;)溶剂的电极反应;(2)溶液中杂质的电解反应;)溶液中杂质的电解反应; (3)水中溶解氧;)水中溶解氧;(4)电解产物的再反应;)电解产物的再反应;(5)充电电容。)充电电容。总样杂溶样样电流效率iiiiii第三节第三节 库仑滴定库仑滴定 一、一、库仑滴定库仑滴定 coulometric titration
15、二、二、自动库仑滴定自动库仑滴定 automated coulometric titration 三、三、微库仑分析微库仑分析 microcoulometric analysiscoulometric titration一、库仑滴定恒电流库仑分析 coulometric titration 1. 1. 控制电流的电解过程控制电流的电解过程 在特定的电解液中,以电极反应产物作为滴定剂(电生滴在特定的电解液中,以电极反应产物作为滴定剂(电生滴定剂,相当于化学滴定中的标准溶液)与待测物质定量作用;定剂,相当于化学滴定中的标准溶液)与待测物质定量作用; 借助于电位法借助于电位法或指示剂来指示滴或指示剂
16、来指示滴定终点。故库仑滴定终点。故库仑滴定并不需要化学滴定并不需要化学滴定和其它仪器滴定定和其它仪器滴定分析中的标准溶液分析中的标准溶液和体积计量。和体积计量。2.库仑滴定的特点(1) (1) 不必配制标准溶液不必配制标准溶液 简便,简化了操作过程;简化了操作过程;(2) (2) 可实现容量分析中不易实现的滴定可实现容量分析中不易实现的滴定 CuCu+ +、BrBr2 2、ClCl2 2作为滴定剂;作为滴定剂;(3) (3) 滴定剂来自于电解时的电极产物滴定剂来自于电解时的电极产物 快速,产生后立即与溶液中待测物质反应产生后立即与溶液中待测物质反应;(4) (4) 库仑滴定中的电量较为容易控制
17、和准确测量库仑滴定中的电量较为容易控制和准确测量 准确,可达可达0.2%0.2%;(5) (5) 方法的灵敏度、准确度较高。方法的灵敏度、准确度较高。 灵敏,可检测出物质量达可检测出物质量达 1010-5-5-10-10-9-9 g/mL g/mL。基准物测定;。基准物测定;(6) (6) 可实现自动滴定可实现自动滴定 易自动化3.库仑滴定的应用(1) 酸碱滴定酸碱滴定 阳极反应:阳极反应:H2O = (1/2)O2+2H+ +2e 阴极反应:阴极反应:2 H2O =H2 +2OH- -2e(2) 沉淀滴定沉淀滴定 阳极反应:阳极反应:Ag=Ag+e (Pb=Pb2+2e)(3) 配位滴定配位
18、滴定 阴极反应:阴极反应: HgY+2e = Hg+Y4-(4) 氧化还原滴定氧化还原滴定 阳极反应:阳极反应: 2Br - = Br2+2e 2I- = I2+2e库仑滴定应用二、自动库仑滴定automated coulometric titration1. 1. 钢铁试样中含碳量的自动库仑测定钢铁试样中含碳量的自动库仑测定 原理:原理:试样在试样在1200 C左右燃烧,产生的左右燃烧,产生的CO2导入高氯导入高氯酸钡酸性溶液,发生如下反应:酸钡酸性溶液,发生如下反应: Ba(ClO4) 2 + H2O + CO2 BaCO3 + 2HClO4反应后溶液的酸度增加,开始电解,产生一定量反应后
19、溶液的酸度增加,开始电解,产生一定量OH - 2H2O +2e 2OH- +H2 (阴极反应)(阴极反应)溶液恢复到原来酸度值时,停止电解。溶液恢复到原来酸度值时,停止电解。 消耗的电量消耗的电量产生的产生的OH - 量量中和的中和的 HClO4量量二摩尔的高氯酸相当于一摩尔的碳。二摩尔的高氯酸相当于一摩尔的碳。可由仪器读数装置直接读出含碳量。可由仪器读数装置直接读出含碳量。2. 污水中化学耗氧量的测定 化学耗氧量(化学耗氧量(COD)是评价水质污染程度的重要指标。)是评价水质污染程度的重要指标。它是指它是指1dm3水中可被氧化的物质(主要是有机化合物)氧化水中可被氧化的物质(主要是有机化合物
20、)氧化所需的氧量。所需的氧量。 基于库仑滴定法设计的基于库仑滴定法设计的COD测定仪原理:测定仪原理: 用一定量的高锰酸钾标准溶液与水样加热反应后,剩余用一定量的高锰酸钾标准溶液与水样加热反应后,剩余的高锰酸钾的量,用电解产生的亚铁离子进行库仑滴定:的高锰酸钾的量,用电解产生的亚铁离子进行库仑滴定: 5Fe2+ +MnO4- +8H+ = Mn2+ +5Fe3+ +4H2O 根据产生亚铁离子所消耗的电量,可确定溶液中剩余高根据产生亚铁离子所消耗的电量,可确定溶液中剩余高锰酸钾量,计算出水样的锰酸钾量,计算出水样的COD。三、微库仑分析技术microcoulometric analysis 装置:图装置:图 特点:特点: 灵敏,快速,方便灵敏,快速,方便 原理与分析过程:原理与分析过程:( 以电生以电生Ag+为例:)为例:) 含含Ag+底液的电位为底液的电位为E测测, 设:偏压为设:偏压为E偏偏, 使使: E测测 = E偏偏 , 则则: E = 0, I电解电解 = 0, 体系处于体系处于平衡。平衡。1.分析过程描述当含当含Cl-的试样进入到滴定池后的试样进入到滴定池后,与与Ag+反应生成反应生成Ag
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025至2030年中国三动作数字化聚光灯行业投资前景及策略咨询报告
- 2025至2030年中国一次性使用口腔包市场分析及竞争策略研究报告
- 2025至2030年中国Ⅴ型圈行业投资前景及策略咨询报告
- 2025至2030年中国PET按键市场调查研究报告
- 2025至2030年中国FR开边二十二瓣花南瓜行业发展研究报告
- 2025至2030年中国45°闸阀行业投资前景及策略咨询报告
- 中国古代服饰文化演变
- 2025年造丸机行业深度研究报告
- 企业文化建设与员工凝聚力增强
- 健康生活方式与个人习惯养成
- 2025年高考作文备考之热点素材解读及相关题目:高中双休
- 2024年杭州萧山环境投资建设集团有限公司招聘考试真题
- 2024年嘉峪关市招聘公安机关警务辅助人员考试真题
- 2024年中国水产科学研究院招聘笔试真题
- 2024年中央戏剧学院招聘考试真题
- 中医医生笔试试题及答案
- 湖南省2025届新高考教学教研联盟高三第一次联考一模生物试题(原卷版+解析版)
- 1688运营培训课件
- uni-app移动应用开发课件 1-初识uni-app
- 2025年湖北漳富投资集团有限公司招聘笔试参考题库含答案解析
- 箱式变电站迁移施工方案

评论
0/150
提交评论