



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
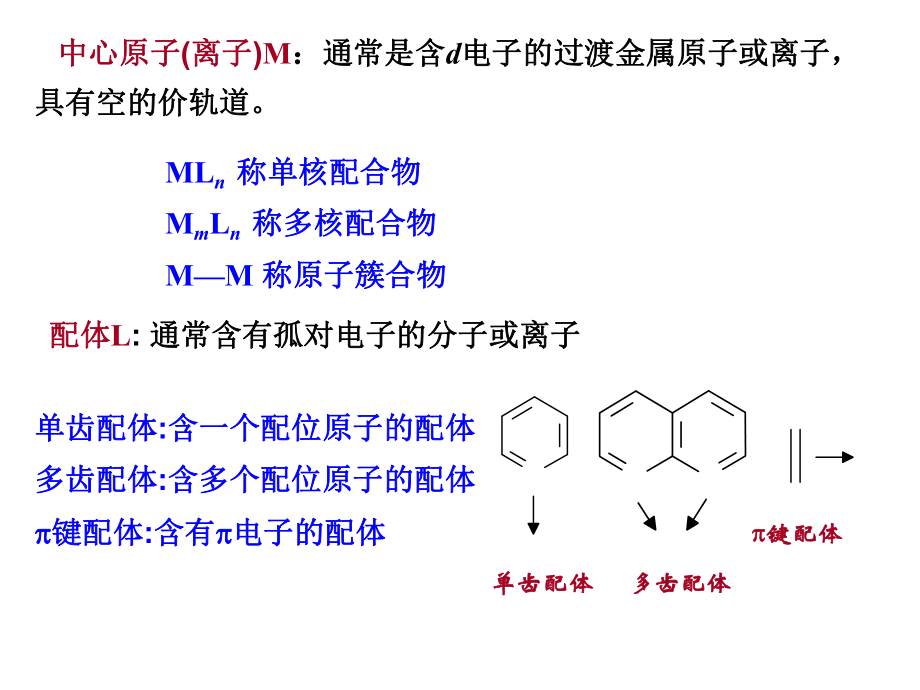
1、63 晶体场理论64 配合物的分子轨道理论65 -键和羰基配合物结构66 核磁共振Chapter 6 The structures and properties of complexes61 概述62 配合物的价键理论一、配合物一、配合物(complex)的概念的概念 配合物配合物v由中心原子由中心原子(或离子或离子)M及其周围若干个分子或及其周围若干个分子或离子作为配体离子作为配体L所组成的化合物叫配合物。所组成的化合物叫配合物。 核与配体核与配体w中心原子或离子称配合物的中心原子或离子称配合物的核核,在核的,在核的周围与核相结合的分子或离子称为周围与核相结合的分子或离子称为配配(位位)体体
2、(ligand)。 MmLn M L配位键61 概述概述 中心原子中心原子(离子离子)M:通常是含:通常是含d电子的过渡金属原子或离子,电子的过渡金属原子或离子,具有空的价轨道。具有空的价轨道。 MLn 称单核配合物称单核配合物 MmLn 称多核配合物称多核配合物MM 称原子簇合物称原子簇合物 配体配体L: 通常含有孤对电子的分子或离子通常含有孤对电子的分子或离子单齿配体单齿配体:含一个配位原子的配体含一个配位原子的配体多齿配体多齿配体:含多个配位原子的配体含多个配位原子的配体 键配体键配体:含有含有 电子的配体电子的配体单齿配体单齿配体 多齿配体多齿配体 键配体键配体解释中心离子和配体的三大
3、理论解释中心离子和配体的三大理论1、价键理论、价键理论 (Valence Bond Theory, VBT)2、晶体场理论、晶体场理论 (Crystal Field Theory, CFT)3、分子轨道理论、分子轨道理论 (Molecular Orbital Theory, MOT)本章的中心问题本章的中心问题: “: “配位键配位键”的本质的本质 6-2 配合物的价键理论配合物的价键理论(Valence Bond Theory, VBT) Pauling在在20世纪世纪30年代初提出的配合物价键理论,他年代初提出的配合物价键理论,他认为核与配体之间的化学键按认为核与配体之间的化学键按杂化轨道
4、理论杂化轨道理论可分为可分为电价配键电价配键与与共价配键共价配键两种。两种。所谓所谓“配键配键”:若两个原子共享的电子来:若两个原子共享的电子来自同一原子,则此键称为配键。自同一原子,则此键称为配键。(1)中心原子中心原子(离子离子)M有空价轨道,配体有空价轨道,配体L有孤对电子,有孤对电子,它们它们结合时,由结合时,由L提供一对电子与提供一对电子与M共享共享形成配键形成配键LM. (2)中心原子中心原子(离子离子)采用杂化轨道成键。采用杂化轨道成键。(3) 杂化方式与空间构型有关。杂化方式与空间构型有关。d2sp3正八面体dsp2正方形d4sp3 正十二面体sp2正三角形sp直线sp3正四面
5、体常见的杂化形式常见的杂化形式 例如例如FeF63, Ni(NH3)62+Ni2 d8 n=2Fe3+ d5 n=5自旋平行的电子达到可允许的最大值,称为自旋平行的电子达到可允许的最大值,称为高自旋高自旋配合物配合物中心离子采用中心离子采用sp3d2杂化杂化,呈八面体构型呈八面体构型2. 电价配键电价配键电价配合物电价配合物: : 中心离子与配体中心离子与配体(配位原子电负性较大,配位原子电负性较大,如氮、氧、卤素等如氮、氧、卤素等)以静电作用结合在一起以静电作用结合在一起, ,中心离中心离子的电子层结构保持其自由离子状态子的电子层结构保持其自由离子状态, ,采用采用spd外轨外轨杂化,是杂化
6、,是高自旋高自旋配合物。配合物。共价配合物共价配合物:中心离子的中心离子的d电子重排,空出轨道,进行电子重排,空出轨道,进行dsp内内轨杂化,接受配位体轨杂化,接受配位体(电负性较小电负性较小,如如CO、CN-、NO2-)孤对孤对电子,形成低自旋共价配合物。电子,形成低自旋共价配合物。2. 共价配键共价配键在共价配键的形成中,可设想成几个部分:在共价配键的形成中,可设想成几个部分:(1)重排重排:中央离子为了尽可能多成键,往往发生电子重排:中央离子为了尽可能多成键,往往发生电子重排,使之自旋配对,腾出空轨道,以参加杂化。,使之自旋配对,腾出空轨道,以参加杂化。(2)杂化杂化:空出的:空出的d轨
7、道与轨道与s、p轨道一起杂化。轨道一起杂化。 (3)成键成键:每个配体提供一对电子与一条杂化轨道形成一个配:每个配体提供一对电子与一条杂化轨道形成一个配建,建,因此因此 分子构型与杂化构型一致。分子构型与杂化构型一致。 例如例如Fe3+ 与六个与六个CN生成生成 Fe(CN)63 -重排 配合物中的配合物中的Fe3+的结构与自由离子不同,自旋平行的的结构与自由离子不同,自旋平行的电子数减少了,故称为电子数减少了,故称为低自旋低自旋。3d4s4p3d4s4pd2sp3杂化杂化6个个CNFe(CN)63 - 一般来说一般来说, ,M和和L的电负性差较大是的电负性差较大是呈电呈电价型价型, ,否则呈
8、否则呈共价型共价型. . enn)2( 3. 电价和共价配键的判断电价和共价配键的判断电价型与共价型的确定电价型与共价型的确定: :由未成对电子数由未成对电子数n或或磁矩磁矩 确定确定( (分子的磁矩可通过测定物质的磁分子的磁矩可通过测定物质的磁化率来确定化率来确定). ). 例如例如测得配合离子测得配合离子Fe(H2O)63+的磁距为的磁距为5.88 e 推得推得n=5,高自旋,高自旋 所以所以电价配合物电价配合物又又 例如例如测得Fe(CN)62, = 0 推得推得n=0,低自旋,低自旋 所以所以共价配合物共价配合物弱点:弱点:(1) n=1,高、低自旋无法区分;,高、低自旋无法区分; (
9、2) 配合物分电价、共价,且高自旋必电价,低自配合物分电价、共价,且高自旋必电价,低自旋必共价,与实验不符。旋必共价,与实验不符。 如如Fe(C5H7O2)33,测得测得 =5.8 e, n=5.对于三价对于三价Fe离子离子来说为高自旋,所以属于电价,但其性质又表现共价,如来说为高自旋,所以属于电价,但其性质又表现共价,如易挥发,而易溶于非极性有机溶剂。易挥发,而易溶于非极性有机溶剂。 配合物的价键理论能说明部分事实,如能解释同一配合物的价键理论能说明部分事实,如能解释同一种中央离子为何有时成高自旋,有时呈低自旋,对配合种中央离子为何有时成高自旋,有时呈低自旋,对配合物的磁性和分子的几何构型也
10、给予一定说明。物的磁性和分子的几何构型也给予一定说明。 4. 价键理论的评估价键理论的评估6-3 配合物的晶体场理论配合物的晶体场理论(Crystal Field Theory, CFT) 晶体场理论是静电作用模型晶体场理论是静电作用模型, ,把中心离子和配体的相把中心离子和配体的相互作用看作类似离子晶体中互作用看作类似离子晶体中正负离子的点电荷静电正负离子的点电荷静电作用。中心离子处在配体所组成的场作用。中心离子处在配体所组成的场(晶体场晶体场)中。中。一、基本要点一、基本要点: : 2. 由于由于d轨道的对称性不同轨道的对称性不同, ,当当L接近接近M时时, , 简并的简并的d轨轨道将发生
11、能级分裂。道将发生能级分裂。由于配体场的对称性不同由于配体场的对称性不同, ,发发生的能级分裂也不同。生的能级分裂也不同。3. 能级的分裂能级的分裂, ,引起电子重新排布不同引起电子重新排布不同, ,获得获得晶体场稳晶体场稳定化能定化能(CFSE), ,使配合物的总能量下降。使配合物的总能量下降。19291935年由年由Bethe(贝特贝特)和和Van Vlek(范弗莱克范弗莱克)提出。提出。+xydxy+dyzyz+dxzxz+ +dz2xz+dyx22yx二、二、d轨道的能级分裂轨道的能级分裂d轨道角度分布图轨道角度分布图:(1)d轨道能级的分裂轨道能级的分裂 配体所形成的负电场对中心配体
12、所形成的负电场对中心d电子起作用,电子起作用,消除消除d轨道的简并轨道的简并。这种现象叫。这种现象叫d轨道的能级在配位场中轨道的能级在配位场中发生了分裂。发生了分裂。对于不同的配位场,对于不同的配位场,d轨道分裂的情况是不同的。轨道分裂的情况是不同的。 在正八面体配合物中,金属离子位于八面体中心,在正八面体配合物中,金属离子位于八面体中心,六个配位体分别沿着三个坐标轴正负方向接近中央离子六个配位体分别沿着三个坐标轴正负方向接近中央离子。(i) 正八面体配位场正八面体配位场(Oh):分裂的根源分裂的根源:(1)d轨道具有明显的角度分布。轨道具有明显的角度分布。(2)d轨轨道所在的配位场不是球形对
13、称的。道所在的配位场不是球形对称的。d 轨道能级分裂情况:轨道能级分裂情况:eg自由离子自由离子d轨道轨道 球形场球形场Es10Dqt2g),(yzxzxyddd),(222zyxdd八面体场八面体场分裂能分裂能 分裂能分裂能(o):1个电子从较低能量个电子从较低能量d轨道跃迁到较高轨道跃迁到较高能量能量d轨道所需的能量。轨道所需的能量。量子力学原理指出:量子力学原理指出:不论晶体场的对称性如何,受到相互作用的不论晶体场的对称性如何,受到相互作用的d轨道的轨道的平均能量是不变的,为球形场作用产生的平均能量是不变的,为球形场作用产生的Es能级,习能级,习惯将惯将Es取作取作0点;点;则有E(eg
14、)E(t2g)=10Dq2E(eg)+3E(t2g)=0 解之解之,有有E(eg) =6Dq, E(t2g)=4Dq 在八面体场中,在八面体场中,d 轨道分裂的结果是:与轨道分裂的结果是:与Es相比,相比,eg轨道能量上升了轨道能量上升了6Dq,而,而t2g轨道能量下降了轨道能量下降了4Dq。 可见可见yxd(x2y2)(ii) 正四面体正四面体(Td): 立方体的立方体的中心是金属离子中心是金属离子,八个角上每隔一个角上放一,八个角上每隔一个角上放一个配位体,即可得正四面体配合物。个配位体,即可得正四面体配合物。yx dxy配体受dx2-y2,dz2的排斥力小,受dxy,dyz,dzx的排斥
15、力相对大。在四面体场中d轨道也分裂成两组: 可见eddtdddzyxxzyzxy记为能量较低二组记为能量较高一组 , : , : 2222在其它条件相同时在其它条件相同时ot94可以证明可以证明配体相同及与中心配体相同及与中心离子距离相同离子距离相同自由离子d 轨道球形场Es四面体场Td场中d轨道能级的分裂图et2ot94 可见可见 在四面体场中,在四面体场中,d轨道分裂结果是:相对轨道分裂结果是:相对Es而言,而言,t2轨道能量上升了轨道能量上升了1.78Dq,而而e e轨道下降了轨道下降了2.67Dq。(iii) 平面正方形平面正方形在平面正方形配合物中,四个配位体沿x、y方向与中央离子接
16、近d(x2y2) 平面正方形中的平面正方形中的d(x2y2) )和和dxy轨道轨道dxy在正方形场中轨道能级的分裂图在正方形场中轨道能级的分裂图球对称场球对称场 正方形场正方形场d22yxdxydyzxzdd ,2zdd 轨道在各种配位体场中的能级分裂轨道在各种配位体场中的能级分裂四面体场四面体场 球对称场球对称场 八面体场八面体场 正方形场正方形场2tedgegt222yxdxydyzxzdd ,2zd能级分裂大小能级分裂大小, ,随不同的配体和中心原子的性质而异随不同的配体和中心原子的性质而异经验规则经验规则: :(1) 对同一金属原子对同一金属原子,不同的配体时不同的配体时COCN NO
17、2 enNH3pyEDTAH2OC2O42 OH F SCN Cl Br I 若只看配体的单个配位原子若只看配体的单个配位原子,随原子序数增大而减小随原子序数增大而减小:C N O F S Cl Br I -光谱化学序列光谱化学序列 一般:一般:NH3以前的称为强场;以前的称为强场;H2ONH3之间的称之间的称为中间场;为中间场;H2O以后的称为弱场。以后的称为弱场。(2) 对同一的配体对同一的配体, , 分裂能随金属原子的不同而异分裂能随金属原子的不同而异: :(i) 同一金属原子随价数的升高而增大同一金属原子随价数的升高而增大(ii) d电子数相同电子数相同,价数相等的离子价数相等的离子,
18、随周期数增大而增大随周期数增大而增大 1362126218600)(9300)(cmOHCocmOHCo1363136333900),5()(23000),4()(cmnNHRhcmnNHCo第一系列过渡金属第一系列过渡金属 第二系列过渡金属第二系列过渡金属 P时时,强场强场, E(I)E(II), 低自旋低自旋当当 P时时,弱场弱场, E(I)E(II), 高自旋高自旋对于八面体的对于八面体的d4组态组态:高高 93006H2O22500Co2+ d7高低高6NH321000Co3+ d6 d56H2O23500Cr2+ d4观测的推测的高高13900高高21000
19、6H2O28000Mn3+高高 78006H2O25500Mn2+高低高低10400330006H2O6CN17000Fe2+高高137006H2O30000Fe3+自旋状态 cm1配位体Pcm1离子组态表表 某些八面体配合物的自旋状态某些八面体配合物的自旋状态(1) 八面体配合物中八面体配合物中d电子的排布电子的排布 当当oP时,时,即强场的情况下,电子尽可能占据即强场的情况下,电子尽可能占据低能的低能的t2g轨道。轨道。注意:注意:d1,d2,d3,d8,d9和和d10无高低自旋之分,仅无高低自旋之分,仅d4,d5,d6和和d7有。有。 d1 d2 d3 d4 d5 d6 d7 d8 d9
20、 d10egt2g当o P时,即弱场的情况下,电子尽可能分占五个d轨道。egt2gd1 d2 d3 d4 d5 d6 d7 d8 d9 d10(2)四面体配合物中四面体配合物中d电子的排布电子的排布在相同的条件下,在相同的条件下,d轨道在四面体场作用下的分裂轨道在四面体场作用下的分裂 能能只是八面体作用下的只是八面体作用下的4/9,这样分裂能是小于成对,这样分裂能是小于成对能的。因而四面体配合物大多能的。因而四面体配合物大多是高自旋配合物是高自旋配合物。d电子的具体排布情况如下:电子的具体排布情况如下:tet2d1 d2 d3 d4 d5 d6 d7 d8 d9 d10四、晶体场稳定化能四、晶
21、体场稳定化能(crystal field stabilization energy, CFSE)1 定义定义: d电子从未分裂的电子从未分裂的d轨道轨道进入分裂的进入分裂的d轨道所产生轨道所产生的总能量下降值的总能量下降值,称为晶体场稳定化能,并用,称为晶体场稳定化能,并用CFSE表示。表示。CSFE越大,配合物也就越稳定。越大,配合物也就越稳定。 2 CSFE的计算的计算轨道中的电子数:轨道中的电子数:ggentn221CFSE=(-4n1+6n2)Dq+(m1-m2)P轨道中的成对电子数:球形体场中,轨道中的成对电子数:八面体场中,dmdm21八面体场八面体场(i) 在弱八面体场中,在弱八
22、面体场中,d电子取高自旋电子取高自旋, ,d6为为Es6Dq4Dqt2gegCSFE = ( 4 4 + 2 6) Dq = 4 Dq(t2g)4(eg)2:(ii) 在强八面体场中,在强八面体场中,d电子取低自旋电子取低自旋Es6Dq 4Dqt2geg 可求:CFSE = 64 Dq 2P = 24 Dq 2 Pd6 为为(t2g)6(eg)0(iii) 在四面体场中,均为弱场高自旋,在四面体场中,均为弱场高自旋,d6为为e3t23:t=(4/9)10Dq(2/5)t(3/5)tDqDqDqCFSE7.2109452310945331. 1. 配合物的紫外可见光谱配合物的紫外可见光谱 由于配
23、合物中的由于配合物中的d轨道能级有高低之分,可发生轨道能级有高低之分,可发生d-d跃跃迁,实验结果表明,迁,实验结果表明,值的大小是在值的大小是在10000cm- 1 30000cm-1之间,可估计频率在之间,可估计频率在近紫外近紫外和和可见光谱区可见光谱区,所,所以过渡金属配合物一般都有颜色,而颜色的变化显然与以过渡金属配合物一般都有颜色,而颜色的变化显然与值有关。值有关。(当全空、半充满、全充满时无色当全空、半充满、全充满时无色) Fe(H2O)63+和和Fe(H2O)62+的的值分别为值分别为13700cm-1和和10400cm-1,故在浓度相同时前者的颜色故在浓度相同时前者的颜色比后者
24、要偏红。比后者要偏红。五、应用五、应用 例例12 热力学稳定性热力学稳定性 第一系列过渡元素二价离子的水合物第一系列过渡元素二价离子的水合物M(H2O)62+的水化热的水化热(H)。金属离子从气态溶于水所产生的热量为水化热。金属离子从气态溶于水所产生的热量为水化热。 例例2Cu2+水溶液呈浅蓝色,当加入水溶液呈浅蓝色,当加入NH3后呈深蓝色后呈深蓝色 Cu(H2O)42+4 NH3Cu(NH3)42+4 H2O Cu2+水溶液吸收红光呈浅蓝色,加入水溶液吸收红光呈浅蓝色,加入NH3后配体由后配体由H2O变为变为NH3,增大,使吸收峰波长变短,吸收橙色,变为深蓝色。增大,使吸收峰波长变短,吸收橙
25、色,变为深蓝色。 例例3硅胶干燥剂常加入硅胶干燥剂常加入CoCl2(蓝色蓝色),吸收水份后变为吸收水份后变为CoCl26H2O呈红色,试解释之呈红色,试解释之。 Co2+有有d7结构。结构。Co2+ 受配体影响发生受配体影响发生d-d跃迁而显蓝色。吸水之跃迁而显蓝色。吸水之后的配体为后的配体为H2O,形成,形成Co(H2O)6Cl2, 由于由于H2O的场强大于的场强大于Cl- -,增大,增大, 使吸收峰波长变短,使呈现红色。使吸收峰波长变短,使呈现红色。M2+ + 6H2O(l)M(H2O)62+ (- H) 放 热 核电荷增加,3d电子壳层缩小,带极性的水分子和离子间距离减小,水化作用增大,
26、水合热(H)循序上升,成平滑曲线,但实验得到的是双峰曲线双峰曲线。中心离子d轨道在H2O配体弱场的作用下发生了分裂,产生了CFSE。CFSE越大,表明配合物越稳定,水合时放出的热量越多,H越大。Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn140016001800200022002400 H/KJ.mol1水化热与水化热与d电子数的关系电子数的关系M:Ca2+,Sc2+, Ti2+, V2+, Cr2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+d: 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 d1 d2 d4 d5 d6 d7
27、 d9 d10一般来说,同一周期中同价的过渡金属离子一般来说,同一周期中同价的过渡金属离子, ,在弱八面场在弱八面场的作用下,高自旋配合物的热力学稳定性有下列次序:的作用下,高自旋配合物的热力学稳定性有下列次序:3 离子半径离子半径 过渡金属二价离子半径随核电荷增加,过渡金属二价离子半径随核电荷增加,3d电子数电子数也增加也增加,离子半径应单调下降。实验得到的是离子半径应单调下降。实验得到的是向下双向下双峰曲线峰曲线(HS),向下单峰曲线向下单峰曲线(LS) 。第一系列过渡金第一系列过渡金属离子属离子M2+ (a)和和M3+ (b)的离子半的离子半径径 HS态态:向下双峰向下双峰LS态态:向下
28、单峰向下单峰 1937年,年,Jahn和和Teller指出:指出:在对称的非线性分子中,在对称的非线性分子中,如果一个体系的状态有几个简并能级,则是不稳定的,如果一个体系的状态有几个简并能级,则是不稳定的,体系一定要发生畸变,使一个能级降低,一个能级升体系一定要发生畸变,使一个能级降低,一个能级升高,消除这种简并性。高,消除这种简并性。这就是关于配合物发生变形的这就是关于配合物发生变形的姜姜- -泰勒效应。泰勒效应。 4、姜姜- -泰勒泰勒(Jahn-Teller)效应效应 实验证明,配位数为六的过渡金属配合物并非都是正实验证明,配位数为六的过渡金属配合物并非都是正八面体八面体 d9组态的配合
29、物不是正八面体构型,组态的配合物不是正八面体构型, 状态有可能状态有可能出现两种排布情况:出现两种排布情况: 362)()(gget能量相同,简并度为能量相同,简并度为2 这是不稳定的状态,体系一定要发生畸变,使这是不稳定的状态,体系一定要发生畸变,使一个能级降低,一个能级升高,消除这种简并性。一个能级降低,一个能级升高,消除这种简并性。21621262)()()()()()()()(222222zyxgzyxgddtbddta由由d10d9时,若去掉的是时,若去掉的是(dx2-y2)电子,则)电子,则d9的结构的结构为为(t2g)6(dz2)2(dx2-y2)1。这样就。这样就减少了对减少了
30、对x,y轴配位体的推轴配位体的推斥力;从而斥力;从而x,y上四个上四个配体内移,配体内移,形成四个短键形成四个短键, ,二二个长键个长键(拉长的八面体构型拉长的八面体构型) 。因为四个短键上的配体对因为四个短键上的配体对dx2-y2斥力大,故斥力大,故dx2-y2能级上升,能级上升,dz2能级下降。这就使得原先能级下降。这就使得原先简并的简并的eg一个上升,一个下降。一个上升,一个下降。(a)(a)xy 若去掉的是若去掉的是(dz2)1电子,电子,则则d9的结构为的结构为(t2 g)6(dx2-y2)2(dz2)1,减小了对,减小了对z上上两个配体的斥力,使两个配体的斥力,使 z的的两个配体内
31、移,两个配体内移,形成两个短形成两个短键,四个长键(压扁的八面键,四个长键(压扁的八面体构型体构型),结果,结果dz2轨道能级轨道能级上升,上升,dx2-y2轨道能级下降,轨道能级下降,消除了简并性。消除了简并性。(b)(b)xy详细的计算和详细的计算和实验表明四个实验表明四个短两个长键的短两个长键的构型构型(a)比较稳比较稳定定,说明两个,说明两个状态并非简并。状态并非简并。一般情况下以一般情况下以拉长拉长为多。为多。(a)(a)(b)(b) 比较比较在高能的在高能的eg轨道上出现简并态,变形较大轨道上出现简并态,变形较大-大畸变大畸变在低能的在低能的t2g轨道上出现简并态,变形较小轨道上出
32、现简并态,变形较小-小畸变小畸变 平面正方形配合物可看作八面体被拉长的极限情况平面正方形配合物可看作八面体被拉长的极限情况如如d8离子的离子的Ni2+,Pt2+易生成平面正方形低自旋易生成平面正方形低自旋配合物配合物:(t2g)6(dz2)2(dx2-y2)0 凡是有几种可能排布的,都会发生畸变。凡是有几种可能排布的,都会发生畸变。例:在CuCl2晶体中,Cu2+周围有六个Cl-配位, 实验测得其中四个CuCl键长为230pm, 另外两个键长为295pm,试解释之 但不能解释配合物的高低自旋本质问题但不能解释配合物的高低自旋本质问题, ,即不能即不能解释配位场的强弱之分。解释配位场的强弱之分。
33、原因原因: :晶体场只考虑金属与配体之间的点电荷的晶体场只考虑金属与配体之间的点电荷的静电作用静电作用, ,而没有考虑它们之间的共价结合而没有考虑它们之间的共价结合, ,即中即中心金属原子和配体轨道之间的重叠作用。心金属原子和配体轨道之间的重叠作用。 六、晶体场理论的评估六、晶体场理论的评估晶体场理论较好的解释了配合物的颜色、磁性、晶体场理论较好的解释了配合物的颜色、磁性、立体构型、热力学性质和配合物畸变等问题。立体构型、热力学性质和配合物畸变等问题。6-4 配合物的分子轨道理论配合物的分子轨道理论(Molecular Orbital Theory, MOT)配合物的分子轨道理论与晶体场理论不
34、同,考虑了原配合物的分子轨道理论与晶体场理论不同,考虑了原子轨道的重叠即共价键的形成,认为:子轨道的重叠即共价键的形成,认为:对称性一致的对称性一致的原子轨道线性组合成配合物的分子轨道原子轨道线性组合成配合物的分子轨道-离域分离域分子轨道。子轨道。(1) 找出组成分子的各个原子轨道,并按照对称性分类找出组成分子的各个原子轨道,并按照对称性分类(2) 根据对称性匹配原则,由原子轨道线性组合成分子轨根据对称性匹配原则,由原子轨道线性组合成分子轨道,按分子轨道能级高低构成轨道能级图道,按分子轨道能级高低构成轨道能级图(3) 电子遵循能量最低原理、泡利原理、洪特规则逐一填入分电子遵循能量最低原理、泡利
35、原理、洪特规则逐一填入分子轨道子轨道分子轨道形成过程分子轨道形成过程: :一、一、 分子轨道分子轨道第一系列过渡金属离子和六个配体形成的第一系列过渡金属离子和六个配体形成的八面体八面体配合物配合物dddxzyzxy3 ,3 ,3pppsddzyxzyx44 ,4 ,4 ,3 ,3,222t2gega1gt1u极大值方向夹在轴间,形极大值方向夹在轴间,形成以面为对称的成以面为对称的 型轨道型轨道极大值方向沿极大值方向沿x,y,z轴指向配轴指向配体,可形成以轴为对称的体,可形成以轴为对称的 型轨道型轨道配位体配位体 轨道:轨道:单原子配体,如F-、Cl-可以提供轨道;双原子分子配体有最高占据的轨道
36、,例:N2的3g,CO的5,它们的共同特点是有伸向分子外侧的电子云,容易与中心离子的型轨道重叠形成键;多原子分子配体如NH3,H2O有孤对电子轨道。 这六个原子轨道和六个配位体这六个原子轨道和六个配位体L的的 型轨道进行线性组合,型轨道进行线性组合,形成形成 键键S +3+2+5+4+1+6yzx中心原子S轨道6个配体的原子轨道12Px-+yzx6543211 sag653143212111)()()(zuyuxuptptpt-yzx+-+yzx+4321122)(yxgde432165222)(2zgde八面体配合物分子轨道能级图八面体配合物分子轨道能级图DqEEggte1002反键MO非键
37、MO成键MO配位体群轨道分子轨道受配位场微扰的原子轨道 t2g eg t1ua1g t2g ega1g t1uspd金属配合物配位体ag1tu1eg分子轨道理论不象晶体场理论那样只考虑静电作用。也得到分子轨道理论不象晶体场理论那样只考虑静电作用。也得到了了d轨道能级分裂,说明配位场效应是适应于过渡金属配合物轨道能级分裂,说明配位场效应是适应于过渡金属配合物的一般原理。的一般原理。其差别在于其差别在于:在晶体场理论中:EEggte20分子轨道理论中:EEggte20遇到中性配体,例如遇到中性配体,例如N2、CO等与中性原子结合而成的配合物,等与中性原子结合而成的配合物,晶体场理论完全失效,只有用
38、分子轨道理论加以说明。晶体场理论完全失效,只有用分子轨道理论加以说明。 例例:在在FeF63和和Co(NH3)63中可认为中可认为6个成键分子轨道个成键分子轨道由六个配位体的由六个配位体的12个电子所占用。个电子所占用。 前者分裂能前者分裂能o小于成对能小于成对能P-弱场,后者弱场,后者o大于成对能大于成对能P-强场。强场。 t2g eg t1ua1g t2g ega1g t1u4p3dFe3+6F-4sFeF63ag1tu1eg结论:结论:5个个d电子分别占用三个电子分别占用三个t2g及两个及两个eg* *轨道,形成高自旋轨道,形成高自旋配合物,这相当于弱晶体场作用的结果。配合物,这相当于弱
39、晶体场作用的结果。结论:结论:6个个d电子刚好占用三个电子刚好占用三个t2g 金属轨道,故是低自旋配合物,金属轨道,故是低自旋配合物,这与晶体场理论中强场作用相一致。这与晶体场理论中强场作用相一致。 t2g eg t1ua1g t2g ega1g t1u4p3dCo3+6NH34sCo(NH3)63egag1tu1二、二、 分子轨道分子轨道 金属离子的金属离子的t2g(dxy,dxz,dyz)轨道虽不能与配体的轨道虽不能与配体的 轨轨道形成有效分子轨道,但若配体有道形成有效分子轨道,但若配体有 型轨道时,还是可型轨道时,还是可以重叠形成以重叠形成 键。键。 配位体所提供的配位体所提供的 轨道可
40、以是配位原子的轨道可以是配位原子的p或或d原子轨原子轨道,也可以是配位基团的道,也可以是配位基团的 和和 *分子轨道。分子轨道。+ + + - - - C C O O + + + - - - + - + -中心离子中心离子t2g轨道之一与配位体轨道之一与配位体p,d, *轨道的键合作用轨道的键合作用根据配体性质的不同,有两种不同类型的根据配体性质的不同,有两种不同类型的 配键配键1 充满电子的充满电子的 轨道轨道,且且E Et2g: 0 eg* t2g中心离子的中心离子的d d轨道轨道0配位体轨配位体轨道道: : 高高, ,空空MO 配体配体 轨道轨道* eg*如如Co(CN)64-就属于这类
41、配合物就属于这类配合物而NH3,H2O等分子与中心离子只能形成 键,不能与M形成键,是中间场中间场。一、一、金属羰基配位化合物和小分子配位化合物金属羰基配位化合物和小分子配位化合物6-5 - 键和几种特殊配合物的结构键和几种特殊配合物的结构 CO几乎可以和全部的过渡金属(除锆和铪以外)以-配键形成稳定配合物叫羰基配合物羰基配合物。如 Fe(CO)6、Os(CO)5、 Cr(CO)6、Co2(CO)8等。羰基配合物中金属可以是零价零价甚至是负价负价。2. 18电子结构规则电子结构规则: 每个金属原子的价电子数与它周围配体提供的每个金属原子的价电子数与它周围配体提供的价电子数之和为价电子数之和为1
42、8,分子呈反磁性分子呈反磁性。 Ni(CO)4 (3d84s2,Td), Fe(CO)5 (3d64s2,D3h), Cr(CO)6 (3d54s1,Oh), Co2(CO)8 (3d74s2,CoCo),Mn2(CO)10 (3d54s2,MnMn)等。等。羰基配位化合物的特点羰基配位化合物的特点:1. CO分子的分子的C原子的一端与金属原子成键原子的一端与金属原子成键,M C O三个原子在一直三个原子在一直线上线上;羰基配位化合物羰基配位化合物的结构只能用分子轨道理论解释的结构只能用分子轨道理论解释实验表明,羰基实验表明,羰基 配合物中配合物中CO主主要是以端基配位要是以端基配位-CO3
43、+-CO+5 +-4 +-2 CO 1 O电负性大,不易电负性大,不易给出电子。给出电子。电子云在电子云在C-O之间,之间,不易给出。不易给出。空空能对中心离能对中心离子给予电子子给予电子而形成而形成 键键+-侧基配位COM端基 配位OCM5 1 )5)(1)(4)(3)(2)(1(242222CO:例6COCrCr原子的电子结构为原子的电子结构为3d54s1,它采用,它采用d2sp3杂化,指杂化,指向八面体的六个顶点,每个杂化轨道接受一个向八面体的六个顶点,每个杂化轨道接受一个CO分子的分子的5 电子对,形成电子对,形成正常的正常的 配键配键。+OCOCCrCr Cr的的dxy与与CO的的2
44、 *是对称匹配的,它们再组成是对称匹配的,它们再组成 分分子轨道。而由原子轨道。而由原dxy上的一对电子占据上的一对电子占据 轨道,相当于轨道,相当于电子由电子由CrCO的空的空 轨道轨道,这样的键叫,这样的键叫反馈反馈 键键 + + - -Cr+ -C-+O +- Cr -O+-C dxy2反馈键在Cr(CO)6中既有配键,又有反馈键,这两种键合在一起,称为 - 键键,亦称电子授受键电子授受键 - - 电子授受配键电子授受配键 C C O O: : C C O O: : Cr+Cr dxyd2sp352 - 键 中心金属和配位体之间配键和反馈键的形成是同时进行的,而且配键的形成增加了中心原子
45、的负电荷,对反馈键的形成更加有利,反馈键的形成则可减少中心原子的负电荷,对配键的形成更加有利。两者互相促进,互相加强,这就是协同效应协同效应。协同效应协同效应1、加强了中心金属和配体之间的结合。因为两者加强了中心金属和配体之间的结合。因为两者之间除了有之间除了有 配键外,还有反馈配键外,还有反馈 键。造成了中心金键。造成了中心金属和配位体间的双重键,使互相结合更加牢固属和配位体间的双重键,使互相结合更加牢固2、削弱了配体内部的结合削弱了配体内部的结合二、不饱和烃配合物二、不饱和烃配合物 许多不饱和的有机化合物分子或离子与低价氧化态许多不饱和的有机化合物分子或离子与低价氧化态的过渡金属例如的过渡
46、金属例如Cu+,Ag+,Pt2+等形成的配合物。等形成的配合物。其成键的特点:其成键的特点: 配体的配体的成键成键 电子电子填入中心原子的空轨道形成填入中心原子的空轨道形成 键键,配体,配体又以空的又以空的反键反键 * * 轨道轨道参与参与反馈反馈 键键的形成,总的的形成,总的形成形成 - 键键,因此这类配合物又称为因此这类配合物又称为 配合物配合物。1 烯、炔配合物烯、炔配合物 1827年年蔡斯蔡斯(Zeise)制得的第一种配合物是:KPtCl3(C2H4)H2O ClClClCCHHHHPt2+PtCl3(C2H4)-结构结构Pt2+(d8)与与3个氯原个氯原子处于同一个平子处于同一个平面
47、上,此平面与面上,此平面与乙烯所在的平面乙烯所在的平面垂直。垂直。PtCCdxzdsp2+-+-形成形成 - 键键+-2 环状共轭烯烃的金属配合物环状共轭烯烃的金属配合物PhPhPh22 C3Ph3+ C4H42 C5H5 C6H6 C7H7+ C8H82 2e 6e 6e 6e 6e 10e 一些平面构型对称多烯的构型和一些平面构型对称多烯的构型和 电子数电子数 许多环状共轭烯烃具有离域键的结构,离域键可以作为一个整体和中心金属原子通过多中心键形成配位化合物。+-重叠式重叠式(气态气态): D5h交错式交错式(固态固态): D5d1951年合成的第一个环状共轭多烯金属配合物二茂铁二茂铁 其它
48、过渡金属和环戊二烯基也能形成类似结构,如:Ru(C5H5)2、Co(C5H5)2、Mn(C5H5)2等;过渡金属与苯基也可以形成三明治化合物,如二苯铬Cr(C6H6)2等;环烯烃(3元环、4元环直至7、8元环)都能与过渡金属形成这种夹心化合物,但以5元环,6元环为最常见;也可以是混合环体系,如Ti(C5H5)(C3Ph3)、 (C5H5)V(C7H7);有些是金属与一个环烯基配位,再与三个羰基配位,例如Cr(C6H6)(CO)3 6-6 、核自旋与核磁矩、核自旋与核磁矩1. 核自旋角动量核自旋角动量 核和电子一样,也有自旋运动,称为核自旋。核自旋也要产生自旋角动量核和电子一样,也有自旋运动,称
49、为核自旋。核自旋也要产生自旋角动量 ) 1( IIMNI 为核自旋量子数为核自旋量子数 核自旋角动量在核自旋角动量在Z轴轴(磁场磁场)方向上的分量是量子化的方向上的分量是量子化的 INzmMm1为核自旋磁量子数为核自旋磁量子数-I, -(I+1),-(I+2)+I,共共2I+1个取值个取值 I 的取值随原子核而定,不同的核有不同的的取值随原子核而定,不同的核有不同的I :(1) 质量数为奇数,质量数为奇数, I =半整数半整数,1H:I =1/2(2) 质量数、原子序数为偶数质量数、原子序数为偶数, I = 0, 12C,16O: I = 0(3) 质量数为偶数、原子序数为奇数质量数为偶数、原
50、子序数为奇数, I =整数整数,2H: I =1 2. 核磁矩核磁矩核磁矩和自旋角动量之间的关系:核磁矩和自旋角动量之间的关系: ) 1() 1(22IIgIImegMmegNNpNNPNN(1)和(3)可作为NMR的研究对象。以(1)类中的1H,13C,19F,31P等核的核磁共振研究最多。pNmeh4为为Bohr核磁子核磁子(H的核磁子的核磁子=5.0508 10-27 J/T)注意区别:注意区别: 电子产生的磁矩与角动量的方向相反,而核的电荷为正,电子产生的磁矩与角动量的方向相反,而核的电荷为正,它们的方向相同它们的方向相同。二、核磁共振条件二、核磁共振条件1. 在外磁场中,核磁能级的分
51、裂在外磁场中,核磁能级的分裂外磁场外磁场B与核磁矩与核磁矩 N有相互作用,作用能为有相互作用,作用能为 E = N B cos 设设z方向为外磁场方向方向为外磁场方向: mp为核质量,为核质量,gN为核的为核的g因子因子(质子的质子的g因子因子=5.5854)BmgBmmegBMmegEINNIpNNZPN22由于由于mI有有2I+1个取值,故在外磁场中能级分裂成个取值,故在外磁场中能级分裂成2I+1个:个: 如质子如质子I = 1/2,mI = 1/2,1/2。BgBgBgENNNNNN)21()21(EmI =1/2mI =1/2自旋磁自旋磁矩矩与外磁场方向相同与外磁场方向相同的的吸收能量
52、后可以跃迁到吸收能量后可以跃迁到较高能级,磁旋变为与外磁较高能级,磁旋变为与外磁场方向相反场方向相反入射电磁辐射可以有效的提供能量当辐射能恰好等于跃入射电磁辐射可以有效的提供能量当辐射能恰好等于跃迁所需要能量时,即迁所需要能量时,即E辐辐= hv =E,就会发生这种自旋取,就会发生这种自旋取向的变化,即向的变化,即核磁共振核磁共振2. 选律与共振条件选律与共振条件 (1) 选律: 1ImBgEhNNhBgNN(2) 共振条件: 对于某种指定的核,其共振吸收的频率与外加磁场的磁感应强度B成正比。B越大,造成核磁能级分裂越大,相应能级间隔也越大,核磁共振所需吸收的频率也越大。3. 质子共振频率质子
53、共振频率若外磁场强度:B = 1.4092 T, MHzHzhBgNN60106010626. 64092. 1100508. 55854. 563427即在外磁场为即在外磁场为60兆赫时质子能级跃迁,产生质子共振谱。兆赫时质子能级跃迁,产生质子共振谱。4. 化学位移化学位移 以上的共振条件只考虑以上的共振条件只考虑孤立的质子孤立的质子,若考虑分子中的质子,若考虑分子中的质子,则核外电子产生附加反方向的磁场则核外电子产生附加反方向的磁场B,因此质子实际上所受到,因此质子实际上所受到的的磁场强度磁场强度应该是:应该是: B = B0-B0 = (1-)B0 为屏蔽常数,它表征为屏蔽常数,它表征分
54、子中核外电子对核的分子中核外电子对核的磁屏蔽作用磁屏蔽作用 hBgNN)1 ( 共振条件:共振条件: 通常采用扫场法:固定频率,改变磁场:通常采用扫场法:固定频率,改变磁场:)1 (NNghB目前核磁共振有两种操作方式: 固定磁场(扫频法) 固定辐射频率(扫场法).分子中质子的连接方式不同,通常说它的化学环境化学环境不同,即不同,就有不同的核磁共振峰,该峰与裸露质子的共振峰位置的差称为化学位移化学位移 661010参参参参iiiBBB化学位移表示化学位移表示: 为了突出为了突出化学环境化学环境对质子峰的影响,又便于比较和应对质子峰的影响,又便于比较和应用,通常采用无量纲的用,通常采用无量纲的这个相
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024年白银市特岗教师招聘考试真题题库附答案
- 2024年黑河学院辅导员招聘备考题库附答案
- 2025天津市公务员考试数量关系专项练习题及答案参考
- 水盆工保密意识测试考核试卷含答案
- 电法勘探工岗前成果考核试卷含答案
- 幻灯机与投影机维修工安全实操考核试卷含答案
- 排水管道工安全行为能力考核试卷含答案
- 固体化妆品制造工安全知识能力考核试卷含答案
- 硝酸铵结晶造粒工保密竞赛考核试卷含答案
- 2024年湖北大学知行学院辅导员招聘考试真题汇编附答案
- 04S519小型排水构筑物1
- 光纤激光打标机说明书
- 劳动者个人职业健康监护档案
- 《两角和与差的正弦、余弦、正切公式》示范公开课教学PPT课件【高中数学人教版】
- 治理现代化下的高校合同管理
- 境外宗教渗透与云南边疆民族地区意识形态安全研究
- GB/T 28920-2012教学实验用危险固体、液体的使用与保管
- GB/T 26389-2011衡器产品型号编制方法
- GB/T 16588-2009带传动工业用多楔带与带轮PH、PJ、PK、PL和PM型:尺寸
- 人大企业经济学考研真题-802经济学综合历年真题重点
- 建筑抗震鉴定标准课件

评论
0/150
提交评论