



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
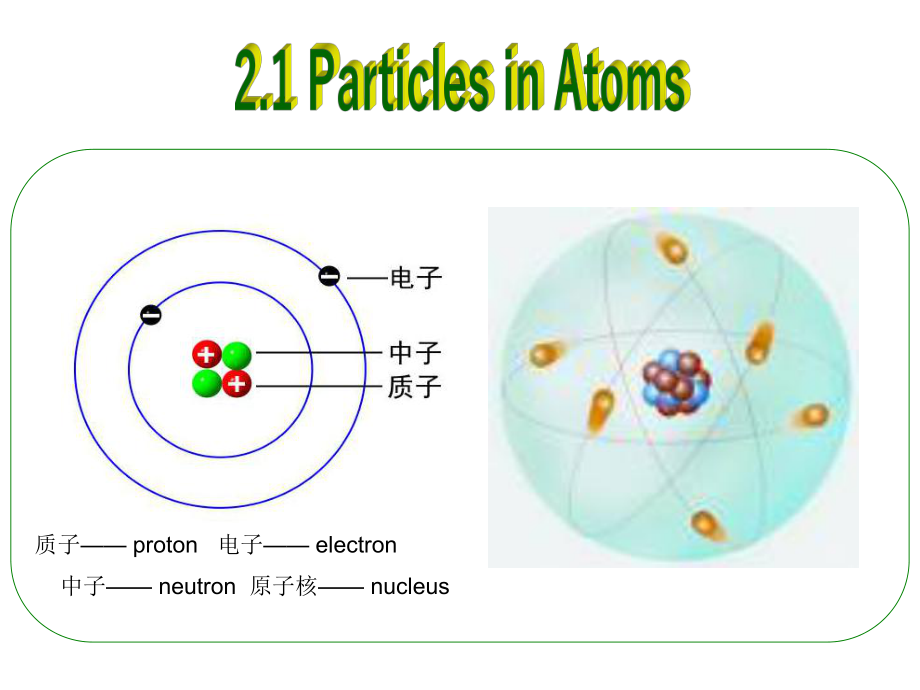
1、 Chapter 2: Atomic Structure 自然界的物质种类繁多,性质各异,但它们都是由种类不同的原子组成,原子以不同的种类、数目和方式结合,形成了无数的物种。因此,原子结构的知识是了解物质结构和性质的基础。 化学变化包含着旧的化学键断裂和新的化学键的形成,化学变化一般只涉及核外电子运动状态的变化,所以研究原子结构时,主要研究核外电子的运动状态。前言(Preface)n古希腊哲学家古希腊哲学家Democritus提出,物质由原子(提出,物质由原子(atom)构)构成成约约460 370BC质子 proton 电子 electron 中子 neutron 原子核 nucleusEl
2、ectrons 2.2 The Bohr Model 在装有氢气放电管的两极上,通以高压电使之放电,将管中发出的光线通过棱镜分光,便得到氢原子的线状光谱。 (提示:在可见光区有四条谱线组成的线状光谱。)青青红 橙 黄 绿 青 蓝 紫2.2 The Bohr Model2.2 The Bohr Model为了解释氢原子谱线规律性,1913年玻尔提出氢原子模型。1)原子模型:原子模型: 核外电子不能沿任意轨道运动,只能沿某些特许的稳定轨道绕核旋转,电子在轨道上运动时,即不吸收也不放出能量。(定态的假设) 第一节 : 核外电子运动的特殊性既不辐既不辐射也不射也不吸收能吸收能量量 第一节 : 核外电子
3、运动的特殊性2)轨道量子化:在一定轨道上运动的电子有一定的能量,它们只允许是不连续的分立值(能量量子化)。nhnL2能量是不连续的能量是不连续的2.2 The Bohr Model3)光谱频率:当电子从一个能量状态跃迁到另一个能量状态时会吸收或释放出一定能量。 222121812nn1Z1018.2hEEEE光子氢原子光谱的一部分氢原子光谱的一部分波长波长青青2.2 The Bohr Model 课课 堂堂 小小 结结 222121812nn1Z1018. 2hEEEE光子 玻尔理论最大贡献:建立微观粒子量子化特性,成功地解释了氢原子光谱是线状光谱,为化学键理论奠定了基础。2.3 The Wa
4、ve Theory of Electronsmvhph2.4 Heisenbergs Uncertainty Principle2.4 Heisenbergs Uncertainty Principle 第一节 : 核外电子运动的特殊性(狭缝越窄,衍射图象散布得越宽)各种实验说明,把微粒的位置和动量同时确定是不可能的。xph/42.4 Heisenbergs Uncertainty Principle 第一节 : 核外电子运动的特殊性(狭缝越窄,衍射图象散布得越宽)各种实验说明,把微粒的位置和动量同时确定是不可能的。xph/4 2.5 The Schrodinger Equation2.5 T
5、he Schrodinger Equation1926年薛定谔(奥地利)从微观粒子的二象性出发,建立了有名的薛定谔方程,用来描述核外电子的运动状态。0)(8)(22222222VEhmzyx E E:电子总能量:电子总能量 V V:电子势能:电子势能 m m:电子质量:电子质量 h h:普朗克常数:普朗克常数 x.y.zx.y.z:电子空间坐标:电子空间坐标 :波函数:波函数 薛定谔方程,是描述核外电子的运动状态的方程。它的解(波函数 )是描述核外电子运动状态的函数在量子力学中常把波函数(Wave function)称为原子轨道波函数,简称原子轨道(atom orbit)。故原子轨道和波函数是
6、同义词。注意:原子轨道与经典力学中固定轨道有不同含义。注意:原子轨道与经典力学中固定轨道有不同含义。波函数和原子轨道波函数和原子轨道2.6 Quantum Numbers 为得到合理的解,要求n、l、m(三个常数)要符合一定的取值。量子力学把这类特定的常数叫量子数。 当量子数n、l、m的取值一定,就有一个波函数的具体表达式,这相当于经典力学中确定了物体的运动轨道,量子力学借用“轨道”一词,把原子体系的每一个波函数叫做原子轨道。1. 主量子数(Principle Quantum Number) n 取值:正整数 n =1、2、3 它表示电子离核的远近,也是决定电子能量的主要因素,也叫电子层数。J
7、1018. 22218nZE对氢原子或类氢离子(单电子)来说,电子能量完全由n决定:n 光谱符号12345KLMNO2.6 Quantum Numbers2. 角量子数(Angular Momentum Quantum Number )l 取值:0、1,2,3,n-1它表示原子轨道和电子云的形状 ,与能级或称电子亚层(subshell)对应。()l01234光谱符号光谱符号spdfg轨道形状轨道形状球形球形哑铃形哑铃形花瓣形花瓣形纺锤形纺锤形2.6 Quantum Numbers主量子数与角量子数的关系:n12345l00、10、1、20、1、2、3gn-1亚层亚层1s2s、2p3s、3p、3
8、d4s、4p、4d、4f2.6 Quantum Numbers3.磁量子数(Magnetic Quantum Number )m 取值: 0、1、2.l它表示原子轨道在空间的伸展方向,磁量子数与能量无关。2.6 Quantum Numbers 4. 自旋量子数(Magnetic Spin Quantum Number )ms 取值:+1/2 、- 1/2 它表示电子自旋的两个方向,顺(逆)时针常用或表示。 在氢原子化学光谱的精细结构实验中,人们发现它的大多数谱线,其实是由靠得很近的两条谱线组成。 四个量子数n、l、m、ms可全面确定原子中每个电子的运动状态,它们的取值是相互制约的。 波长波长青
9、青2.6 Quantum Numbers轨道数与容纳电子数轨道数与容纳电子数 轨道数电子数 轨道数 = n2n = 112 n = 248容纳电子数 = 2n2n = 3918 n = 416321.指出下列各组轨道的n、l量子数:a)4f b)5d c)3p 2.根据下列各组量子数,写出对应轨道名称解:解:轨道名称(1)2pz (2)3px (3)6s课 堂 练 习随堂练习:(1)2、1、0 (2)3、1、+1 (3)6、0、0轨道4f5d3pn453l321 3.下列各组量子数哪些不合理,为什么? (1) n=1 l =1 m=0 (2) n=2 l =0 m=1 (3) n=3 l =3
10、 m=3 (4) n=2 l =1 m=0解: (1) n=1 l =0 m=0 (2) n=2 l =0 m=0 或n=2 l =1 m=0(或+1,-1) (3) n=3 l =2 m=0,1, 2 (4) n=2 l =1 m= 0,1课 堂 练 习随堂练习:2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals波函数也可用球坐标表示:222zyxrcossinsincossinrzryrx、rmlnR:径向分布函数 由n、l决定 Y:角度分布函数 由l、m决定 为了便于阐明其物理意义,可分为两个部分)、(、mllnrYrR)
11、(2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals 使R(r)保持不变,只改变角度,将 Y 随( )变化作图可得。常用图形有两种:A:原子轨道角度分布 B:电子云角度分布图 将不同.值代入,可求得一系列Y值,从坐标原点出发,引出方向为( )的直线,取其长度为Y值,将所有这些端点连接起看,在空间就形成了一个曲面图。2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals如:氢原子的角度部分:【s轨道】41),(sY(是量子力学处理薛定谔方程,求出的解)Ys是一常数与是一
12、常数与(,) )无关,故原子轨道的角度部分为一球面,半径为无关,故原子轨道的角度部分为一球面,半径为:41xy+A:原子轨道角度分布2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitalscos43),(zpY0153045607590Y0.4890.4720.4230.3450.2440.126018016515013512010590Y-0.489-0.472-0.423-0.345-0.244-0.1260我们来试做一下函数在yz平面的图形:如:氢原子的角度部分:【pz轨道】2.7 Shapes of Atomic Orbita
13、ls2.7 Shapes of Atomic Orbitals0.472+-yz15节面:当节面:当cos = 0时,时, = 0, = 902.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals同样的方法我们可以作出px、 py轨道的角度分布函数图px+ +xypz+ +xzpy+ +xy2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals同样的方法我们可以作出:dxz、 dyz 、 dxy、 dx2-y2、 dz2轨道的角度分布函数图+ +dxz+ +xz+ +dy
14、z+ +zy+ +dxy+ +yx+d x2y2xy+d z2xz2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals三维立体图2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals dz2轨道的角度分布函数三维立体图2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals 由于Y(.)只与l、m有关,与n无关,因此 只要是量子数l、m相同的状态,它们的原子轨道角度分布图都相同。 剖面图:“”无电性意义,具相位
15、类似意义, 在讨论原子间成键时有一定用途。 2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic OrbitalsB:电子云角度分布图电子云角度分布图表示出电子在空间不同角度所出现的几率密度大小。波函数实际上没有明确的、直观的物理意义,只是一个数学函数。 由经典的电磁波理论 |2 波的强度 |2 电子的几率密度2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic OrbitalsY(.) 2 . 作图,就得到电子云角度分布图zxsxyxzzpypxpzxxzs+xyxzx+-pypxpzz+B:电子云角
16、度分布图2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals+d z2xz+ +dxz+ +xz+ +dyz+ +zy+ +dxy+ +yx+d x2y2xydxzxzdyzzydxyyxd x2y2xyd z2xzB:电子云角度分布图2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals1.前者有正、负号之分,后者均为正值,因为Y(、)中的、为三角函数关系,但Y2后就没有正、负了。2.后者比前者瘦些,这是因为Y值小于1,Y2值就更小;3.前者是数学函数图,没有明确物理
17、的意义。而后者表示在空间单位体积中出现的几率大小随角度、的变化 。原子轨道角度分布函数图电子云角度分布图的区别主要区别有几点电子云的整体图形电子云的整体图形 a) 电子云图:2 即几率密度,用黑点的疏密表示。 b)几率密度等值线图: 2值相同点而成的曲线。 c)电子云界面图:核外电子在空间出现的总几率的90%包括在内的地方作一等密度面。1.00.60.4bc . . . . . . .a电子云的整体图形:电子运动的统计性结果,是电子云的整体图形:电子运动的统计性结果,是|2的具体的具体形象描述。形象描述。2.7 Shapes of Atomic Orbitals2.7 Shapes of At
18、omic Orbitals电子云的整体图形电子云的整体图形2.7 Shapes of Atomic Orbitals2.7 Shapes of Atomic Orbitals 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p能级交错能级交错美国化学家Pauling根据光谱实验的结果,总结出多电子原子中原子轨道能量高低顺序,并绘制成能级近似图2.8 Many-Electron Atoms 2.8 Many-Electron Atoms 构造原理构造原理2.8 Many-Electron Atoms 2.8 Many-Electron
19、 Atoms (一)Aufbau principle (Buliding-up principle)能量最低原理体系能量越低越稳定,按原子轨道近似能级图由低向高排布。(二) Pauli Exclusion Principle 泡里不相容原理在同一个原子中,没有运动状态完全相同的电子,每层最多可容纳2n2电子。 (三) Hunds Rule 洪特规则在填充能量相等的等价轨道时,电子尽可能分占不同等价轨道,且自旋平行。Electron ConfigurationsElectron ConfigurationsSample: 6C 15P 21Sc 15P : 1s2 2s2 2p6 3s23p32
20、1Sc : 1s2 2s2 2p6 3s23p63d14s4s2 2 2s2p6C : 1s2 2s2 2px1 2py11s 为了书写方便,常将内层已达稀有气体电子层结构的电子,用稀有气体元素符号加方括号表示。(原子实 + 外层电子构型) 21Sc : 1s2 2s2 2p6 3s23p6 3d14s2Ar 3d14s2例:例:Mn 1s2 2s2 2p6 3s2 3p6 3d5 4s2 Ar 3d5 4s2 超常的常见元素有: Cr(3d5 4s1) Cu(3d10 4s1) Mo(4d55s1) Ag (4d10 5s1) 目前对其它某些例外情况,尚无确切解释:(遵循实验事实) Nb:
21、Kr4d4 5s1 而不是: Kr4d35s2 或 Kr4d55s0 3 d4s4 p Cr(3d5 4s1) 洪特规则洪特规则特例特例Electron Configurations光谱实验证明:光谱实验证明:实验证明洪特规则特例 当等价轨道中的电子处于半充满( p3, d 5, f 7 )、全充满(p 6, d 10, f 14 )或全空(p 0, d 0, f 0 )时,具有额外的稳定性。1.写出下列元素核外电子结构: 2.某元素有6个电子处于n=3,l=2的能级上,推测该原子的原子序数,并根据Hund规则指出d 轨道上有几个未成对电子?课 堂 练 习随堂练习: 9F 14Si 24Cr
22、29Cu 26Fe 解: 3d 轨道上有6个电子1s2 2s2 2p6 3s2 3p6 4s2 3d6 Z = 26d 轨道上有4个未成对电子2.10 The Periodic Table and Electronic2.10 The Periodic Table and Electronic Configurations of Atoms Configurations of Atoms 1869 1869年门捷列夫年门捷列夫( (俄俄) )创立了元素周期表创立了元素周期表PeriodsPeriods人们发现,随着原子序数人们发现,随着原子序数(核电荷核电荷)的增加,不断有新的电子的增加,不断
23、有新的电子层出现,并且最外层的电子的填充始终是从层出现,并且最外层的电子的填充始终是从ns1开始到开始到ns2 np6结束结束(除第一周期外除第一周期外),即都是从碱金属开始到稀有气体结,即都是从碱金属开始到稀有气体结束,重复出现。元素性质呈现周期性的变化规律束,重复出现。元素性质呈现周期性的变化规律(周期律周期律)是是由于原子的电子层结构呈现周期性变化所造成的。由于原子的电子层结构呈现周期性变化所造成的。 周期数周期数 = 能级组数能级组数 = 电子层数电子层数由能级组和周期的关系可知,能级组的划分是导致周期表中各元素能划分为周期的本质原因。第七周期为未填满周期 2.10 The Perio
24、dic Table and Electronic Configurations of Atoms能 级n + 0 .7 l能 级 组 数周 期 数能 级 组 内 最多 的 电 子 数每 周 期 中 的元 素 数周 期 名称1 s1 .01122特 短2 s2 p2 .02 .72288短3 s3 p3 .03 .73388短4 s3 d4 p4 .04 .44 .7441 81 8长5 s4 d5 p5 .05 .45 .7551 81 8长6 s4 f5 d6 p6 .06 .16 .46 .7663 23 2特 长7 s5 f6 d7 p7 .07 .17 .47 .777未 完 成能级组
25、的形成是元素划分为周期的本质原因。2.10 The Periodic Table and Electronic Configurations of AtomsPeriodsPeriodsGroupsGroups族:原子的电子层结构相似的元素落在同一列,称为族。 长周期表共分18列,其中铁、钴、 镍 三列合成为一族;称为第族。其余每一列为一族(共有16个族)。主族(主族(A):有长短周期元素的各列,:有长短周期元素的各列,AA+零族共零族共8个主族。个主族。副族(B):仅有长周期元素的各列, B B+族共8个副族。 族的划分 A:族号数:族号数= ns 电子数电子数 + np 电子数电子数 B:
26、族号数:族号数= ns 电子数电子数 +(n-1)d 电子数电子数2.10 The Periodic Table and Electronic Configurations of Atoms 1869 1869年门捷列夫年门捷列夫( (俄俄) )创立了元素周期表创立了元素周期表主族(主族(A):):AA+零族共零族共8个主族。副族(个主族。副族(B):):B B+族共族共8个副族。个副族。 2.10 The Periodic Table and Electronic Configurations of Atoms 根据各元素原子电子层结构的特点,把长式周期表划为s、p、 d、 ds、f五个区。
27、 s d ds pf2.10 The Periodic Table and Electronic Configurations of AtomsBlock 1.已知下列元素的价层电子构型分别为:ExercisesExercises(1)3s2 3p5 (2)3d54s2 (3)3d104s2它们分别属于第几周期?第几族?哪个区?最高氧化数是多少?2.已知某元素的原子序数为28,试指出它属于哪一周期?哪一族?什么区?是什么元素?解:电子层构型为 1s22s22p63s23p64s23d8 第四周期族 d区 3d84s2 Ni 原子半径:指原子在分子或晶体中表现的大小。1.1.共价半径共价半径 同
28、种元素共价单键键长的一半作为该元素的共价半径。2.2.范德华半径范德华半径 不属于同一分子的两个最接近的原子核间 距离的一半称为原子的范德华半径。3.3.金属半径金属半径 在金属晶体中,把相邻两个原子的核间距离的 一半作为该元素的金属半径。 2.11 The Periodicity of the Properties of2.11 The Periodicity of the Properties of Elements and Atomic Structure Elements and Atomic StructureAtomic Radii原子半径在元素周期表中的大致变化规律 1869 1
29、869年门捷列夫年门捷列夫( (俄俄) )创立了元素周期表创立了元素周期表大大小小大大小小 2.11 The Periodicity of the Properties of Elements and Atomic StructureAtomic Radii 原子半径的变化规律图 2.11 The Periodicity of the Properties of Elements and Atomic Structure 1)同一周期阳离子(cation)半径随正价增加而减少,例如:Na+ Mg2+ Al3+。 2) 同一主族元素离子半径从上到下递增, 例如:Li +Na+ K+ Rb +Cs
30、+、F- Cl- Br- Fe3+。 Ionic Radii Ionic Radii离子的半径 指形成稳定离子键时所表现的有效半径。指形成稳定离子键时所表现的有效半径。5) 阳离子半径较小约10170pm;阴离子(anion)半径较大,130260pm。6)镧系、锕系收缩:相同正价的镧系和锕系阳离子半径随原子序数增加而减少。离子半径的大小对物质的熔点的影响:离子晶体 NaFKFRbF离子半径 95 95 133 133 148148 熔点() 1265 1265 1130 1130 10381038 Ionic Radii Ionic RadiiIonization EnergyIonizat
31、ion Energy 电离能:一个基态气态原子失去电子形成气态正离子时所需要吸收的能量,叫该元素的电离能。 气态原子失去电子的难易气态原子失去电子的难易, ,可用电离能来衡量。可用电离能来衡量。 I1 : M - e = M+ 单位单位:eV对同一原子,其各级电离能大小的顺序总是I1I2I3 2.11 The Periodicity of the Properties of Elements and Atomic Structure 周期表中主族元素的第一电离能随原子序数的递增而呈现周期性的变化: Be 2S2 N 2S22P3 Zn 3d104s2电离能变化规律同一周期中,左 右:随着有效核
32、电荷增加,电离能依次增大。同一主族中,上下: 随着有效核电荷降低,电离能依次减小。除上述规律外,在某些位置上出现转折。所有元素中所有元素中,He,He的电离能最大的电离能最大,Cs,Cs的电离能最小的电离能最小Ionization EnergyIonization EnergyElectron AffinityElectron Affinity 电子亲合能:是指一个气态中性原子得到一个电子形成气态负离子时释放出的能量。在元素周期表中,电子亲合能的变化规律类似电离能。 A + e = A - 释放释放(+) 吸收吸收(-) ( (提示提示: :并不是所有元素的原子都放出能量并不是所有元素的原子都
33、放出能量) ) 2.11 The Periodicity of the Properties of Elements and Atomic StructureElectronegativityElectronegativity 电负性:元素的原子在分子中吸引成键电子能力的相对大小。 1932年鲍林提出了电负性的概念,用它作为衡量在化学键中原子吸引成键电子能力相对大小的尺度。人为规定F的电负性为4.0 2.11 The Periodicity of the Properties of Elements and Atomic Structure1、同一周期中,从左到右电负性逐渐增加,主族元素间的变化明显,副族元素间的变化幅度小些。2、同一族中,主族从
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 【正版授权】 ISO 7334:2025 EN Earth-moving machinery - Vocabulary and taxonomy for automation and autonomy
- 【正版授权】 ISO 16123:2025 EN Ships and marine technology - Marine cranes - Slewing bearings
- 【正版授权】 IEC 61000-4-41:2024 EN-FR Electromagnetic compatibility (EMC) - Part 4-41: Testing and measurement techniques - Broadband radiated immunity tests
- 【正版授权】 IEC 61035-1:1990 EN-D Specification for conduit fittings for electrical installations - Part 1: General requirements
- 【正版授权】 IEC 60884-2-2:2006 EN-D Plugs and socket-outlets for household and similar purposes - Part 2-2: Particular requirements for socket-outlets for appliances
- 【正版授权】 IEC 60335-2-66:2025 EXV-RLV EN Household and similar electrical appliances - Safety - Part 2-66: Particular requirements for water-bed heaters
- 【正版授权】 CISPR 14-1:2005 FR-D Electromagnetic compatibility - Requirements for household appliances,electric tools and similar apparatus - Part 1: Emission
- 以客户运营为中心
- 2025年化妆品营销策划方案经典
- 2025年乡村幼儿园工作方案
- 消防更换设备方案范本
- 中国农业银行笔试题库(含答案)
- 2019人教版高中英语选择性必修三单词表
- 项目部二级安全教育内容
- 统编(部编)五年级语文下册全册教学反思
- 七年级地理欧洲西部
- GB∕T 16754-2021 机械安全 急停功能 设计原则
- 下肢静脉曲张硬化治疗指南
- MT_T 142-1986 煤矿井下空气采样方法_(高清版)
- 【民办幼儿园发展规划】幼儿园发展规划
- 设备更新改造管理制度

评论
0/150
提交评论