



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、 7-3 氧化还原滴定法v用途: 测定测定氧化型或还原型或不具氧化还原型物质的含量。v条件: 反应迅速、定量、合适指示终点的方法。一、条件电极电位1. 副反应系数2. 条件电极电位lg0591. 0氧还还氧n式中式中及及在条件一定时,是一固定在条件一定时,是一固定值值( (常数常数) ),多为实验测得的电位。,多为实验测得的电位。 称为条件电位称为条件电位,它是在特定条件下,氧化,它是在特定条件下,氧化态和还原态的浓度都为态和还原态的浓度都为1molL-1 时的电位。时的电位。特点:特点:1.1.条件不变时为一常数;条件不变时为一常数; 2.离子强度离子强度和和各种副反应各种副反应影响;影响;
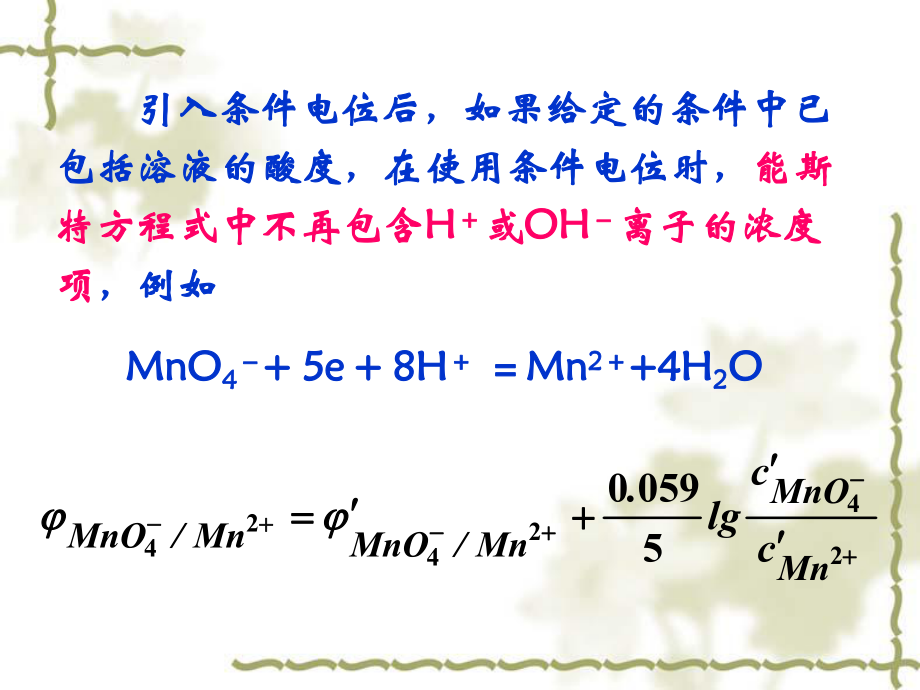
2、 3.数据较少,如缺乏相同条件的数据较少,如缺乏相同条件的 可用可用相近的相近的 甚至用甚至用 来代替。来代替。 引入条件电位后,如果给定的条件中已引入条件电位后,如果给定的条件中已包括溶液的酸度,在使用条件电位时,包括溶液的酸度,在使用条件电位时,能斯能斯特方程式中不再包含特方程式中不再包含H H或或OHOH离子的浓度离子的浓度项项,例如,例如 MnOMnO4 4+ 5e + 8H+ 5e + 8H MnMn2 2+4H+4H2 2OO 24242450590MnMnOMn/MnOMn/MnOcclg. 二、氧化还原滴定曲线(标准溶液的加入量为横坐标,电极电位为纵坐标作图)1 可逆电对指反应
3、在任一瞬间能迅速建立起化学平衡的电对(如I2/I、Fe3/Fe2),其实际电极电位与用能斯特方程计算所得的理论电位相符。2 不可逆电对是指反应在瞬间不能建立起化学平衡的电对(如MnO4/ Mn2、Cr2O72/Cr3、 CO2/H2C2O4)。3 滴定曲线绘制 以以0.1000molL-1 的的Ce(SO4)2 标准标准溶液滴定在溶液滴定在H2SO4 为为1molL-1的介质中,的介质中,20.00ml 0.1000molL-1 的的Fe2+为例讨论为例讨论溶液中电位的变化。溶液中电位的变化。Ce4+ + Fe2+ = Ce3+ + Fe3+ 在在c(H2SO4 )= 1molL-1时,各电对
4、的条件时,各电对的条件电位是:电位是:V.V.Fe/FeCe/Ce6804412334 1) 计量点前计量点前:体系中存在体系中存在Fe3+ / Fe2+ 、 Ce4+ /Ce3+ 。在滴定过。在滴定过程中程中,当加入滴定剂反应达平衡后:当加入滴定剂反应达平衡后:E +- -=0 (Fe3+/Fe2+) (Ce4+/Ce3+)当加入当加入2.00ml Ce4+时时:)V(.lg.).(.lg.)Fe(c)Fe(clg.Fe/Fe6209010059206800022002002010000002200210000059206801059202323 当加入当加入19.98ml Ce4+时:时:
5、)V(.lg.)Fe(c)Fe(clg.Fe/Fe86010999059206801059202323 2) 计量点后:计量点后:溶液中的离子溶液中的离子Ce4+过量,有过量,有Fe2+是痕量溶液的是痕量溶液的电位由电位由Ce4+ /Ce3+电对来计算。电对来计算。当加入当加入20.02ml Ce4+时时,即过量即过量0.1:)V(.lg.)Ce(c)Ce(clg.Ce/Ce26110010059204411059203434 当加入当加入20.20ml Ce4+时,即过量时,即过量1:)V(.lg.)Ce(c)Ce(clg.Ce/Ce3211001059204411059203434 )Fe
6、(c)Fe(clgn.)Ce(c)Ce(clgn.ep 232234110592005920 )Ce(c)Ce(clg.nn)(ep 34111059201 )Fe(c)Fe(clg.nn)(ep 23222059202 3) 计量点时:计量点时:(1)+(2)得)得)Ce(c)Fe(c)Ce(c)Fe(clg.nn)nn(ep 324322112105920 计量点时计量点时c(Fe2+)=c(Ce4+),c(Fe3+)= c(Ce3+)V.)nn(nnep06111680441212211 0.600.700.800.901.0051015 20 25mlCe4+ 加入量加入量E(V)30
7、突跃突跃: 0.861.26V1.10指示剂的选择:在指示剂的选择:在此突跃范围内变色此突跃范围内变色的指示剂的指示剂1.201.06 滴定突跃的大小与两电对的差值大小滴定突跃的大小与两电对的差值大小有关,有关,突跃,突跃。 对对n n1 1=n=n2 2的反应,计量点电位恰好处于突的反应,计量点电位恰好处于突跃中点。跃中点。4) 影响因素三、指示剂(由指示终点的原理不同分类)v1 1、自身指示剂、自身指示剂 MnO4(紫红)(紫红)Mn2(无色)(无色) MnO4(粉红色(粉红色半分钟不褪)半分钟不褪).v2、特殊指示剂、特殊指示剂 淀粉碘量法中的指示剂(淀粉碘量法中的指示剂(I2淀粉)深蓝
8、色化合物淀粉)深蓝色化合物I无色无色v3、氧化还原指示剂、氧化还原指示剂 在滴定过程中因为氧化或还原而发生颜色变化,来在滴定过程中因为氧化或还原而发生颜色变化,来指示终点指示终点4、选择氧化还原指示剂的原则:1)批示剂的变色电位范围应在滴定突跃范围内;2)终点颜色要有突变。四、常用的氧化还原滴定法四、常用的氧化还原滴定法(一)(一) 高锰酸钾法高锰酸钾法4MnO 2HMn2MnO中中性性、弱弱酸酸性性或或弱弱碱碱性性 24OHMnO1.51V24MnMnO0.59V24MnOMnO0.56V-244MnOMnO标定条件标定条件温温 度度:75850C酸酸 度度: :c cH+H+:0.2-0.
9、5mol.L:0.2-0.5mol.L-1-1 滴定速度滴定速度: :慢慢 快快 慢慢滴定终点滴定终点: :自身指示,半分自身指示,半分钟不退色钟不退色高锰酸钾法的应用示例高锰酸钾法的应用示例1. H2O2含量的测定:含量的测定: 6HO5H2MnO224O8H5O2Mn222 %10022224422OHOHKMnOKMnOOH25VMVc2.钙盐中钙的测定(间接测定法)钙盐中钙的测定(间接测定法)测定过程有关反应如下:测定过程有关反应如下: 2HOCaC42 2422CaOCH 6HOC5H2MnO4224 2422OCCa(白白色色) 42OCaCO8H10CO2Mn222 钙盐中钙的测
10、定(间接测定法)钙盐中钙的测定(间接测定法)4422422MnO52OCHOCaCCa%1001000sCamMVc44KMnOKMnO25Ca%则可以利用下式计算钙的含量:则可以利用下式计算钙的含量:(二)(二)K K2 2CrCr2 2O O7 7法法(二苯胺磺酸钠或邻二氮菲亚铁)(二苯胺磺酸钠或邻二氮菲亚铁) 重铬酸钾也是一种较强的氧化剂,在酸性溶液重铬酸钾也是一种较强的氧化剂,在酸性溶液中。中。K K2 2CrCr2 2O O7 7与还原剂作用时被还原为与还原剂作用时被还原为CrCr3+3+,半电池反,半电池反应式为:应式为: CrCr2 2O O7 722+14H+14H+ +6e+
11、6e2Cr2Cr3+3+7H+7H2 2O O 1.33V K2Cr2O7还原时的标准电极电位虽然比还原时的标准电极电位虽然比KMnO4的标准的标准电位低些,但它与高锰酸钾法比较,具有以下一些优电位低些,但它与高锰酸钾法比较,具有以下一些优点:点:(1)、)、K2Cr2O7容易提纯,性质稳定,而且在容易提纯,性质稳定,而且在140150时干燥后,可以直接称量,配成标准溶液,时干燥后,可以直接称量,配成标准溶液,并可长期存放。并可长期存放。a:测:测Fe含量含量Fe2 Cr2O72 Fe2 6Fe2 Cr2O72(橙)(橙)14H = 6Fe32Cr3(绿)(绿)7H2Ob:土地中有机质的测定:
12、土地中有机质的测定c:水中化学需氧量测定:水中化学需氧量测定2 2)滴定可在)滴定可在1mol1molL-1 HClL-1 HCl溶液中进行。溶液中进行。应用:应用:碘量法也是常用的氧化还原滴定方法之一。碘量法也是常用的氧化还原滴定方法之一。基本反应:基本反应:I I3 32e2e = 3I= 3I简写简写I I2 22e2e=2I=2I =0.54V=0.54V由由可知可知I2是一种较弱的氧化剂,能与较强的还是一种较弱的氧化剂,能与较强的还原剂作用;而原剂作用;而I-是一种中等强度的还原剂,能与许多是一种中等强度的还原剂,能与许多氧化剂作用,因此碘量法又可以用直接的和间接的氧化剂作用,因此碘
13、量法又可以用直接的和间接的两种方式进行滴定。两种方式进行滴定。( (三)碘量法三)碘量法(1)直接碘量法()直接碘量法(用于电极电位比用于电极电位比 I2/I- 低的还原性物低的还原性物质)质) 如如 测钢铁中测钢铁中S含量:含量: I2SO22H2O = 2I2SO424H用于测强还原性物质:用于测强还原性物质:SO2 、S2-、SO32-、 S2O32-、 Sn2+、S2O32-、等。、等。 (2)间接碘量法)间接碘量法(用于电极电位比用于电极电位比 高的氧化性物质)高的氧化性物质)氧化剂试样氧化剂试样 I2 IS4O62例如:例如:K2Cr2O7的测定(弱酸性介质中),用的测定(弱酸性介
14、质中),用Na2S2O3的标的标定定6I Cr2O72 14H = 3I22Cr37H2O I22S2O32 = 2IS4O62I2 / I / I 过量的过量的I INaSNaS2 2O O3 31) 1)控制溶液的酸度中性或弱酸性控制溶液的酸度中性或弱酸性OH-3I2 + 6OH- IO3- +5I- +3H2O S2O32- + 2H+ SO2 + S +H2O 4I- + 4H+ +O2 2I2 + 2H2O-223210OH4IOS O5H8I2SO224 H+2) 2) 加入过量的碘化钾加入过量的碘化钾 防止碘的升华、增加碘的防止碘的升华、增加碘的溶解度溶解度滴定条件滴定条件 :3)
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 考勤风险管理培训
- 2026年绿色供应链管理与认证考试题
- 2026年股市分析师进阶考试试题与答案
- 2026年营养师营养学知识应用测试题
- 2026年机械设计工程师认证题集及解答
- 老旧小区改造培训
- 青少年近视防控合同2025
- 2026年春季学期学校“‘学困生’学习方法指导”手册编写方案:编写手册精准指导
- 个人信守诺言与自律承诺函7篇
- 农业科技推广专员技术实施绩效考核表
- 深圳大疆在线测评行测题库
- 设备保养维护规程
- 《JBT 9778-2018 全喂入式稻麦脱粒机 技术条件》(2026年)实施指南
- 2025年东营中考物理真题及答案
- 医患沟通培训正确处理医患沟通课件
- 2025年1月八省联考高考综合改革适应性测试-高三政治(陕西、山西、宁夏、青海卷)(含答案)
- 2026年1月1日起施行新增值税法全文课件
- 高一英语阅读理解试题(生活类)
- GB/T 44242-2024质子交换膜燃料电池汽车用氢气无机卤化物、甲酸的测定离子色谱法
- 高中数学课时作业(人教A版选修第二册)课时作业(十)
- 动物自然繁殖篇12标清

评论
0/150
提交评论