



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
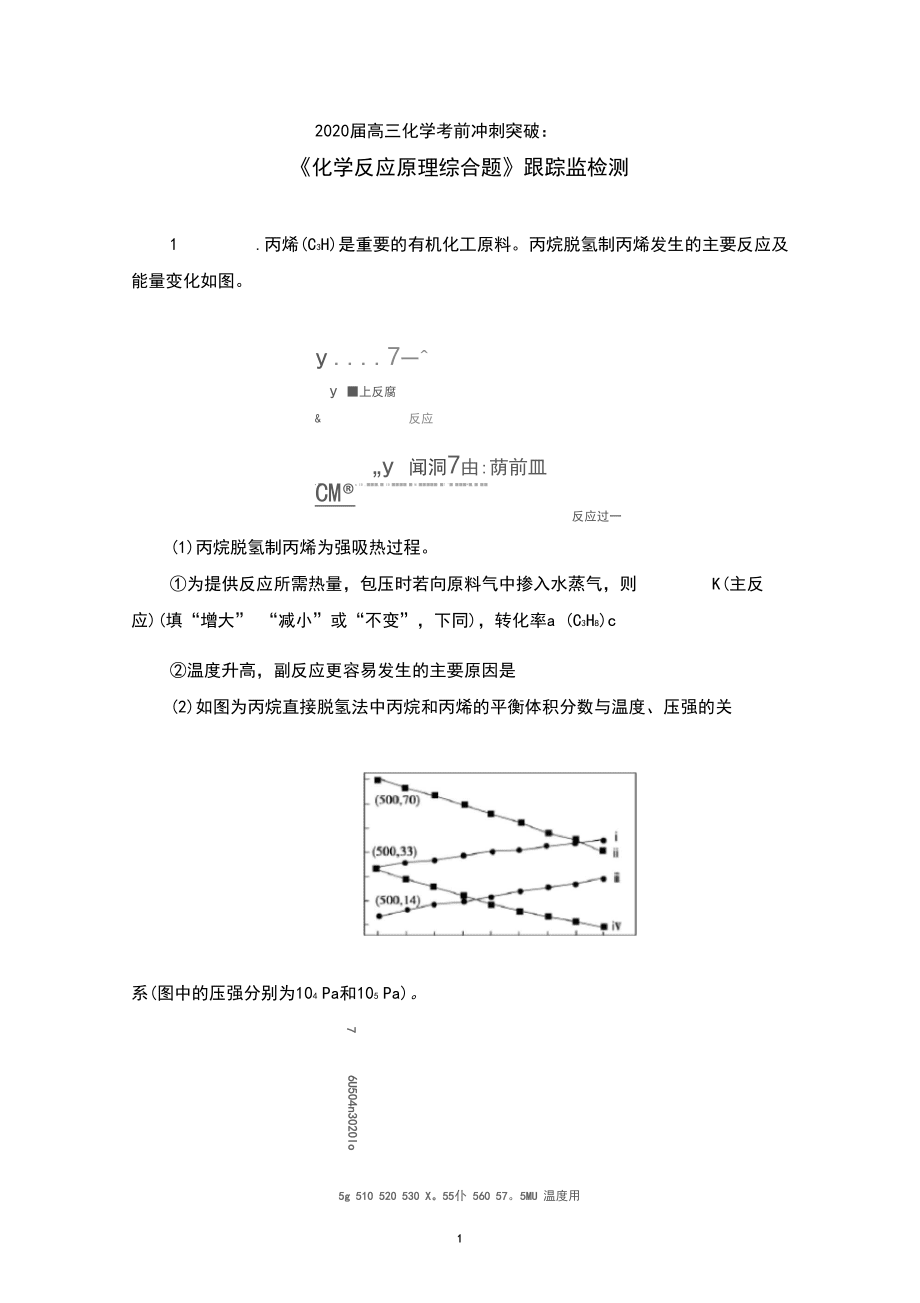
1、2020届高三化学考前冲刺突破:化学反应原理综合题跟踪监检测1 .丙烯(C3H)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及 能量变化如图。y7一y 上反腐&反应y 闻洞7由:荫前皿 .n IB , IB M ! ' *, CM®反应过一(1)丙烷脱氢制丙烯为强吸热过程。为提供反应所需热量,包压时若向原料气中掺入水蒸气,则K(主反应)(填“增大” “减小”或“不变”,下同),转化率a (C3H8)c温度升高,副反应更容易发生的主要原因是 (2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104 Pa和105 Pa)。5g
2、510 520 530 X。55仆 560 57。5MU 温度用706U504n3020lo104Pa时,图中表示丙烯的曲线是 (填“i” “ii” “iii"或v" )104Pa、500 C时,主反应用平衡分压代替平衡浓度表示的化学平衡常数&=(已知:气体分压=气体总压X体积分数 )。(3)利用CO的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可 采用铭的氧化物为催化剂,其反应机理如图。已知:CO和代的燃烧热分别为A H= 283.0 kJ - mol AH = 285.8 kJ - mol 。图中催化剂为。298 K时,该工艺总反应的热化学方程式为该工艺可
3、以有效消除催化剂表面的积炭,维持催化剂活性,原因是解析:(1)由图可知,丙烷脱氢制丙烯为吸热反应:CH(g) = GH(g) + H(g) AH= +124.3 kJ mol一,恒压时若向原料气中掺入水蒸气,体系温 度升高,平衡向正反应方向移动,化学平衡常数K增大,丙烷的转化率增大。由图可知,副反应的活化能低于主反应的活化能,温度升高,活化能较 低的副反应更容易发生。(2)丙烷脱氢制丙烯为气体体积增大的反应,增大压强,平衡向逆反应方 向移动,丙烯的平衡体积分数减小;该反应为吸热反应,温度升高,平衡向正 反应方向移动,故曲线i代表104 Pa时丙烯的平衡体积分数104 Pa、500 C时,丙烯的
4、平衡体积分数为 33%设起始丙烷为1 mol, 转化率为x,由题意建立如下三段式:QH(g)= GH(g) + 凡(g)起(mol)100变(mol) xxx平(mol)1 -xxx 一x一、则由丙烯的平衡体积分数为 33%M得,T-=0.33 ,解得x = 0.5,丙烷、1十x ,1 丙烯和氢气的分压均为104 Pax-,则用平衡分压代替平衡浓度表示的化学平衡3104 Pa x3 x 104 Pa x31常数 (=104 Pax = 3.3 x 103 Pa。41310 Pax q3(3)由图可知,反应i为3GH8+2CrQ3GH+CrzQ+ 3H2O,反应ii为3CO+ Cr2O = 2C
5、rQ+3CQ 则催化剂为 CrQ。 一一1一-1 -由题意可得 H2(g) +2Q(g)=H2O(l)AH = 285.8 kJ mol,1一iCO(g)+2Q(g)=CO (g)AH = 283.0 kJ mol 1,C3H8(g)1 GH(g)+H(g)AH= +124.3 kJ mol1,由盖斯定律一+得热化学方程式为 GH(g) +CO(g) = GH(g) + CO(g)+ H2O(l),则AH =(+124.3 kJ mol1)+(285.8 kJ mol1)( 283.0 kJ - mol1) =+121.5 kJ mol1。该工艺中碳与CO反应生成CO可以有效消除催化剂表面的积
6、炭, 维持催 化剂活性。答案:(1)增大 增大 副反应的活化能低于主反应的活化能(2) i3.3X103 Pa(3)CrQ CH(g) +CO(g) =GH(g) + CO(g)+H2O(l)AH = +121.5 kJ mol1碳与CO反应生成CQ脱离催化剂表面2 .汽车发动机工作时会产生包括 CO NO等多种污染气体,涉及如下反应: N(g) +Q(g)= 2NO(g) 2NO(g)+ O(g)= 2NO(g) NO(g) +CO(g) = CO(g) + NO(g)弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:(1)请根据下表数据填空:N(g) +Q(g) = 2NO(g
7、) ah=物质QNO能量(kJ)946497811.25(断开1 mol物质中化学键所需要的能量)(2)实验测得反应2NO(g)+Q(g)2NO(g) AH<0的即时反应速率满足以下关系式:v正=k正 c2(NO) c(O2) ; v逆=卜逆 c2(NO) , k正、k逆为速率常数,受温度 影响温度为Ti时,在1 L的包容密闭容器中,投入 0.6 mol NO?口 0.3 mol Q, 达到平衡时Q为0.2 mol;温度为T2时,该反应存在卜正=卜逆,则Ti(填 “大于”“小于”或“等于" )T2。研究发现该反应按如下步骤进行:ki正第一步:Na NOk mq 快速平衡ki第二
8、步:NQ+ Q> 2NO 慢反应其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:丫1正=总正 c2(NO); vi 逆=仁逆 c(N2Q)。下列叙述正确的是 。A.同一温度下,平衡时第一步反应的 鲁越大,反应正向进行的程度越大 ki逆B.第二步反应速率低,因而转化率也低C.第二步的活化能比第一步的活化能低D.整个反应的速率由第二步反应速率决定(3)科学家研究出了一种高效催化剂,可以将COW NO两者转化为无污染气 体,反应方程式为 2NQg) + 4CO(g)=4C2Og) +降包)A H<0O某温度下,向i0 L密闭容器中分别充入0.i mol NO 2和0.2 mol
9、 CO ,发生 上述反应,随着反应的进行,容器内的压强变化如下表所示:时间/min02468i0i2压强/kPa7573.47i.9570.769.768.7568.75回答下列问题:在此温度下,反应的平衡常数 &=kPa-(&为以分压表示的平 衡常数,计算结果精确到小数点后 2位);若保持温度不变,再将 CO CO气体 浓度分别增加一倍,则平衡 (填“右移” “左移”或“不移动”)。若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?(填“增大” “减小”或“不变”),原因是解析:(i)计算出N(g) +O(g) = 2NO(g)的A H= E(反应物键能)一 E
10、(生成物键能)=(946 + 4978ii.25 x 2) kJ/mol = i79.5 kJ/mol 。(2)温度为 Ti 时:2NO(g)+Q(g)=1 2NO(g)开始(mol/L)0.60.30转化(mol/L)0.20.10.2平衡(mol/L)0.40.20.2则温度为T1时,平衡常数K二0.2 2- 0.4 2X0.2= 1.25 ,由于平衡时v正=丫逆,不难推出平衡常数等于速率常数之比,即Ki=l=1.25;温度为T2时,该反应存K逆在&=L=1,&<Ki,由于反应为放热反应,温度越高平衡常数越小,所以<丁2K逆由分析可知,当第一步反应达平衡状态时,
11、V1正=丫1逆,由于速率常数之比实际上就是平衡常数,平衡常数越大,反应正向进行的程度越大,A正确;反应速率快慢与转化率之间无因果关系,B错误;相同温度下,第一步反应快速达 到平衡,第二步是慢反应,所以第二步活化能比第一步高,C错误;整个反应的化学反应速率由第二步慢反应决定,D正确。(3)向10 L密闭容器中分别充入 0.1 mol NO2和0.2 mol CO ,反应10 min 达到平衡,体系内压强由75 KPa减少到68.75 KPa ,则反应中各物质的浓度变 化为2NO(g) +4CO(g)4CO(g) +N2(g)AH<0开始(mol/L) 0.010.02转化(mol/L) 2
12、 x4x4x平衡(mol/L) 0.01-2x0.02 4x根据0.0375c 平衡p 平衡'0.03x 68.75,解得x = 0.002 5 mol/L ;根据公4Pp no. Pp4 9 P(A)=P(总)xn,可得 &= 0.04 KPa1。若平衡后再将CO CO的浓度增加一倍,由于方程式中两种物质的系数相同,所以Q=K,因此化学平衡不发生移动。降低温度,体积不变,根据阿伏加德罗定律,压强减小;同时该反应的 正反应为放热反应,降低温度,平衡正向移动,导致体系内气体分子数减少, 所以总压强也会减小。答案:(1)179.5 KJ/mol (2)小于 AD(3)0.04 不移
13、动 减小 若温度降低,体积不变,根据阿伏加德罗定 律,总压强减小;同时,降低温度,由于反应放热,所以平衡朝正方向移动, 容器内分子数减少,总压强也减小3 .铁及其化合物在生产、生活中有广泛的应用。(1)复合氧化物铁酸锐(MnFaO)可用于热化学循环分解制氢气,原理如下:x一MnFeC4(s)=MnFeO4 x)(s) +5。©)A HiMnFeQ4 x)(s) +xHO(g)=MnFq(s) +xH2(g)AH22H2O(g)=2H(g) + Q(g)A H则:A H3与A H、A H2的关系为A H3 =。(2)纳米铁是重要的储氢材料,可用下列反应制得:Fe(s) +5CO(g)F
14、e(COMg)AH< 00在1 L包容密闭容器中加入足量铁粉和 0.5 mol CO ,在Ti、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图1所示。Ti(填“>”或)丁2。T2温度下,上述反应的平衡常数 K=(结果不要求带单位)。(3)高铁酸钾(KzFeO)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至 弱碱性条件下不稳定。工业上用 KCIO与Fe(NO) 3溶液反应制得 K2FeO,反应的离子方程式为制备K2FeO时,KCIO饱和溶液与 Fe(NO)3饱和溶液混合的操作为已知K2FeO在水解过程中铁元素形成的微粒分布分数与pH的关系如图2所示。向pH=6的溶液中加
15、入KOH溶液,发生反应的离子方程式为 电解法可制得KFeO,装置如图3所示。阳极的电极反应式为r>sn 4 2 L a ft a a«全璋全解析:(1)复合氧化物铁酸锐(MnFe。)可用于热化学循环分解制氢气,原理 如下:xMnFeQ(s)=MnFeO4 x)(s)+Q(g)a HiMnFeQ4 x)(s) +xHO(g)=MnFq(s) + xH2(g)A H22H2O(g)=2H(g) + Q(g)A H2X+X 2根据盖斯 止律,1可 得2HO(g)=2H(g) + O2(g)A H = 2 A H1+ A H2o 图1中,温度为Ti时曲线斜率大,且优先达到平衡状态,说明
16、温度 T1 较高,则温度丁1丁2。T2达到平衡状态时c(CO)=0.1 mol/L ,Fe(s) +5CO = Fe(CO%(g)初始(mol/L)0.50转化(mol/L)0.40.08平衡(mol/L)0.10.08则T2温度下,该反应的平衡常数0.083K= ri=8X 10。0.1(3)将Fe(NO)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO,则 在KOH容液中,Fe(NO)3与KClO反应生成K2FeO、KCl和KNQ反应的方程式为 2Fe(NO)3+3KClO+ 10KOH=2KeQ+6KNO+ 3KCl + 5HO,改成离子方程式为 2Fe3 + 3ClO + 10
17、0H =2Fe6 + 3Cl + 5H2O;高铁酸钾在酸性至弱碱性条件下 不稳定,制备K2FeO时,KC1O饱和溶液与Fe(NO)3饱和溶液混合的操作为:在 搅拌下,将饱和Fe(NO)3溶液缓慢滴加到KC1O溶液中。当pH= 6时溶液中主要存在HFeO,加入KOH§液后HFeO的浓度减小,FeO一的浓度增大,说明发生反应:HFeQ + OH=FeO + H2Q(4)根据图3可知,阳极Fe失去电子结合氢氧根离子生成 FeO ,电解过程 中阳极的反应式为Fe- 6e +8OrH =Fe6+4HA-2 AH+A H不 八 3答案:(1) (2)>8X103x(3) 2Fe3 + +
18、3C1O + 10OH =2Fe(2T + 3C1+ 5H2O 在搅拌下,将饱和Fe(NO) 3溶液缓慢滴加到KC1O溶液中 HFeO + OH =FeO! + HO(4)Fe 6e + 80H=Fed + 4H2O4. (2018 全国卷I )采用NQ为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题:(1)1840年Devil用干燥的氯气通过干燥的硝酸银,得到NO。该反应的氧化产物是一种气体,其分子式为。(2)F.Daniels 等曾利用测压法在刚性反应器中研究了25 C时N2c5(g)的分解反应:汉0.小)其中NO二聚为NQ的反应可以迅速达到平衡。体系的
19、总压强 p随时间t的 变化如表所示t = 8时,NQ(g)完全分解:t /min040801602601 3001 700oop/kPa35.840.342.545.949.261.262.363.1已知:2N2Q(g)=2N2Q(g) + O(g) AH = 4.4 kJ mol_ _ 12N(2(g)=N2Q(g)A H2 = 55.3 kJ - mol1 一 一,则反应 N?Q(g)=2NO(g) +2Q(g)的 A H=kJ - mol。研究表明,NQ(g)分解的反应速率 v=2x 103xpNQ(kPa - min 1) 0 t = 62 min时,测得体系中pQ = 2.9 kPa
20、,则此时的pNQ=kPa,v = kPa - min (填标号)。A. v(第一步的逆反应)>v(第二步反应)B.反应的中间产物只有NOC.第二步中NO与NO的碰撞仅部分有效D.第三步反应活化能较高解析:(1)Cl 2与AgNO反应生成NO,还应该有AgCl,氧化产物是一种气体, 则该气体为Q。 ,(2)把已知两反应按顺序编号为a、b,根据盖斯定律,a式x 2b式可得:-11-1NQ(g)=2NO(g) +2Q(g)A H +53.1 kJ - mol由方程式 2NO5(g)=4NO(g) +Q(g)可知,62 min 时,pQ=2.9 kPa,则 减小的 NO为 5.8 kPa ,止匕
21、时 pNn = 35.8 kPa 5.8 kPa =30.0 kPa ,则 v(MQ) = 2X 10 3X30.0 kPa - min 1 = 6.0X10 2 kPa - min 1。温度提高,体积不变,总压强提高;NO二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高。时间无限长时NQ完全分解,故由2NO(g)=4NO(g) +Q(g)知,此时生 成的 pNO = 2pNQ= 2 x 35.8 kPa = 71.6 kPa , pQ= 0.5 x 35.8 kPa = 17.9 kPa。0若提高反应温度至35 C,则NQ(g)完全分解后体系压强p«. (35 C)
22、(填“大于” “等于”或“小于” )63.1 kPa ,原因是。25 C时NQ(g)2NO(g)反应的平衡常数 & =kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。(3)对于反应2NQ(g) >4NO(g) + O2(g) , R.A. Ogg提出如下反应历程:第一步 NQ = NO+ NO快速平衡第二步 NO+ NO->Nd NO+ O2慢反应第三步 NJ NO-> 2NO快反应其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是由题意知,平衡时体系的总压强为 63.1 kPa ,则平衡体系中NO、降。的压强和 为 63.1 kPa 17.9
23、kPa =45.2 kPa ,设 NQ 的压强为 x kPa , WJMQ(g)= 2NO(g)初始压强/kPa071.6转化压强/kPax2x平衡压强/kPax71.6-2x则 x + (71.6 2x)=45.2,解得 x = 26.4,71.6 kPa 26.4 kPa X 2= 18.822kPa,13.4 kPapNO 18.8 kPaKp=pNO4= 26.4 kPa(3)第一步反应快速平衡,说明正、逆反应速率很大,极短时间内即可达到 平衡,A项正确;由题给三步反应可知,反应的中间产物有 NO和NO B项错误; 第二步反应慢,说明有效碰撞次数少,C项正确;反应快,说明反应的活化能较
24、 低,D项错误。答案:(1)02 (2)+53.1 30.0 6.0 X 10 2大于 温度提高,体积不变,总压强提高;NO二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高13.4 (3)AC5. (2018 全国卷H )CHCO催化重整不仅可以得到合成气(CO和H),还 对温室气体的减排具有重要意义。回答下列问题:(1)CH4CO催化重整反应为 CH(g) +CO(g)=2CO(g)+2H(g)。已知:C(s)+2H(g)=CH(g)A H= 75 kJ molC(s) +2c2(g)=CO(g) AH= - 111 kJ - mol 1该催化重整反应的A H=kJ mo|T
25、。有利于提高CH平衡转化率的 条件是(填标号)。A.高温低压B.低温高压C.高温高压D.低温低压某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时 CO的转化率是50%其平衡常数为 mol2 - L_ _. . 1C(s) + Q(g)=CO(g)A H= 394 kJ - mol-2o(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:积碳反应CH(g)= C(s) +2H(g)消碳反应CO(g) + C(s) =2CO(g)AH(kJ- mol1)75172活化能/催化剂X33911(kJ -
26、 mol )催化剂Y4372由上表判断,催化剂X(填“优于”或“劣于” )Y,理由是在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温 度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常 数(K)和速率(v)的叙述正确的是(填标号)。170500 550 600 650 7008 4 史魏B:京A. K积、K消均增加B. v积减小、v消增加C. K积减小、K消增力口D. v消增加的倍数比v积增加的倍数大在一定温度下,测得某催化剂上沉积碳的生成速率方程为v = k p(CH4) p(CQ) 0.5(k为速率常数)。在p(CH) 一定时,不同p(CO)下积碳
27、量随时间的变化趋势如图所示,则 pa(CQ)、pb(CQ)、pc(CQ)从大到小的顺序为0 4 a 12 16Anin解析:(1)将题给已知三个反应依次编号为、,根据盖斯定律,由x 2可得:CH(g) + CO(g)=2CO(g) + 2H2(g)1A H= 247 kJ - mol 1根据平衡移动的影响因素,该反应的正反应是一个吸热、气体体积增大的 反应,所以高温低压有利于反应正向移动。CH(g) + CO(g)=2CO(g) + 2H(g)起始浓度/mol, L 110.500转化浓度/mol, L 10.250.250.50.5平衡浓度/mol, L 10.750.250.50.5c2
28、CO c2 H20.5 mol L 1 2x 0.5 mol L 1 2_ 1 p 2:c CH c CO = 0.75 mol L 1X0.25 mol L 1 =3 mo '°(2)积碳反应中,由于催化剂 X的活化能比催化剂Y的活化能要小,所以 催化剂X更有利于积碳反应的进行;而消碳反应中,催化剂X的活化能大于催化剂Y,所以彳S化剂Y更有利于消碳反应的进行;综合分析,催化剂 X劣于催化 剂Y。由表格可知积碳反应、消碳反应都是吸热反应,温度升高,平衡右移,K积、K消均增加;温度升高,反应速率均增大,从图像上可知,随着温度的升高, 催化剂表面的积碳量是减小的,所以 v消增加的
29、倍数要比v积增加的倍数大。由速率方程表达式v = k p(CH) p(CQ) 0.5可知,v与p(CQ)成反比例 关系,p(CQ)越大,反应速率越小,所以 pc(CQ) >pb(CQ) >pa(CQ)。1答案:(1)247 A - 3(2)劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的 速率小;而消碳反应活化能相对小,消碳反应速率大ADpc(CQ)、pb(CQ)、pa(CQ)6. (2018 全国卷田)三氯氢硅(SiHCl 3)是制备硅烷、多晶硅的重要原料。 回答下列问题:(1)SiHCl 3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成 (HSiO)2O等,写
30、出该反应的化学方程式 14(2)SiHCl 3在催化剂作用下发生反应:2SiHCl3(g)=SiH2Cl2(g) +SiCl 4(g)AH = 48 kJ mol13SiH2cl2(g)=SiH"g) +2SiHCl3(g)A H= -30 kJ mol1则反应 4SiHCl3(g)=SiH4(g) +3SiCL(g)的AH为 kJ - mol1。(3)对于反应2SiHCl3(g)=SiH2cl2(g) +SiCl 4(g),采用大孔弱碱性阴离子 交换树脂催化剂,在323 K和343 K时SiHCL的转化率随时间变化的结果如图 所示。343 K时反应的平衡转化率 民=%平衡常数 &a
31、mp;3K=(保 留2位小数)。在343 K下:要提高SiHCl3转化率,可采取的措施是 ;要缩短 反应达到平衡的时间,可采取的措施有 ? 。比较a、b处反应速率大小:va(填“大于”“小于”或“等于")vb。 反应速率v = v正一v逆=k FX2SiHCl3k逆xSiH2cLxSiCl 4, k正、k逆分别为正、逆,一、,、,一 ,一一.,一八,、一,.,- v正 ,、,向反应速率吊数,x为物质的重分数,计算a处的一 =(保留1包小数)解析:(1)SiHCl 3遇潮气时发烟生成(HSiO)2O等,结合原子守恒推知 SiHCl 与水蒸气反应除生成 (HSiO)2O外,还生成 HCl
32、,化学方程式为 2SiHCl3 + 3HO=(HSiO)O+ 6HCl。(2)将题给两个热化学方程式依次编号为、,根据盖斯定律,由X 3 +可得:4SiHCl3(g)=SiH4(g) + 3SiCl 4(g),则有 A H= 3 A H+A H2=3X48 kJ mol 1+(-30 kJ mol1) =114 kJ mol1。(3)温度越高,反应速率越快,达到平衡的时间越短, a点所在的曲线达到 平衡的时间短,则a点所在的曲线代表343 K时SiHCl3的转化率变化,b点所在 的曲线代表323 K时SiHCl3的转化率变化。由题图可知,343 K时反应的平衡转化率a =22%设起始时SiHC
33、l3(g) 的浓度为1 mol - L 1,则有2SiHCl3(g)=SiH 2c12(g) +SiCl 4(g)起始浓度/molL1100转化浓度/molL 10.220.110.11平衡浓度/molL 10.780.110.11则343 K时该反应的平衡常数K343 K =-1 2c SiH2cl2 c SiCl 40.11 mol ' L2 _c SiHCl31 2 0.78 mol - L0.02。17在343 K时,要提高SiHCl3转化率,可采取的措施是及时移去产物,使 平衡向右移动;要缩短反应达到平衡的时间,需加快化学反应速率,可采取的 措施有提高反应物压强或浓度、改进催
34、化剂等。温度越高,反应速率越快,a点温度为343 K, b点温度为323 K,故反 应速率:Va>Vb。反应速率v=v正一v逆=卜正x2SiHCl3 k逆xSiH2cLxSiCl 4,则有 v正= kFX2SiHCL v逆=卜逆xSiH2cLxSiCl 4, 343 K下反应达到平衡状态时丫正=丫 逆,即 k 正x2SiHCl3=k逆xSiH2cLxSiCl 4,设起始时 SiHCL(g)的浓度为 1 mol - L 1此时SiHCl3的平衡转化率a =22%经计算可得SiHCL、SiH2c医SiCl4的物质2 一,力k k 正 0.11的量分数分别为 0.78、0.11、0.11,则有
35、 k 正X0.782=k逆X 0.112, 二=0=k 逆 0.780.02; a处SiHCl3的平衡转化率a =20% 此时SiHCL、SiH2c小SiCl 4的物质的量分数分别为一.,.v 正0.8、0.1、0.1,则有片k 正 x2SiHCl3k 正-一k逆xSiH2cLxSiCl 4 k逆x2SiHCl3xSiH2cLxSiCl 421.30.80.02 X- 0.1答案:(1)2SiHCl 3+ 3H2O=(HSiO)0 6HCl(2)114 (3)22 0.02 及时移去产物改进催化剂提高反应物压 强(浓度)大于 1.37. 近期发现,HS是继NO CO之后的第三个生命体系气体信号
36、分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是 (填标号)A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以8. 氢硫酸的导电能力低于相同浓度的亚硫酸C. 0.10 mol L-的氢硫酸和亚硫酸的pH分别为4.5和2.1D.氢硫酸的还原性强于亚硫酸(2)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反 应系统原理。热化学硫碉期环水分擀制总系策(1)S03* 0,(g) 白 ff-327 kJ ' rniJ1箱2En-qdLSOdU-i) A/<-l51kJ * mn尸tfetjO+L (*)
37、3& =K)kJ * HtdW用铀+$50也1)=购:彘后石©疝T 获石匚i:L热化学嬉暖循环硫比应分解联产辄气.破黄系统通过计算,可知系统(I )和系统(R )制氢的热化学方程式分别为 > 2制得 等量从所需能量较少的是(3)H 2s与 CO在高温下发生反应:H2s(g) +CG(g) =1 COS(g)+ HO(g)。 在610 K时,将0.10 mol CO 2与0.40 mol H 2s充入2.5 L的空钢瓶中,反应平 衡后水的物质的量分数为0.02。HS的平衡转化率 *=,反应平衡常数K=。在620 K重复实验,平衡后水的物质的量分数为 0.03, HS的转化
38、率a2 a 1,该反应的 A H0。(填“>” “<”或“=")向反应器中再分别充入下列气体,能使HS转化率增大的是 (填标号)。A. H2sB. COC. COSD. N解析:(1)根据较强酸制备较弱酸原理,氢硫酸不和 NaHC3®应,亚硫酸与 NaHCW应,说明亚硫酸、碳酸、氢硫酸的酸性依次减弱,A项不符合题意;相同浓度,溶液的导电能力与离子总浓度有关,相同浓度下,氢硫酸溶液导电能 力弱,说明氢硫酸的电离能力较弱,即电离出的氢离子数较少,B项不符合题意; 相同浓度下,亚硫酸的pH较小,故它的酸性较强,C项不符合题意;酸性强弱 与还原性无关,酸性强调酸电离出氢
39、离子的难易,而还原性强调还原剂失电子 的难易,D项符合题意。(2)系统(I)和系统(n)都是吸热反应,从热化学方程 式可以看出,系统(H)制备1 mol凡需要消耗20 kJ能量,而系统(I)制备1 mol H2需要消耗286 kJ能量,故系统(H)消耗的能量较少。(3)用三段式法计算: 该反应是等气体分子数反应,平衡时 n(HzO)= 0.02 X 0.50 mol =0.01 mol。HS(g) + CO(g) = COS(g)+ HO(g)起始/mol 0.400.100转化/mol 0.01平衡/mol 0.390.010.010.090.010.010.010.01 "1:0
40、40*100险2.5%;对于等气体分子数反应,可直接用物质的量替代浓度计算平衡常数:K=c COS - c HO 0.01 X0.01-TTT一_ c H2S - c CO 0.39 X0.09= 2.8 X 10 30总物质的量不变,代。的物质的量分数增大,说明平衡向右移动,H2S的转化率增大;即升高温度,平衡向正反应方向移动,正反应是吸热反应平衡之后,再充入HS,19则CO的转化率增大,H2s的转化率减小,A项错误;充入CO,平衡向右移动,H2s的转化率增大,B项正确;充入COS平衡向左移动,HS的转化率减小,C 项错误;充入 电无论体积是否变化,对于气体分子数相等的反应,平衡不移 动,H
41、2S的转化率不变,D项错误。答案:(1)D.1A H= 286 kJ - mol ,1 H 2O(l)=H2(g) + 2O2(g)HS(g)=H2(g) +S(s)AH= 20 kJ mol系统(H)(3)2.5% 2.8X10 3 > > B8.丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:(1)正丁烷(C4H10)脱氢制1-丁烯(CM)的热化学方程式如下:QH10(g)=CH(g) + H(g)A Hi已知: GH°(g) +-O2(g)=C4H8(g) +H2O(g)AH2=119 kJ mol1一 H2(g) +2Q(g)=H2O(g)AH3=
42、242 kJ - mol 1反应的A H为 kJ - mol 10图(a)是反应平衡转化率与反应温度及压强的关系图,x(填“大于”或“小于” )0.1 ;欲使丁烯的平衡 产率提高,应采取的措施是 (填标号)。A.升高温度B.降低温度C.增大压强D.降低压强I 2 工 * 5 &庭内晒内;T-fc?(2) 丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器 (氢气的 作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图 (b)为丁烯产率与 进料气中n(氢气)/ n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势, 其 降低的原因是(3)图(c)为反应产率和反应温度的关系曲线,副产
43、物主要是高温裂解生成 的短碳链姓类化合物。丁烯产率在 590 C之前随温度升高而增大的原因可能是、; 590 C之后,丁烯产率快速降低的主要原因可能是解析:(1)根据盖斯定律,可得:,则A H=A H2A H3= 119 kJ mor 1 + 242 kJ - mo1=123 kJ - mo1。反应为气体总体积增大的反应, 在温度相同时降低压强有利于提高平衡转化率,故x<0.1。反应为吸热反应,升高温度有利于平衡正向移动,A项正确;降低压强平衡向气体总体积增大的方 向移动,D项正确。(2)结合题图(b)可看出随着n(氢气)/ n(丁烷)增大,丁烯产 率先升高后降低,这是因为氢气是生成物,
44、当 n(氢气)/ n(丁烷)逐渐增大时,逆 反应速率增大,故丁烯的产率逐渐降低。(3)在590 C之前随温度升高丁烯产率逐渐增大, 这是因为温度升高不仅能 加快反应速率,还能促使平衡正向移动;但温度高于 590 C时,丁烯高温裂解 生成短链姓类,导致丁烯产率快速降低。答案:(1)123 小于 AD(2)氢气是产物之一,随着n(氢气)/ n(丁烷)增大,逆反应速率增大(3)升高温度有利于反应向吸热方向进行温度升高反应速率加快丁烯高温裂解生成短链姓类9. CO和CO可作为工业合成甲醇(CHOH用直接碳源,还可利用 CO据电化 学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO排放的目的。(
45、1)利用CO和凡反应合成甲醇的原理为:CO(g) +3H(g) = CHOH(g) + HO(g)。上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催 化剂中CuO的质量分数对CO的转化率和CHOH的产率影响的实验数据如下表所 示:WCuO)/%102030405060708090CHOH的产率25%30%35%45%50%65%55%53%50%CO的转化率10%13%15%20%35%45%40%35%30%由表可知,CuO的质量分数为时催化效果最佳。(2)利用CO和H在一定条件下可合成甲醇,发生如下反应:CO(g) +2寓g)CHOH(g),其两种反应过程中能量的变化曲
46、线如图中a、b所示,B. a反应正反应的活化能为510 kJ - molC. b过程中第I阶段为吸热反应,第R阶段为放热反应D. b过程使用催化剂后降低了反应的活化能和AHE. b过程的反应速率:第R阶段第I阶段(3)在1 L的恒容密闭容器中按物质的量之比1 : 2充入CO?口 H2,测得平 衡混合物中CHOH的体积分数在不同压强下随温度的变化情况如图 1所示,则压 强P2(填或“=")仍;平衡由A点移至C点、D点移至B 点,分别可采取的具体措施为 : C点时,CO的转化率为。甲和乙两个包容密闭容器的体积相同,向甲中加入1 mol CO和2 mol凡,向乙中加入2 mol CO和4
47、mol H 2,测得不同温度下 CO的平衡转化率如图2所 示,则L、M两点容器内压强:p(M)2p(L);平衡常数:K(M)K(L)(填 或“=”)。%O25D no 3504n 值加 550细 (Til(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通 入CO进行电解,在阴极可制得低密度聚乙烯HC-CH (简称LDPE)电解时,阴极的电极反应式是 工业上生产1.4 X102 kg的LDPE理论上需要标准状况下 L的 CO。解析:(1)相同的温度和时间段内,催化剂中 CuO的质量分数对CO的转化 率和CHOH的产率影响的实验数据分析可知, 氧化铜60%寸甲醇的产率最高,CO
48、的转化率最大,由表可知,CuO的质量分数为60%勺催化效果最佳。(2)上述反应的A H= 91 kJ - mol1,故A正确;a反应正反应的活化能为 419 kJ - mol1,故B错误;由图像曲线变化和能量变化可知,b过程中第I阶段生成物能量高,则第I阶段为吸热反应,第R阶段生成物能量低于反应物, 反应为放热反应,故C正确;b过程使用催化剂后降低了反应的活化能,加快反 应速率,不改变反应的A H,故D错误;b过程中第R阶段的活化能小于第I阶 段的活化能,反应速率:第R阶段第I阶段,故E正确。(3)由图像分析可知温度一定,压强增大平衡正向进行,甲醇体积分数越 大,故压强P2V P1;平衡由A点
49、移至C点是升温平衡逆向进行,保持压强为 P2, 将温度由250 C升高到300 C; D点移至B点是压强增大,保持温度为300 C, 将压强由P3增大到pi, C点时甲醇的体积分数50%在1 L的包容密闭容器中按 物质的量之比1 : 2充入COf口 H,,设CCW质的量为1 mol,氢气物质的量为2 mol, 设一氧化碳消耗物质的量为x,CO(g) + 2W(g)= CHOH(g)起始量(molL1)120变化量(molL1)x 2xx平衡量(molL1)1 x2 2xx丁)-=50% x = 0.75 mol , CO的转化率=075mo-X 100险 75% 3 2x "'
50、;1 mol甲和乙两个包容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 mol H2, M和L点CO的转化率相同,若温度相同,则 p(M) = 2p(L),但M点温度高,则L、M两点容器内压强:p(M)>2p(L) ; M点和 L点比较,M点温度高,平衡逆向进行,平衡常数:K(M) < K(L) 0(4)2nCO H2C-CH ,碳的化合价从+ 4变为一2,每个C原子得到6 个电子,则2nCO总共得到12n个电子,根据电荷守恒可得该电极反应式为 2nCO + 12ne+12nH+ = H2C CH +4nHQ工业上生产 1.4 X
51、 102 kg 的 LDPE( H2C- CH ),根据 2nCO H2C CH 1.4105 g可知,需要二氧化碳的物质的量为 -Hx2n=1X104 mol,理论上需28n g - mol要标准状况下 CO的体积是 22.4 L - mol1X 1X 104 mol =2.24 X 105 L。答案:(1)60% (2)ACE(3) < 保持压强为p2,将温度由250 C升高到300 C保持温度为300 C,将压强由p3增大到p1 75%<(4)2nCO+ 12nhl+ + 12ne = H2C CH +4nHO 2.24X10510. MnO可作氧化剂、催化剂和干电池中的去极
52、化剂,通过图 1装置焙烧MnCM以制取MnQ石英普MnCO.图I32已知:2MnO(s)+ Q(g)=2MnO(s)AH = a kJ molMnC0(s)=MnO(s) + CO (g) AH = b kJ moll回答下列问题:(1)写出图1装置中制取MnO勺热化学方程式: (A H用含a、b的代数式表示)。(2) 一定条件下,在1 L包容密闭容器中,该反应达到化学平衡时,CO与O2的物质的量之比为m,氧气的物质的量为2 mol ,则化学平衡常数K=mol L 1。(3)用真空抽气泵不断抽气的目的是 以化 学平衡的角度回答)。(4)某科研小组对碳酸锐与空气反应制备二氧化钮的条件(焙烧温度和
53、气氛)进行了研究,获得以下三幅图。100 2 5 (BOO 3 5 040045 廿邂空气中一/ >4100轼即it 604。2002 4 6 K 10培烧时间加m 反应温度与转化率的美泰 图3在小m气制中始烧的反应效果丽时4020O 10 20 箱如 5IJ水分含H/%图4湿空气中水分含状与转化率的美系制备时焙烧温度为 ,气氛条件为<图2中是在常压(0.1 MPaJF获得的数据,试在图2中用虚线画出10 MPa 下反应温度与转化率的关系图解析:(1)由题中信息可知,可认为制取 MnO的过程先后发生了两个反应: MnCO (s)=MnO(s) + CO (g) A H2 = b k
54、J mol 1 , 2MnO(s) + Q(g)=2MnO(s) AH = a kJ - mol1,由x 2 +可得制取 MnO的热化学方 程式为 2MnC侬)+C2(g)=2Mn(2(s) + 2CO (g)A H= (a+ 2b) kJ - mol1。(2) 一定条件下,在1 L包容密闭容器中,该反应达到化学平衡时,CO与C2的物质的量之比为 m,氧气的物质的量为2 mol,则CO的物质的量为2mmo1, CO和Q的物质的量浓度分别为 2mmol L和2 mol L-,该反应的化学平衡 常数 K= -2m- = 2n20(3)用真空抽气泵不断抽气的目的是减小生成物CO的浓度,使平衡正向移动,提高MnCO专化率。(4)制备时焙烧温度为350 C左右(或325375 C),气氛条件为湿空气, 其中水分含量
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025室内亲子主题乐园装饰装修工程合同范本范文
- 春节期间的随笔汇编10篇
- 感恩母亲讲话稿15篇
- 学习企业文化和员工敬业度
- 商业银行的风险防控与合规监管
- 技术服务工程师总结范文(7篇)
- 家庭教育与孩子体育素质的培养
- 科技与艺术的完美结合-平面设计新篇章
- 绿色创新环保科技企业的成功故事
- 入团志愿书9-多篇
- 【七上HK数学】安徽省蚌埠市固镇县2024-2025学年七年级上学期1月期末试卷数学试题
- 电信网和互联网图像篡改检测技术要求与测试方法
- 2025届江苏省南京市盐城市高三一模考试语文试题 课件
- 供货方案及时间计划安排
- 唐山动物园景观规划设计方案
- 中国版梅尼埃病诊断指南解读
- 创业投资管理知到章节答案智慧树2023年武汉科技大学
- 暨南大学《经济学》考博历年真题详解(宏观经济学部分)
- GB/T 8014.1-2005铝及铝合金阳极氧化氧化膜厚度的测量方法第1部分:测量原则
- eNSP简介及操作课件
- 运动技能学习与控制课件第七章运动技能的协调控制

评论
0/150
提交评论