



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
8.5消除反应的机理一、两种消除机理(El和E2)卤代烃的消除也有两种与SNI,SN2对应的机理:单分子消除(unimolecularelimination)机理(El)和双分子消除(bimolecularelimination)机理(E2)。
1.单分子消除机理(E1)
叔丁基溴在碱性溶液中发生消除分两步进行:
第一步,离去基团先带着电子对离开中心碳原子,经由第一过渡态断裂C—Br键,形成碳正离子;
第二步,碳正离子经由第二过渡态失去β-质子(被碱所接收)而生成烯烃。在决定反应速度的第一步只涉及卤代烃一个分子,所以称为单分子消除,用E1表示(elimination,“1”代表单分子)。
E1反应的第一步和Sn1的相同,因此二者具有某些类似的特征。在动力学上是一级反应,如结构允许,常常伴随重排等。
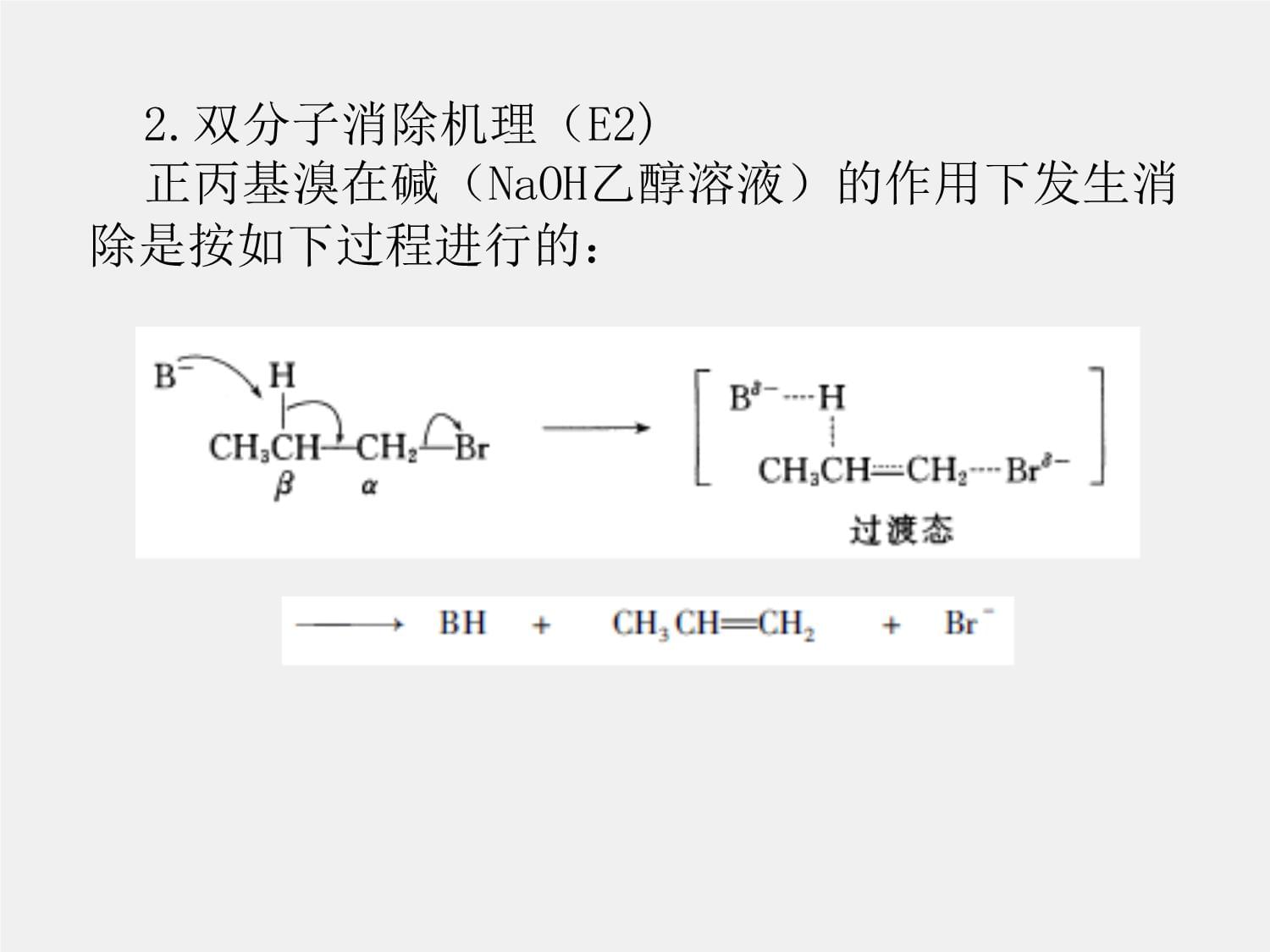
2.双分子消除机理(E2)
正丙基溴在碱(NaOH乙醇溶液)的作用下发生消除是按如下过程进行的:
如果在决定反应步骤中,涉及C—H键的断裂,那么该原子的较重同位素所参加的反应将变得较慢。例如,普通异丙基溴和氘代异丙基溴在乙醇钠作用下,前者脱HBr速度比后者的快7倍,这说明在决定反应速度步骤中涉及C—H和C—D键的断裂。二、影响消除反应机理及其活性的因素
卤代烃的消除反应按哪种机理进行以及它们的相对活性也受多种因素的影响,与亲核取代有很多相似之处,但也有不同之点。
1.烃基的结构
与SN1一样,不同烃基的卤代烃按E1机理消除的相对活性为:叔卤>仲卤>伯卤。烯丙型卤代烃如经过消除能生成共轭二烯,其消除活性特别高。
E2反应与SN2有些类似,但结构与活性的关系却完全不同。已知SN2反应的相对活性是伯卤>仲卤>叔卤,而E2反应却是叔卤>仲卤>伯卤。这是为什么?
在SN2反应中,亲核试剂(实际上也是碱试剂)是进攻中心碳原子,空间因素对反应速度有明显的影响,因此叔卤的活性最低。而在E2反应中,碱试剂是进攻β-H,这种进攻基本上不受α-C上所连基团的空间障碍影响。相反α-C上所连烃基越多,β-H的数目就越多,它们被碱试剂进攻的机会就越多,反应就进行得越快。可以说这是叔卤活性大于仲卤、伯卤的原因之一。
此外,叔卤消除后,产物的双键碳上所连的烃基数目比仲卤、伯卤的多,所以叔卤消除所生成的烯烃相对稳定性较高。这是叔卤按E2机理消除活性较大的另一个原因。2.卤素种类
当烃基相同,而卤素种类不同时,消除反应的活性顺序为:
RI>RBr>RC1
不管是El机理,还是E2机理,卤原子总是要带着电子对离开中心碳原子,所以有较好离去基团的碘代烃,其消除活性最高。3.碱试剂
只有E2反应与试剂的碱性强弱、浓度有关,高浓度的强碱试剂可提高E2反应的速度。E1反应不受试剂的碱性和浓度的直接影响。4.溶剂
E1反应中C—X键的解离受溶剂的影响比较明显,极性较大的溶剂可提高E1反应的速度,而对E2反应是不利的。
卤代烃的消除反应在机理的选择上主要受以上诸因素的影响。从卤代烃的结构看,叔卤倾向于E1机理,伯卤倾向于E2机理,仲卤居中,但比较倾向于E2。高浓度的强碱有利于E2,而较低浓度的弱碱有利于E1。高极性溶剂有利于E1,低极性溶剂有利于E2。改变反应条件,可使某种卤代烃的消除由一种机理转向另一种机理。三、消除反应的方向
卤代烃的消除是一种定向反应,其消除取向遵循萨伊切夫规律。在此我们将从反应机理的角度来解释这种规律。1.E2反应
在E2反应中,碱试剂进攻β-H,卤素离开中心原子,经由过渡态生成烯烃。当有两种不同的β-H时,碱优先进攻哪个β-H主要决定于相应过渡态的稳定性,由于在过渡态已有部分双键形成,所以能够稳定烯烃产物的因素,也能够稳定相应的过渡态。我们知道,双键上含有较多烷基的烯烃比较稳定,因此部分双键碳上连有较多烷基的过渡态也比较稳定。
而这种过渡态正是由碱试剂进攻含氢较少的那个β-C上的氢而形成的。通过该过渡态所需活化能较低,容易发生消除,因此所得到的主要产物是双键上连有较多烷基的烯烃。2.E1反应
在E1反应中,第一步是C—X键断裂,生成碳正离子,产物的取向与这一步无关。决定产物取向的是第二步,即碳正离子甩掉哪个β-H?在第二步的过渡态中也已形成了部分双键。与E2反应类似,当生成双键有较多烷基的烯烃时,相应过渡态比较稳定,活化能较低,能够优先进行反应。例如
和马氏规则一样,对萨伊切夫规律也要抓住它的本质,才能正确处理消除的取向问题,例如:
在这里,卤代烃分子中,两个β-C上所含H数一样多,显然应优先生成比较稳定的共轭烯烃。
卤代烃的消除一般都遵循萨伊切夫规律,但受其他因素的影响,也有例外的情况:四、E2反应的立体化学
在E2反应中,C—L和C—H键逐渐断裂,π键逐渐形成,如果两个被消除的基团(L,H)和与它们相连的两个碳原子处于共平面关系(即L—C—C—H在同一平面上),在形成过渡态时,两个变形的sp3杂化轨道可以尽可能多地交盖(形成部分π键)而降低能量,有利于消除反应的进行。能满足这种共平面的几何要求的有顺叠和反叠两种构象:
由于反叠是能量较低的优势构象,而且当H、L处于反平行关系时,对碱进攻β-H和L的离开都是有利的,所以大多数E2反应为反式消除(图8-4)
在少数情况下,由于几何原因,当分子达不到反叠构象时,则为顺式消除。
对一定构型的反应物,按E2机理进行消除,在写消除产物时,必须把被消除的两个基团(L,H)放在反平行的位置(即反式共平面关系)。例如,1-溴-1,2-二苯基丙烷的两种异构体在NaOH醇溶液中消除分别得到不同构型的烯烃产物:
卤代环己烷进行E2消除,卤原子总是优先与反式β-H消除。在有两种β-H的情况下,优势产物再由萨伊切夫规律决定。在这里还有一点要特别指出的是,为了满足反式共平面的关系,消除基团必须处在a键上,如果它们处在e键,则不能共平面。在下列两个反应中,化合物8反应速度比9慢的事实正说明了这一点五、取代反应和消除反应的竞争
卤代烃既可以发生取代反应,又可以进行消除反应,而且这两种反应一般都是在碱性条件下进行。所以取代和消除往往是同时存在的竞争反应。
根据卤代烃和反应条件的不同,它们可以按单分子机理反应(SNI对E1的竞争),也可以按双分子机理反应(SN2对E2的竞争)。也可能既有单分子机理,又有双分子机理,即SN1,SN2,E1,E2四种机理同时存在,其竞争情况比较复杂。但从产物来看,无非还是两种,取代产物和消除产物。因此我们可以不管反应机理如何,综合分析卤代烃的结构和反应条件对取代、消除的影响,了解二者竞争的一般规律,以便选择适当条件使反应按我们预期的方向进行。1.卤代烃的结构(1)一级卤代烃倾向于发生取代反应,只有在强碱条件下才以消除为主。反应常按双分子机理(SN2或E2)进行。
⑵三级卤代烃倾向于发生消除,即使在弱碱条件下(如Na2C03水溶液),也以消除为主。只有在纯水或乙醇中发生溶剂解,才以取代为主。(3)二级卤代烃的情况介于三级和一级之间。在一般条件下,有较大的取代倾向,但消除程度比一级卤代烃大得多。究竟以哪种反应为主,主要决定具体的卤代烃结构和反应条件。在强碱(NaOH/乙醇)作用下主要发生消除。与伯卤一样,β-C上连有支链的仲卤代烃消除倾向增大。
综上所述,对不同卤代烃来说,其取代和消除倾向为:2.试剂的碱性和亲核性
试剂的影响主要表现在双分子反应中,试剂的碱性越强,浓度越高,越有利于消除。反之,碱性较弱,浓度较低则有利于取代。这是由于在消除反应中,除去β-H需要强碱试剂,一般的碱性试剂都有一定的亲核性,但试剂的碱性和亲核性之间没有完全的平行关系。有些试剂碱性虽弱,但其亲核性较强,利于取代。
试剂的体积大,因空间障碍而不易进攻中心碳原子(Sn2),但与β-H接近不会受到明显影响,因而有利于消除。3.溶剂的极性
溶剂的极性对取代和消除的不同影响主要也表现在双分子机理中。极性较高的溶剂有利于取代(SN2),极性较低的溶剂有利于消除(E2),这是因为在取代反应过渡态中负电荷分散程度比消除反应过渡态的小。较高极性溶剂对取代反应过渡态的稳定作用比消除大。所以由卤代烃制备醇(取代)一般在NaOH水溶液中(极性较大)进行。而制备烯烃(消除)则在NaOH醇溶液中(极性较小)进行。4.反应温度
升高温度有利于消除,这是因为在消除过程中涉
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 二零二五年度人事外包与员工职业规划实施合同
- 2025年度离婚后子女抚养权变更及监护权移交协议
- 二零二五年度摩控型摩托手车买卖协议
- 二零二五年度原创小说著作权许可与影视改编协议
- 二零二五年度办公室租赁合同模板:含餐饮及休闲设施
- 二零二五年度医疗健康产业银行担保贷款协议
- 2025年度绿色建筑节能材料联合投标协议书
- 二零二五年度岗位股权激励与员工激励方案协议
- 二零二五年度房屋租赁合同租赁期满续租协议范本
- 二零二五年度手车交易过户售后服务保障合同模板
- 《课堂管理方法与技巧》课件
- 五年级语文下册 第三单元过关测评卷(部编版)
- 任职以来专业技术能力主要工作业绩和履行岗位职责情况
- 高考英语单词(3500个)
- 《浙艺玩具公司库存管理问题探究》开题报告3000字
- 图解《黑神话悟空》微课件
- TCPHA 33-2024 通 用码头和多用途码头绿色港口等级评价指南
- 期中测试题-2024-2025学年语文六年级上册统编版
- 数字信号处理(第2版)课件 钱玲 第1-3章-引言、离散时间信号与系统、离散傅里叶变换(DFT)
- VTE评分量表解读 课件2024.8
- 部编人教版五年级下册小学道德与法治全册课时作业(一课一练)

评论
0/150
提交评论