



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
备战2025年高考化学模拟卷(安徽专用)
(考试时间:75分钟试卷满分:100分)
可能用到的相对原子质量:HllC12N14016
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.近年来,我国航空航天事业取得了很多令世界瞩目的成就。下列说法错误的是
A.石墨烯与金刚石、石墨互为同素异形体
B.铝、镁、铁等合金广泛应用于飞船建造,合金的熔点通常高于其组成金属的熔点
C.树脂基复合材料是以有机聚合物为基体的纤维增强材料,其属于有机高分子材料
D.当光束通过空间站热控材料使用的纳米气凝胶时,可观察到丁达尔效应
2.物质性质决定用途,下列两者对应关系错误的是
A.石灰乳除去废气中二氧化硫,体现了Ca(OH)z的碱性
B.氯化铁溶液腐蚀铜电路板,体现了Fe?+的氧化性
C.制作豆腐时添加石膏,体现了Cas。,的难溶性
D.“黑面包”实验体现了浓硫酸的脱水性、强氧化性
3.下列化学用语或图示表达正确的是
B.激发态H原子的轨道表示式:|_|I।I
IsIp
C.N?的p-p0键的形成:-88--
D.电子式表示Mgj形成过程::百GMg*罕.百:一►[:ci;]-Mg2+[;ci:]-
4.工业上以钛铁矿(FeTiOs,其中Fe为+2价)为主要原料制备金属钛的工艺流程如图所示,下列说法正确
的是
焦炭ClCO
Ji2I
FeTiO—J嬴」TiClMg
34»Ti
Ar气氛中、800℃
FeCl3
A.“氯化”过程中,每生成O.lmolCO气体,转移电子0.2mol
B.由TiCl’制备Ti的过程中,Ar的作用是防止Mg、Ti被氧化,因此也可用N2代替
C.氯化过程中FeTiO3和焦炭均被氧化
D.用于还原的Mg工业上可以采用电解熔融MgO的方法制取
5.下列图中的实验方案,能达到实验目的的是
n
不断搅拌酸性高镐
冷水酸钾溶液
三歹固体
黄合物乙醇
石棉网三隼一浓硫酸FeCb和FeCl
有色布条有色布条的混合溶液
A.分离碘和氯化B.混合浓硫酸和乙C.探究氯水中具有漂白性的D.证明混合溶液中有
钠醇微粒Fe2+
阅读下列材料,完成下面小题。
资源化利用CC)2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
I.CO?的捕集
方法1:用Na2cO3溶液做吸收剂可“捕集”CO?。随着反应的进行,若吸收剂失活,可利用NaOH溶液
使其再生。
方法2:聚合离子液体是目前广泛研究的CO?吸附剂。实验得出聚合离子液体在不同温度、不同CO?流
28
24
20+10mL-min-1
16
■o30mL'min"1
12
■^■lOOmLmin-1
8
4
0.____
04080120160200240280min
聚合离子液体在不同CO?流速下对CO曲吸附量
II.CC>2合成乙酸:中国科学家首次以CH3OH、CO?和H?为原料高效合成乙酸,其反应路径如图所示:
6.NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.100mL0.5mol/L的NaOH溶液中含有0.05$个H原子
B.常温常压下,11.2LCC>2中含有分子数小于0.5NA
C."CP?分子中含有中子数为27NA
D.3.2gCH30H中含有共价键个数为0.4NA
7.下列相关说法正确的是
A.NaOH、Na2CO3,CH3coOH均含有共价键和离子键
B.NaOH溶液使“Na2cO3吸收齐『再生的离子反应:OH-+HCO;=H2O+CO^
c.低温高流速有利于聚合离子液体吸附CO?
LilRH
D.CO?合成乙酸的总反应:CH3OH+CO2+H2CH3COOH+2H2O
8.6-硝基胡椒酸是合成心血管药物奥索利酸的中间体,其合成路线中的某一步如下:
⑴KMnO/OH、O-^^^COOH
(W\人人NO?
丫(6-硝基胡椒酸)
下列有关X和丫的说法正确的是
A.所含官能团的个数相等B.都能发生加聚反应
C.二者中的所有原子共平面D.均能溶于碱性水溶液
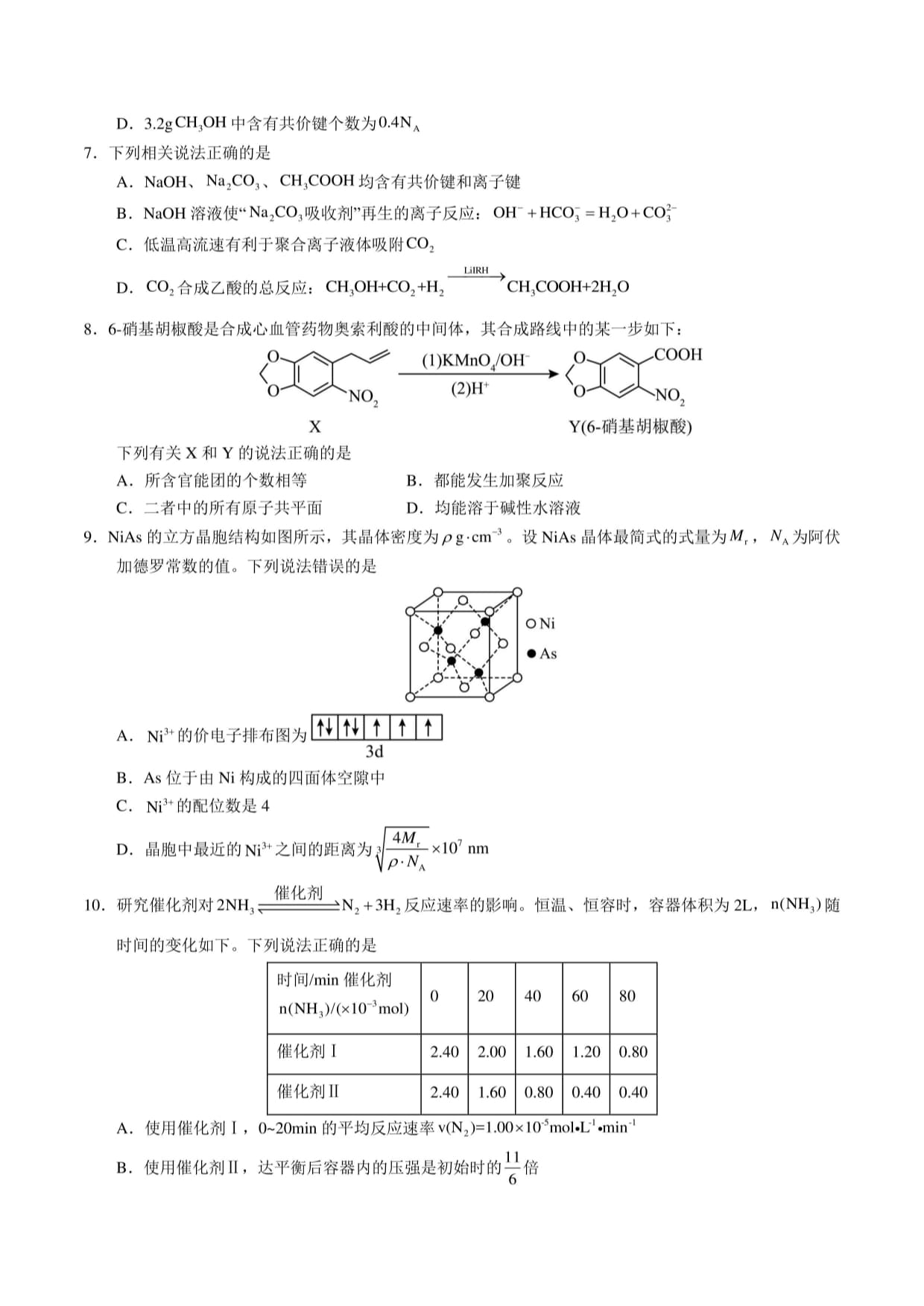
9.NiAs的立方晶胞结构如图所示,其晶体密度为0g-111-3。设NiAs晶体最简式的式量为,NA为阿伏
加德罗常数的值。下列说法错误的是
M3+的价电子排布图为EnHEnn]
A.
3d
B.As位于由Ni构成的四面体空隙中
C.Ni3+的配位数是4
D.晶胞中最近的Ni?+之间的距离为nm
催化剂
10.研究催化剂对2NH3、一凡+3H2反应速率的影响。恒温、恒容时,容器体积为2L,n(NH3)随
时间的变化如下。下列说法正确的是
时间/min催化剂
020406080
-3
n(NH3)/(xlOmol)
催化剂I2.402.001.601.200.80
催化剂II2.401.600.800.400.40
A.使用催化剂I,0〜20min的平均反应速率v(N2)=1.00xl(y5moi・L/・min"
B.使用催化剂II,达平衡后容器内的压强是初始时的2倍
O
C.相同条件下,使用催化剂II反应更快,是因为其使该反应的活化能更高
D.相同条件下,使用催化剂n可使该反应的化学平衡常数更大
H.下列实验方案、现象或目的均正确的是
选项实验方案现象或目的
向试管中先加入2mLO.lmoLLTKzCnCh溶液,再滴入5~10滴
A溶液由橙色变为黄色
6moi.L-NaOH溶液
向试管中先加入2mL0.1molL」CH3coONa溶液再加热,利用pH传
B溶液pH不断上升
感器测量溶液pH
C向盛有甲苯(是否含苯酚未知)的试管中滴加少量酸性高锦酸钾溶液检测甲苯中是否含苯酚
向试管中先加入CH3cH2X再加入NaOH溶液并加热,最后滴加有白色沉淀说明X为氯
D
AgNO3溶液原子
12.在下列不同溶液体系中化学反应先后顺序判断错误的是
A.在含Ba(OH)z、KOH、Na[Al(OH)J的混合溶液中缓慢通入CO?:Ba(OH)2、KOH、Na[Al(OH)J、
K2co3、BaCO3
3+3++
B.在含NH;、Al>Fe>H的溶液中逐滴加入KOH溶液(已知相同条件下KspAl(OH)3>KspFe(OH)3):
3+
H+、Fe"、Al>NH:、Al(OH)3
C.在含[Al(OH)J、OH,COj的溶液中逐滴加入盐酸:0H>[AI(OH)4]\CO,、AI(OH)3、
HCO;
D.在含等物质的量的Fe?+、Ag+、Cu2+>Fe3+>H+的溶液中加入锌粉:Ag+、Fe-、Cu2+>H+>Fe2+
13.南京大学某实验室开发了一种由MPT溶解的DMSO基电极液和TOOS基电极液组成的新型Li-O2电
池双相电解液,使高性能Li-O2电池日用化成为可能,该电池放电时的工作原理如图所示:
放电时,下列说法错误的是
A.电子流向:N电极—灯泡—M电极
B.TOOS基电极液可用Li2SO4溶液代替
C.M极电势高于N极电势
D.M极电极反应式为5+2片+2口+=口2。2
14.常温下,现有含O.lmoI-LTiCd?+的废液,可加入OOlmoLLiNa2s溶液或FeS固体生成沉淀除去Cd?+,
加入Na2s溶液或FeS固体引起溶液的pH变化,进而引起溶液中含S微粒的物质的量分数变化及
Cd(OH)2浊液中Cd?+浓度变化如图所示。下列说法正确的是
2610
已知:/(FeS)=1()77207^(CdS)=lO-
L(
O
E
)
、
。
0.1Xa
O.O_*'I•'''T»Ilb
468101214
PH0^
图1:Na2s体系中各含S粒子的物质
的量分数与pH的关系图2:表示Cd。。浊液中Cd2+浓度随pH的变化
+2--
A.0.01mol/LNa2s溶液中:c(Na)>c(S)>c(OH3>c(HS)
B.加适量Na2s固体可使废液中Cd。〉浓度由b点变到a点
C.由图1和图2得知,当溶液的pH=10,发生的反应为Cd2++2HS-=CdS+HzS
D.向废液中加入FeS固体,可使c(CF)<l(r99moi.LT
二、非选择题:本题共4小题,共58分。
15.(14分)HDS催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧一水浸取法用HDS废
催化剂(主要成分为MoS、NiS、V2O5,AIQ3)制取用。3和铝酸,其工艺流程如图所示。
纯碱、空气过量CO,NH4C1HNO,
I、四l共I、、一I
照,身滤液2>丽]PH=8.4»^^滤液3»^U/MOO4.H2O
傕化刑一厂1-----钥酸
气体浸渣滤渣|:^|滤液4
I
V2O3
已知:I.MOO3>V2O5>川2。3均可与纯碱反应生成对应的钠盐,而Nio不能。且MoC)3熔点795℃,易
升华。
II.高温下,NH4VO,易分解产生NZ、NH3等物质。
回答下列问题:
(1)Mo为第五周期元素,与Cr同族,在周期表中的位置为;从上述流程中可分析出MoOs
属于(填“酸性氧化物”或“碱性氧化物”)。
(2)“焙烧”时若温度超过750℃会导致最终铝酸产率降低的原因是;“焙烧”后的尾气需进
行处理,写出用足量纯碱吸收二氧化硫的化学方程式:(已知常温下,
27。
H,XSO,3:Kal,=1.2xl0aKZ,,=5.6x10*ZH.CjO^Kal,.=4.4x10dK/*=4.7xl()T/i)
(3)写出“培烧”过程中MoS与纯碱、空气反应的化学方程式:;“沉铝”时发生反应的离
子方程式为o
(4)“沉机”时生成NH4VO3沉淀,写出“煨烧”中发生反应的化学方程式:o
(5)“沉钥”所得铝酸需进行水洗,检验铝酸是否洗涤干净的操作为。
16.(16分)铁盐、亚铁盐在工业上具有重要价值。完成下列相关实验问题。
【制备无水FeCb】FeCb在工业上常作催化剂和刻蚀剂。实验室中,先合成SOCL,再与FeCbHzO反
应制备无水FeCb.装置如图所示(加热及夹持仪器略)。
②SOCb的熔点为-101℃,沸点为75.6℃,遇水剧烈分解为两种酸性气体;POCb沸点为105℃。忽略
共沸。
(1)写出A中反应的化学方程式。
(2)打开K2,将三通阀调至,接下来进行的操作是,一段时间后,加热装
置C至60℃。仪器丙的作用为
(3)当C中出现较多液体后,关闭KI、K2。制得FeCb的操作为:①调节三通阀的位置为(根
据下图选填序号);②的操作为;③加热E处硬质玻璃管。
小e。牛
D①B皿
abcc
【配制铁盐溶液并探究铁盐性质】
(4)实验室若需要配制90mL0.1mol/LFeCb溶液,用到的药品和仪器有:FeCb固体,烧杯、量筒、
玻璃棒、胶头滴管、o
(5)某化学学习小组探究Fe3+在溶液中的颜色变化,进行以下实验。
试剂加热前溶液颜色加热后溶液颜色
实验IFe(NC>3)3溶液+蒸储水棕黄色深棕色
实验IIFe(NC>3)3溶液+HNO3几乎无色几乎无色
实验niFeCh溶液+HNO3黄色深黄色
已知:水溶液中,[Fe(凡0订+几乎无色,[FeCl/H。%『为黄色;[Fe(HQ)6「水解生成
[Fe(H2OL(OH)”「(棕黄色)。
从影响平衡移动因素的角度分析,加热前后,实验H中溶液颜色无明显变化的原因为o
②设计实验证明实验皿中溶液呈黄色的原因是Fe3++4C「+2HQu[FeC14(H2。)]:
【探究铁盐和亚铁盐的转化】
(6)铁盐转化成亚铁盐有多种方法,下图是利用电解法(两极均为惰性电极)使FeKSOJs转化成
FeS04(暂不考虑如何进一步提取FeS04)o
为了提高FeSCU产率,在Fe2(SOjc(Fe2+):c(Fe3+)不断增
大。结合里极度座说明加入CH30H可以提高FeSCU产率的原因:;电解一段时间后,取
少量电解液于试管中,加入(填试剂化学式)可以证明生成了Fe2+o
17.(14分)乙烯是一种用途广泛的有机化工原料,在现代石油和化学工业中具有举足轻重的作用。由乙烷
制乙烯的研究备受关注。回答下列问题:
(1)C2H$氧化脱氢反应:
1
2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g)AH^^OQ.SkJgmol;
1
C2H6(g)+CO2(g)=C2H4(g)+H2O(g)+CO(g)AH2=+178.1kJgnoFo
①计算反应2co(g)+C»2(g)=2CO?(g)的AH3=kJmol1,该反应在____(填“高温”“低温”或“任何
温度”)能自发进行。
②我国学者结合实验与计算机模拟结果,研究了不同催化剂下乙烷脱氢阶段反应进程如下图所示(吸附
在催化剂表面的粒子用*标注,TS表示过渡态)。
♦c
200-TSI'TS7-0-d
150-♦•••
100-;\一.
/TS1\/,/\
50-
产
____——9<0---------n
0-■印7aC?H5*+H*C2H4+2H*,
反应进程
上图中代表催化性能较好的催化剂的反应历程是(选填"c”或"d”),其判断依据是。
(2)乙烷直接脱氢制乙烯的过程中,可能发生多个反应:
iC2H6(g)C2H4(g)+H2(g)AH;
iiC2H4(g)^C2H2(g)+H2(g);
iiiC2H2(g)02c(s)+H?(g)。
反应的平衡常数对数值(IgK)与温度的倒数17T的关系如下图。
IgK
25-xlO4/K-'
T
①AH0(填,"y"或“=”)。
②仅发生反应i时,C2H6的平衡转化率为25.0%,计算反应i的K*=(K*是以平衡物质的量分
数代替平衡浓度计算的平衡常数)。
③水蒸气在乙烷直接脱氢制乙烯中起着重要作用。一定温度下,当总压恒定时,增加水蒸气与乙烷的
进料比,可提高乙烷的转化率,其原因是。
④结合上图,分析工业上一般选择温度在1000K左右的可能原因是。
18.(14分)二酯F是一种合成多环化合物的中间体,现由乙焕A制备
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 画作拍卖会行业跨境出海战略研究报告
- 重金属污染水体絮凝剂企业制定与实施新质生产力战略研究报告
- 职业球员进阶课程行业深度调研及发展战略咨询报告
- 自流平环氧地坪漆行业跨境出海战略研究报告
- 污水回用技术集成方案行业深度调研及发展战略咨询报告
- 校园戏剧节行业跨境出海战略研究报告
- 共享物流平台行业深度调研及发展战略咨询报告
- 电池级金属镉制备行业深度调研及发展战略咨询报告
- 医药中间体及原料药超级工厂项目可行性研究报告写作模板-备案审批
- 2025年物业管理服务项目发展计划
- 2025年常州信息职业技术学院单招职业适应性考试题库必考题
- 龙岩市2025年高中毕业班三月教学质量检测 地理试卷(含答案详解)
- 2024-2025学年高二数学湘教版选择性必修第二册教学课件 第2章-2.4空间向量在立体几何中的应用-2.4.4 向量与距离
- 哪吒主题课件模板文档
- 5.3《阳燧照物》教案-【中职专用】高二语文同步教学(高教版2023·拓展模块下册)
- 2025年宁波职业技术学院单招职业倾向性测试题库及答案(历年真题)
- 新版GCP培训课件
- 《如何科学减肥》课件
- 2025建设工程监理合同示范文本
- 大模型落地应用实践方案
- 高速公路网命名和编号规定(附条文说明)

评论
0/150
提交评论