



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
《化学反应原理》(选修)
第2章化学反应的方向、限度与速率第2节化学反应的限度
(第3课时)
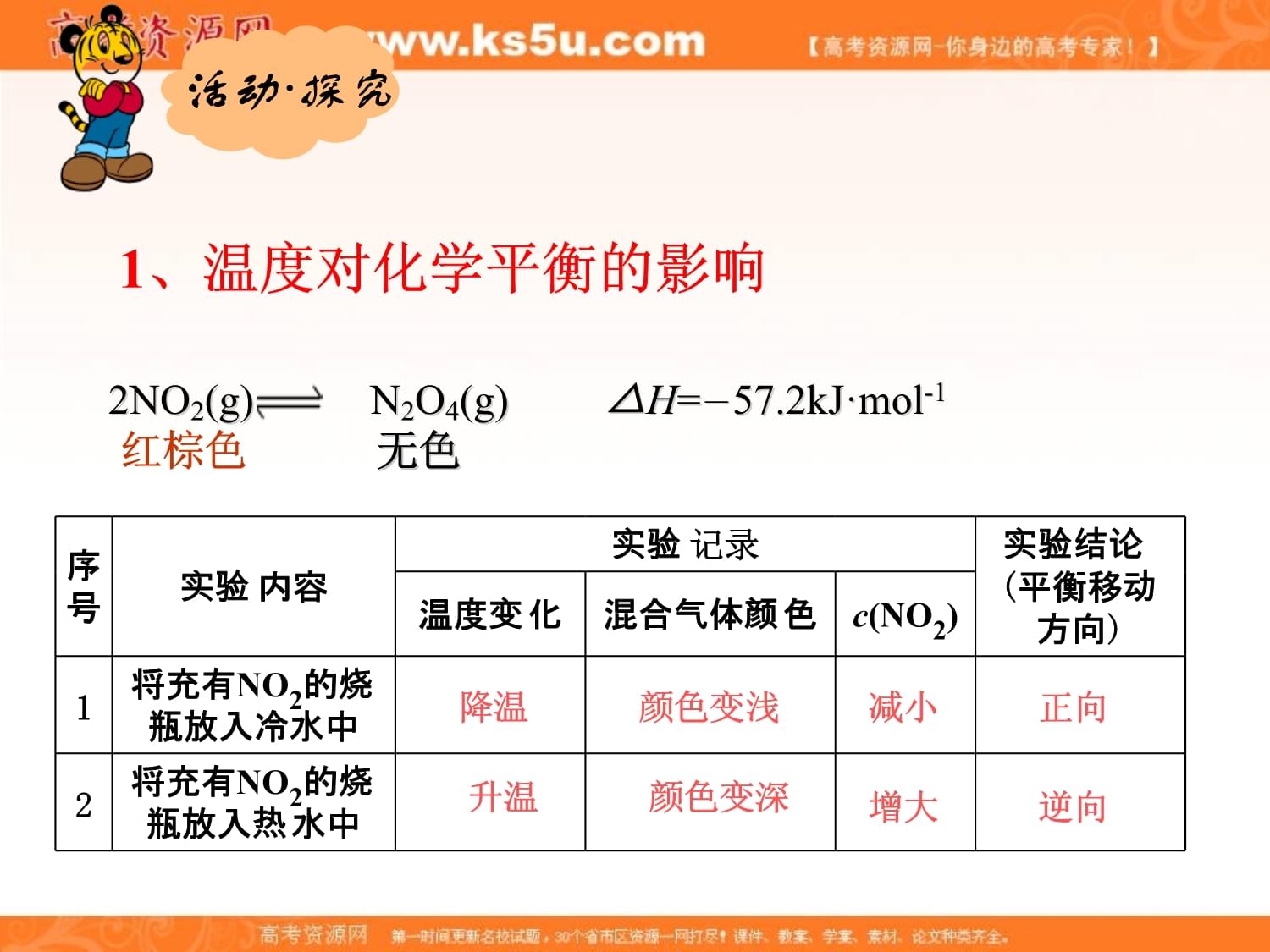
广东某市2013优质课课件【学习目标】知识与技能:通过实验探究温度、浓度对化学平衡的影响,并能用相关理论加以解释。过程与方法:通过探究活动,形成实验探究的能力。【学习重点】温度、浓度对化学平衡的影响。【学习难点】温度、浓度对化学平衡的影响。2NO2(g)N2O4(g)△H=-57.2kJ·mol-1
红棕色
无色
序号实验内容实验记录实验结论(平衡移动方向)温度变化混合气体颜色c(NO2)1将充有NO2的烧瓶放入冷水中2将充有NO2的烧瓶放入热水中降温颜色变浅减小正向升温颜色变深增大逆向活动·探究1、温度对化学平衡的影响正向正向
结论:升高温度,平衡向吸热方向移动;降低温度,平衡向放热方向移动。降温[HI]=0.80mol·L-1[H2]=0.40mol·L-1[I2]=0.40mol·L-1升温[HI]=1.20mol·L-1[H2]=0.20mol·L-1[I2]=0.20mol·L-1[N2]=19.5mol·L-1[H2]=38.5mol·L-1[NH3]=11mol·L-1[N2]=20mol·L-1[H2]=40mol·L-1[NH3]=10mol·L-1N2(g)+3H2(g)
2NH3(g)
△H<0移动方向新平衡状态改变条件原平衡状态可逆反应2HI(g)H2(g)+I2(g)
△H>0交流研讨2NH3(g)
N2(g)+3H2(g)
△H=+92.2kJ·mol-11002.00.0015K/(mol·L-1)2873673473
T/K0.6016.8K/(mol·L-1)-1333298T/K2NO2(g)N2O4(g)
△H=-57.2kJ·mol-1
温度对化学平衡的影响是通过改变平衡常数实现的。交流研讨K=c2
(NO2)c(
N2O4)K=
c(N2)c3(H2)c2
(NH3)在一定体积的密闭容器中,反应CO2(g)+H2(g)CO(g)+H2O(g)的化学平衡常数和温度的关系如下表:t/℃70080083010001200K0.60.91.01.72.6回答下列问题:
(1)该反应的化学平衡常数表达式K=
。
(2)该反应的正反应为
反应(填”吸热”或”放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)
c(H2O),可判断此时的温度为
℃。吸热[CO][H2O][CO2][H2]830迁移应用改变浓度Q、K关系平衡移动方向增大反应物增大c(FeCl3)或c(KSCN)增大生成物增大c[Fe(SCN)3]正向逆向请根据反应Fe3+(aq)
+3SCN-(aq)Fe(SCN)3(aq)的平衡常数K与浓度商Q=
的关系,讨论改变反应物或生成物浓度对化学平衡的影响。Q<KQ>K交流研讨c(Fe3+)c3(SCN-)c[Fe(SCN)3]2、浓度对化学平衡的影响请根据提供的试剂和仪器,按照设计的实验方案证明上述预测。试剂:0.01mol·L-1FeCl3溶液、0.03mol·L-1KSCN溶液、
1mol·L-1FeCl3溶液、1mol·L-1KSCN溶液仪器:胶头滴管、点滴板等编号实验内容实验现象实验结论1先加5滴0.03mol·L-1KSCN溶液,再取2滴0.01mol·L-1FeCl3溶液与之混合,观察颜色变化;然后再加2滴1mol·L-1FeCl3溶液,观察颜色变化。2先加5滴0.03mol·L-1KSCN溶液,再取2滴0.01mol·L-1FeCl3溶液与之混合,观察颜色变化;然后再加2滴1mol·L-1KSCN溶液,观察颜色变化。
改变浓度,若Q<K,平衡正向移动;若Q>K,平衡逆向移动。溶液呈血红色后加深正向移动溶液呈血红色后加深正向移动活动·探究
2SO2(g)+O2(g)2SO3(g)△H
=_197.8kJ·mol-1是硫酸制造工业的基本反应。在生产中通常采用通入过量的空气的方法。为什么?
提高O2在原料气中的比例,使SO2的平衡转化率提高,从而降低生产成本。思考原平衡状态
新平衡状态
平衡移动浓度借助Q与K的相对大小进行判断升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动温度温度对化学平衡的影响是通过改变平衡常数来实现的改变浓度,若Q>K,平衡逆向移动改变浓度,若Q<K,平衡正向移动小结1.关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛。其化学机理为:①HUr+H2OUr-+H3O+
尿酸尿酸根离子②Ur-(aq)+Na+(aq)NaUr(s)下列对反应②叙述中正确的是()A.正反应的△H>0B.正反应的△H<0C.升高温度,平衡正向移动
D.降低温度,平衡正向移动练习BD
2.在一定条件下,反应H2(g)+Br2(g)2HBr(g)的△H<0,达到化学平衡状态且其它条件不变时:
(1)如果升高温度,平衡混合物的颜色
;
(2)如果在体积固定的容器中加入一定量的氢气,化学平衡
移动,Br2(g)的平衡转化率
(变大、变小或不变)。
3.铬酸钾(K2CrO4)与重铬酸钾(K2Cr2O7)有如下转化:2CrO42-+2H+Cr2O72-+H2O
黄色橙红色
已知重铬酸钾的稀溶液呈橙红色。
(1)向重铬酸钾的稀溶液中加入NaOH,溶液呈
色;
(2)向(1)的溶液中再加入过量的H2SO4,溶液呈
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024年专用环卫车辆租赁协议
- 2024年全球航运租赁协议
- 2024年供货商长期合作协议
- 2024年全屋成品定制交付协议
- 2024年共铸品牌:合作创建公司基础协议书
- 双口网络电路课程设计
- 鸟类拍摄课程设计
- 交往与合作课程设计
- 敦煌莫高窟美术课程设计
- 江西人像油画课程设计
- 高考地理一轮复习课件【知识精讲+高效课堂】美食与地理环境关系
- 分居声明告知书范本
- 2023年04月山东济南市槐荫区残联公开招聘残疾人工作“一专两员”公开招聘笔试参考题库+答案解析
- 消失的13级台阶
- 营销管理知识点
- 船体强度与结构设计课程设计
- 不宁腿综合征诊断与治疗
- 初中英语教学活动设计
- 三写作的载体与受体
- GB/T 451.3-2002纸和纸板厚度的测定
- 网签授权书(学生就业平台)

评论
0/150
提交评论