



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
第六章稀土元素6.1概述
镧系元素由57(Ln)到71(Lu),共15个元素,加上Sc和Y共17个元素称为稀土元素(rareearthelements):
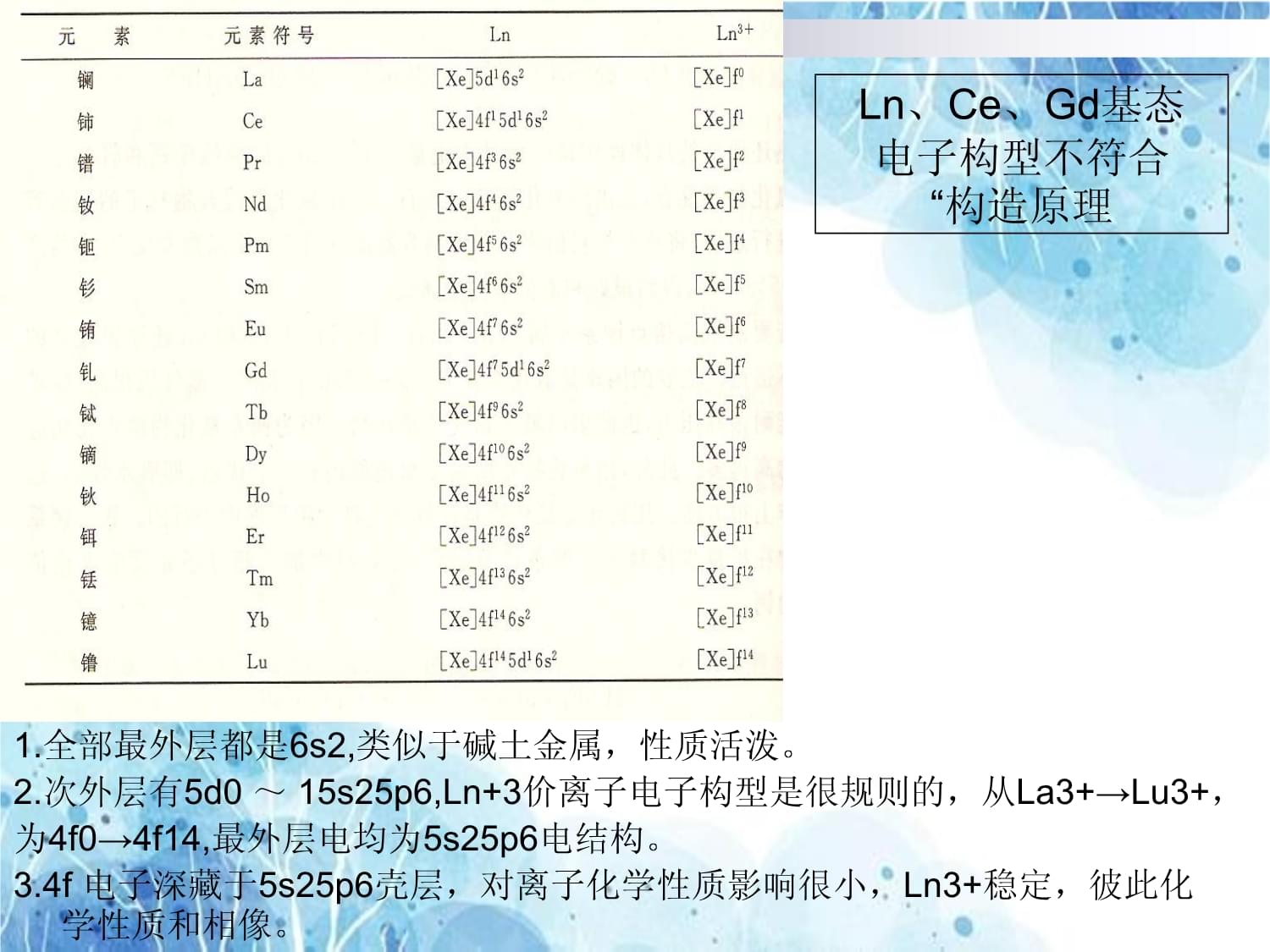
镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu)、钪(Sc)、钇(Y)。6-2镧系元素性质6.2.1镧系元素原子的电子结构从Ce起先,电子逐一填充在4f轨道。价电子构型为:[Xe]4f0~145d0~16s2。1.全部最外层都是6s2,类似于碱土金属,性质活泼。2.次外层有5d0~15s25p6,Ln+3价离子电子构型是很规则的,从La3+→Lu3+,为4f0→4f14,最外层电均为5s25p6电结构。3.4f电子深藏于5s25p6壳层,对离子化学性质影响很小,Ln3+稳定,彼此化学性质和相像。Ln、Ce、Gd基态电子构型不符合“构造原理6.2.2物理性质镧系元素均为典型的金属,银白带灰光泽,介于铁和银之间。一般是松软的,随原子序数增大而变得较硬。具有延展性
纯稀土金属有好的导电性。在超低温下(-268.78℃)有超导性。稀土金属及其化合物在一般温度下为强顺磁性物质,具有很高的磁化率。Sm、Gd、Dy具有铁磁性。镧系金属原子半径变更:6.2.3镧系元素化学性质Ln系金属活泼性仅次于碱金属和碱土金属,由La→Lu递减。La、Ce、Pr在空气中很快氧化;Nd、Sm、Gd氧化较慢;其它的氧化更慢。在空气中加热到200~400℃可燃烧生成M2O3(Ce可为Ce2O4).镧系金属的Eө=-1.99~-2.40V。其可与水作用放出氢气。与热水反应猛烈。镧系金属可与氢、碳、氮、卤素、磷、硫等非金属干脆化合生成相应化合物。如金属型的LnH2(Ln3+(e-)(H-)2)和盐型LnH3。与碳加热生成LnCandLnC2;与N2生成LnNandLN1-x(0<x<1);与氟形成LnF4orLnF3.
6.2.4镧系元素氧化态镧系元素失去6s2和5d1或失去6s2或一个4f电子,而表现为常见的稳定氧化态+3。由于4f的全空、半充溢和全充溢,有些元素又有+2和+4。Ln4+:Ce4+(4f0),Tb4+(4f7);Ln2+:Eu2+(4f7),Yb2+(4f14)Eu2+在水中可稳定存在,是最稳定的离子。Ce4+是很好的氧化还原氧化还原剂,可在水中长时间稳(动力学因素)。Ln3+颜色:La3+(4f0)、Lu3+(4f14)具有封闭电子构型,在可见区、紫外区均无吸取;Ce3+(4f1)、Eu3+(4f6)、Gd3+(4f7)、Tb3+(4f8)吸取带全部或绝大部分在紫外区,Yb3+(4f13)的吸取带出现在近红外区。它们的4f轨道为全空、半空、全充溢、半充溢、或接近全空、全充满、半充溢,在可见光下难以激发,因此它们是无色或近于无色(Eu3+为浅粉色)。其它三价离子,其基态和激发态能量比较接近,可吸取部分可见波长的光而显示不同特征颜色。Ln3+的磁性:
La3+(4f0)、Lu3+(4f14)组态无成对电子,呈现逆磁性。其它fn组态均含有未成对电子,为顺磁性。呈双峰状:6.2.5镧系元素化合物1.氧化物镧系金属在空气中燃烧或灼烧镧系元素的氢氧化物、碳酸盐、硫酸盐和草酸盐等均可得到倍半氧化物Ln2O3。而Ce2O3、Pr2O3、Tb2O3在空气中受热还可进一步氧化为CeO2、Pr6O11、Tb4O7。Ln2O3颜色变更规律与+3价离子的基本相同。其熔点均很高(﹥2000℃)。Ln2O3尤其是轻稀土倍半氧化物与碱土金属氧化物性质相似,可吸取CO2和水,形成碳酸盐和氢氧化物。
Ln2O3不溶于水。可溶于无机酸。溶解程度确定于制备时的灼烧温度和元素在系列中的位置。如:La2O3在冷的70%HClO4中,瞬时溶解;但Lu2O3则需几个小时。金属CeorCe(OH)4在氧气中受热可生成CeO2,浅黄色粉末,不溶于碱液,也不溶于硝酸和盐酸,但能溶于浓硫酸生成Ce(SO4)2。PrO2是很强的氧化剂。可将Mn2+氧化为MnO4-Ce3+氧化为Ce4+。2.卤化物半水氟化物可通过氢氟酸溶液与热镧系硝酸盐溶液反应制得。在真空中加热半水氟化物到300℃或在HF气氛中加热到600℃脱水可制得无水LnF3.氟化物是唯一不溶于水的镧系卤化物。其熔点很高、不吸湿、很稳定。从水中结晶析出的氯化物均含结晶水,对其加热得到的不是无水物,是LnOCl。获得无水氯化物的方法有:(1)在HCl气流中加热水合氯化物,如6.7KPa,400℃,36h。(2)加热过量NH4Cl与氧化物(或水合氯化物)的混合物Ln2O3+6NH4Cl2LnCl3+3H2O+6NH3↑无水氯化物熔点较高(600~800℃)很易吸湿。
300℃
用Ca还原SmF3、EuF3、YbF3可得其二氟化物。制备其它镧系元素的二氟化物,只能在CaF2orSrF2orBaF2中,用Ca还原LnF3制取。制备其它二卤化物的一般方法有:(1)稀土金属还原相应的三卤化物
2TmI3+Tm3TmI3(2)在水溶液中以Zn-Hg齐还原Eu3+到Eu2+。(3)用H2还原三卤化物
2SmCl3+1/2H2SmCl2+HCl(4)加热分解无水三卤化物
2SmI32SmI2+l2(g)(5)在液氨中,金属Sm、Eu、Yb与NH3反应
Ln+2NH3Ln(NH3)2+H2↑Ln(NH3)2+
2NH4ClLnCl2+NH3↑
700℃3.氢化物限制氢气压力下,镧系金属吸取氢气可形成稳定组成不定的类合金氢化物LnHx(0<x≤2)。此类氢化物性脆,外观像金属,呈淡蓝色。LnH2实际组成可表示为Ln3+(e-)(H-)2,e-为处于导带中的自由电子,二氢化物具有导电性。LnH2接着吸氢,最终可变为LnH3。LnH3的组成是Ln3+(H-)3,为盐型化合物,不具有导电性。某些镧系金属合金氢化物,如LaNi5Hx、La2Mg17Hx、La2Ni5Mg15Hx等是良好的储氢材料,能可逆吸取和释放氢气。4.其它盐类镧系元素的氯化物、溴化物、碘化物、硝酸盐、醋酸盐、氯酸盐、高氯酸盐等都极易溶解于水;硫酸盐微溶于水,且在0℃时比在常温下更易溶解;氟化物、碳酸盐、磷酸盐和草酸盐不不溶于中性或碱性水溶液中,且草酸盐也不溶于酸性溶液中。由于草酸盐的不溶性,可将镧系离子以草酸盐的形式从酸性溶液中析出,与其它金属离子分别。通常是在硝酸盐或水合氯化物溶液中,加入6mol/l-1硝酸和草酸溶液,即可得到白色草酸盐Ln2(C2O4)3·nH2O沉淀。草酸盐经灼烧得氧化物。6-3镧系离子协作物Ln3+为典型的硬酸,配位化学的性质与Ca2+、Ba2+等相似,而与d区过渡金属离子成差别较大。6.3.1镧系离子协作物的特点1.4f轨道为内层,外电子层5s25p6为封闭壳层,Ln3+事实上具有稀有气体原子结构。其形成的协作物LFSE(配位场稳定化能)很小,约为4kJ/mol。因此与配体间的轨道作用很弱,主要是以静电作用为主。2.LFSE很小,协作物稳定性较差,只有与强螯合剂如柠酸、EDTA、β-二酮等才能形成热力学上稳定的协作物。3.Ln3+半径较大,Ln3+离子配位数大多在6或6以上,最高可达12。因此其协作物构型也较为困难。4.由于Ln3+为硬酸所以易与含氧、氮等配位原子的硬碱配体,如乙二胺、EDTA、β-二酮等配位。而与CO、CN-、PR3等软碱难以配位。5.由于Ln3+协作物中配位键的离子特性,协作物在溶液中多为活性协作物,易发生取代反应。镧系离子协作物的主要特点(与过渡金属离子对比)6.3.2镧系离子的主要类型协作物与之形成协作物的典型配体有H2O、Ph3PO、Me2SO、EDTA、2,2’-联吡啶、1,10-菲咯啉、冠醚及其衍生物和一些阴离子配体F-、Cl-、NCS-、NO3-等。1.Ln3+—氧配位协作物以氧配位原子配位的协作物较多,水为常见配体。一般可形成就九配位的水合离子[Ln(H2O)9]3+。胺、膦和胂化合物易与Ln3+形成比较稳定的协作物如:由吡啶氧化物现成的[Ln(C5H5NO)5]3+,由三苯基氧化膦形成的[Ln(NO3)3(OPPh3)3]。
稀土离子还可与冠醚大环配体形成稳定的协作物
此类配体具有螯合效应,且空腔大小可便利裁制,可形成多种配比和各种结构的稳定协作物2.Ln3+—氮配位协作物胺可与其形成稳定的协作,常见的为多胺协作物。典型的有二齿配位的2,2’-联吡啶,菲咯啉,和三齿配位2,2’,6‘,2‘’-三联吡啶等。各种硫氰酸根协作物。3.Ln3+—氮氧配位协作物EDTA与Ln3+可形成特别稳定的协作物。与氨基酸液可形成各种结构的协作物4.有机金属化合物同很多d区过渡金属可形成M(C5H5)2一样,镧系金属可形成环戊二烯基化合物[Ln(C5H5)3]3C5H5Na+LnCl3Ln(C5H5)3+3NaClLn=La、Ce、Pr、Nd、Sm、Gd、Er、Yb、Y等。
也可制得(C5H5)2LnCl2C5H5Na+LnCl3(C5H5)3LnCl+2NaClLn=Sm、Gd、Dy、Ho、Er、Yb、Lu等。上述化合物易挥发,热稳定性很高,但易被水或FeCl2分解:
La(C5H5)3+3H2OLa(OH)2+3C5
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 产品改良设计优化方案
- 学校品行常规教育体系构建
- 小班健康:洗洗小手真干净
- 幼儿园健康领域教育指南
- 腾讯课件导入标准流程
- 呼吸衰竭常见护理诊断及护理措施
- 眼健康检查与分析
- 宠物肿瘤术后护理常规
- 教师身体健康教育
- 教育行业市场营销简约策略
- 预制梁首件施工方案
- 问题解决型护理品管圈QCC成果汇报之提高痰标本采集合格率
- 电网公司项目管理标准手册
- 四渡赤水课件(共25张PPT)
- (高清正版)JJF(浙)1080—2012明渠流量计在线校准规范(电子版)
- 《希腊神话与西方文化》教学大纲
- 生活饮用水卫生标准GB5749-2006
- 过渡金属能级图数据库2
- GB-T-12137-2015-气瓶气密性试验方法
- 战锅策火锅店项目策划书
- (完整版)音标练习题(元音部分)

评论
0/150
提交评论