



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
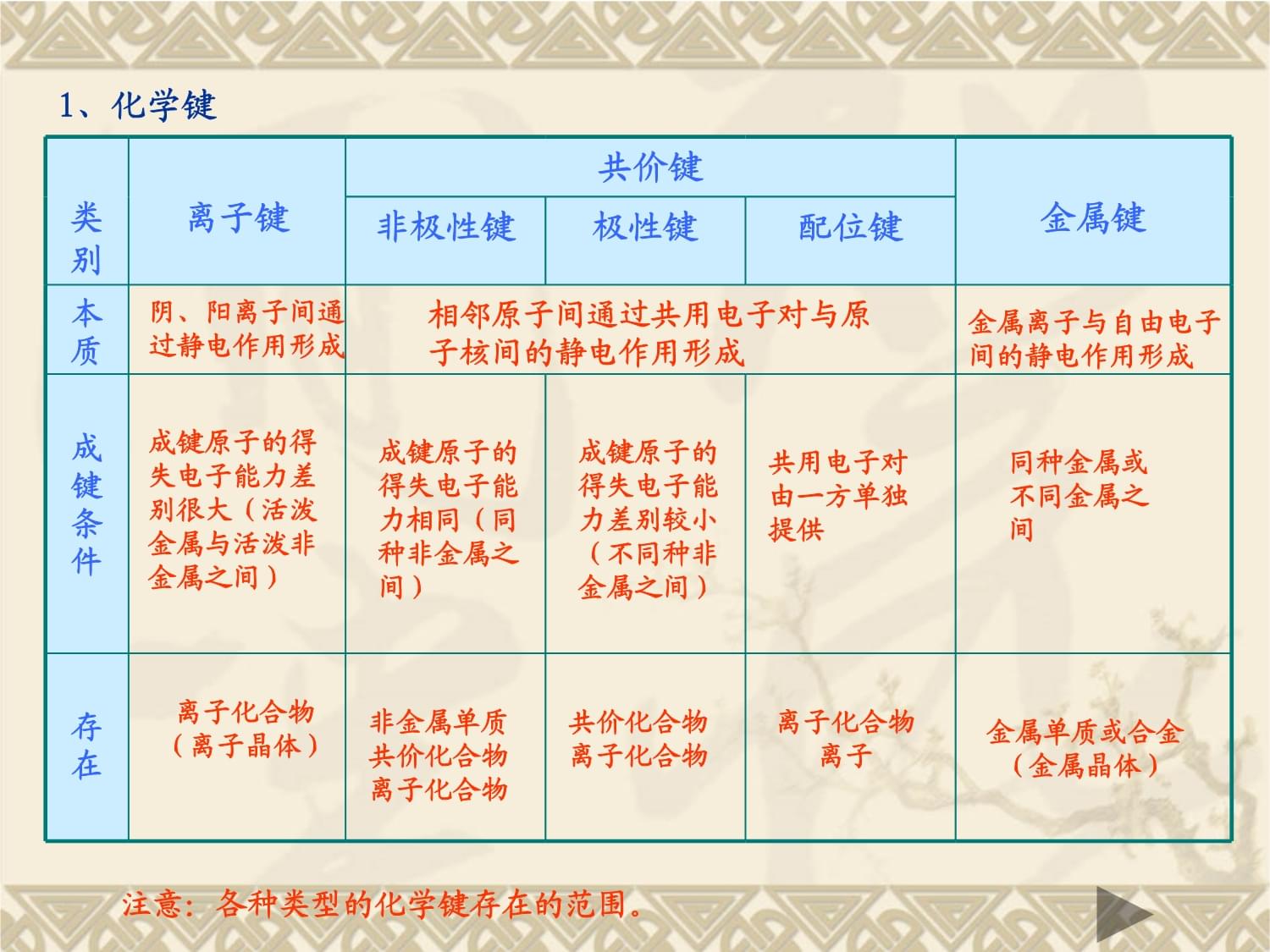
高考化学复习化学键晶体结构双石中学化学组田海制作一、考试说明1、理解离子键、共价键的涵义。理解极性键和非极性键。了解极性分子和非极性分子。了解分子间作用力。初步了解氢键。2、了解几种晶体类型(原子晶体、离子晶体、分子晶体、金属晶体)及其性质二、高考分析展望化学键与晶体结构这一知识点的掌握,能加深同学们对物质结构的本质及化学变化中的能量变化的理解,训练同学们的三维空间想象能力。化学键及晶体结构高考除了直接考查课本基础知识外,近几年来出现了思维要求高、综合性较强的题目。近几年来这一考点主要涉及以下几个方面:1、化学键、离子键、共价键的概念和特点。2、原子、离子、单质、化合物的电子式。3、判断键的极性、分子的空间构型和极性。4、离子晶体、分子晶体、原子晶体熔沸点的比较。值得注意的是,随者新课程标准逐步推进和实施,近年来高考题注重学科间渗透,而对晶体结构的考查恰能够提供此素材。此考点易与立体几何和物理相关知识进行渗透,考查学生的空间想象能力和三维空间的思维能力,因此必将是今后高考的重点。三、学科渗透学科内:1、化学键与晶体结构的综合;化学键与物质的物理性质和化学性质相结合;化学键与反应热相结合。2、有关晶体结构、微粒数目、密度、摩尔质量等的综合计算。学科间:1、化学键的形成、断裂过程中的能量变化与物理学知识的综合;2、晶体结构与物理、数学等学科知识的综合。四、知识小结1、化学键类别离子键共价键金属键非极性键极性键配位键本质成键条件存在阴、阳离子间通过静电作用形成相邻原子间通过共用电子对与原子核间的静电作用形成金属离子与自由电子间的静电作用形成成键原子的得失电子能力差别很大(活泼金属与活泼非金属之间)成键原子的得失电子能力相同(同种非金属之间)成键原子的得失电子能力差别较小(不同种非金属之间)共用电子对由一方单独提供同种金属或不同金属之间离子化合物(离子晶体)非金属单质共价化合物离子化合物共价化合物离子化合物离子化合物离子金属单质或合金(金属晶体)注意:各种类型的化学键存在的范围。2、键的极性与分子的极性分子组成空间结构常见分子键的极性分子极性双原子N2O2Cl2HClCONO三原子CO2CS2V型H2OH2S四原子平面三角型BF3NH3五原子CH4CCl4CH3ClCH2Cl2三角锥形正四面体四面体非极性极性极性极性极性极性极性极性非极性非极性非极性非极性极性极性极性极性直线型直线型分子极性的快速判断:分子中中心原子元素化合价绝对值等于主族序数,一般为极性分子。3、晶体类型与性质类型离子晶体原子晶体分子晶体金属晶体构成晶体粒子粒子间作用力物理性质熔沸点硬度导电性导热性延展性溶解性典型实例阴、阳离子原子分子金属离子和自由电子离子键共价键分子间作用力金属键较高很高低有高、有低硬而脆大小有大、有小不导电(熔化或水溶液导电)绝缘体(半导体)不良良导体良良不良不良不良不良不良不良易溶于极性溶剂不溶于任何溶剂相似相溶NaClKBrNaOHNH4Cl金刚石SiCSiSiO2
冰干冰I2白磷、气体单质FeCuMg黄铜(铜锌合金)难溶(K、Na等与水反应)电子式的书写电子式是表示物质结构的一种式子,其写法是在元素符号周围用“·”或“×”表示原子或离子的最外层电子,并用n+或n—表示离子所带电荷。书写时要注意以下几点:1、要根据原子或离子的最外层电子排布式写;中学阶段并非所有物质的电子式都能写出,如CO、NO、O3等。2、阴离子的电子式:不但要画出最外层电子式,而且应用“[]”括起来,并在右上角标上“n—”电荷字样;3、阳离子的电子式:不要求画出离子最外层电子数,就用其离子符号表示(NH4+除外)。4、电子式只要求表示化学键的情况,不要求表示出分子的形状。练习:分别写出下列各物质的电子式:HBrH2OH2SNH3PCl3CH4CCl4C2H4C2H2Na2ONa2O2Mg3N2NaOHCa(OH)2N2NH4ClCl2HClOH2O2等。1、下列物质中,既含有离子键,又含有非极性共价键的是()
A、NaOHB、Na2O2C、CaCl2D、H2O练习3、下列物质中不含有非极性键的非极性分子是()
A、Cl2B、H2OC、N2D、CH42、下列叙述正确的是()
A、两种元素构成的共价化合物分子中的化学键都是极性键
B、两种不同非金属元素原子间形成的化学键都是极性键
C、含有非极性键化合物的分子一定不是极性分子
D、只要是离子化合物,其熔点就比共价化合物的熔点高BDB分子间作用力1、概念:把分子聚集在一起的作用力,叫做分子间的作用力。2、实质:电性引力。3、特征:广泛存在与分子之间;只有分子间充分接近时才有分子间作用力,如固体和液体;分子间作用力的能量比化学键弱得多。4、影响因素(1)、相对分子质量的大小。分子组成和结构相似时,相对分子质量越大作用力越大。(2)、分子极性。相对分子质量差不多的化合物,分子的极性越强作用力越大。如CO大与N2(3)、分子的形状。分子中支链数增加,分子间靠近程度减少,分子作用力减弱,其熔沸点相应减小。如正戊烷>异戊烷>新戊烷。5、分子间作用力是决定物质物理性质的主要因素,而化学键是决定物质化学性质的主要因素。6、氢键:分子间作用力的一种。化学键、氢键、分子间作用力的强弱顺序为:化学键>氢键>分子间作用力能形成氢键的元素:N、O、F。例:(02年高考)关于氢键,下列说法正确的是()
A、每一个水分子含有两个氢键
B、冰、水和水蒸气中都存在氢键
C、DNA中的碱基互补配对是通过氢键来实现
D、H2O是一种非常稳定的化合物,这是由于氢键所致C物质熔沸点高低比较⑴、不同晶型的物质的熔沸点高低顺序:一般是:原子晶体>离子晶体>分子晶体同一晶型的物质:晶体内部结构粒子间的作用力越强,熔沸点越高。⑵、原子晶体比较共价键的强弱:一般地说,原子半径越小,形成的共价键的键长越短,键能越大,其晶体熔沸点越高。如金刚石>碳化硅>晶体硅⑶、离子晶体比较离子键强弱。一般地说,阴阳离子的电荷数越多,离子半径越小则离子间的作用力就越强,其离子晶体的熔沸点就越高。如MgO>MgCl2>NaCl⑷、分子晶体比较分子间的作用力,分子间作用力越大,则晶体熔沸点越高,另含有氢键的物质熔沸点比不含氢键的物质高。⑸、金属晶体中金属离子半径越小,离子电荷数越多,则熔沸点越高。如Al>Mg>Na⑹、元素周期表中第VIIA族卤素单质(分子晶体)的熔点随原子序数递增而升高,第IA族碱金属元素单质(金属晶体)的熔点随原子序数递增而降低。四种典型晶体组成的参数氯化钠——每个Na+紧邻6个Cl—,每个Cl—紧邻6个Na+,每个Na+与12个Na+等距离相邻。氯化铯——每个Cs+紧邻8个Cl—,每个Cl—紧邻8个Cs+。每个Na+与6个Cs+等距离相邻。干冰——每个CO2分子紧邻12个CO2分子,晶格的一个面上有5个CO2,还有一个CO2分子位于中央。金刚石——每个C原子与4个C原子紧邻,由5个C原子形成正四面体结构单元。由共价键构成最小环状结构中有6个C原子,不在同一平面上,晶体中每个C原子参与了4条C—C键的形成,而在每条键中的贡献只占一半,碳原子个数与C—C键数之比为1:2。石墨——每个平面六边形有6个C原子。由共价键形成的6个C原子环为平面六边形。晶体中每个C原子由3个六边形共用,故C原子个数与C—C键数之比为2:3。二氧化硅——每个Si与4个O原子紧邻,每个O原子与2个Si紧邻,每nmolSiO2晶体中,Si—O键最接近4nmol。注意:均摊法求晶体化学式。例1(02年上海):下列有关晶体的叙述中错误的是()
A、离子晶体中,一定存在离子键B、原子晶体中,只存在共价键
C、金属晶体的熔沸点均很高D、稀有气体的原子能形成分子晶体练习1、(03年连云港):下列叙述正确的是()
A、任何晶体中,若含有阳离子也一定含有阴离子
B、原子晶体中含有共价键
C、离子晶体中只含有离子键,不含有共价键
D、分子晶体中只存在分子间作用力,不含有其他化学键练习2、下列物质的熔沸点比较正确的是()
A、金刚石>NaCl>O2B、F2
>Cl2
>Br2
C、S>NaBr>金刚石D、Na>CH4
>干冰CBAD练习3、下列各组晶体中,化学键类型、晶体类型都相同的是()
A、CO2和SiO2B、H2S和H2OC、NaCl和HClD、CF2Cl2和NaAcB练习4、(全国高考)关于晶体的下列说法中正确的是()
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、原子晶体的熔沸点一定比金属晶体的高
D、分子晶体中的熔点一定比金属晶体的低A例2、(03年荆州)美国《科学》杂志评选2001年世界科技十大成就中,名列第五的是日本青山学院大学教授光纯发现的金属间化合物硼化镁超导39K,该金属间化合物的晶体结构如下图所示,则它的化学式为(
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024-2025新职工入场安全培训考试试题(完整版)
- 电子商务师职业发展培训计划
- 租赁服务中介协议
- 旅游物资采购协议
- 二年级语文上册教学计划的创新与实践
- 建筑电器安装合同范本
- 初一班主任班级纪律管理计划
- 小学英语教研组学生能力提升计划
- 2025-2030中国TFT模块市场发展趋势及前景动态分析研究报告
- 2025-2030中国POC诊断行业市场发展趋势与前景展望战略研究报告
- 2024年韶关学院辅导员考试真题
- 物理-北京市朝阳区2025年高三年级第二学期质量检测一(朝阳一模)试题和答案
- 小学生金融知识进校园
- 【课件】高二下学期《清明祭英烈 共筑中华魂》主题班会课件
- 2024年宁夏电力投资集团招聘笔试真题
- 飞利浦超声基础培训
- 大学生创新创业演讲稿
- 医院物业保洁保安投标服务方案(技术方案)
- 陶瓷行业安全生产培训
- 学校感恩教育课件
- 新兴技术交流及应用方案推进工作指引

评论
0/150
提交评论