



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
高三化学组第八单元水溶液中的离子平衡第25讲难溶电解质的溶解平衡第一课时
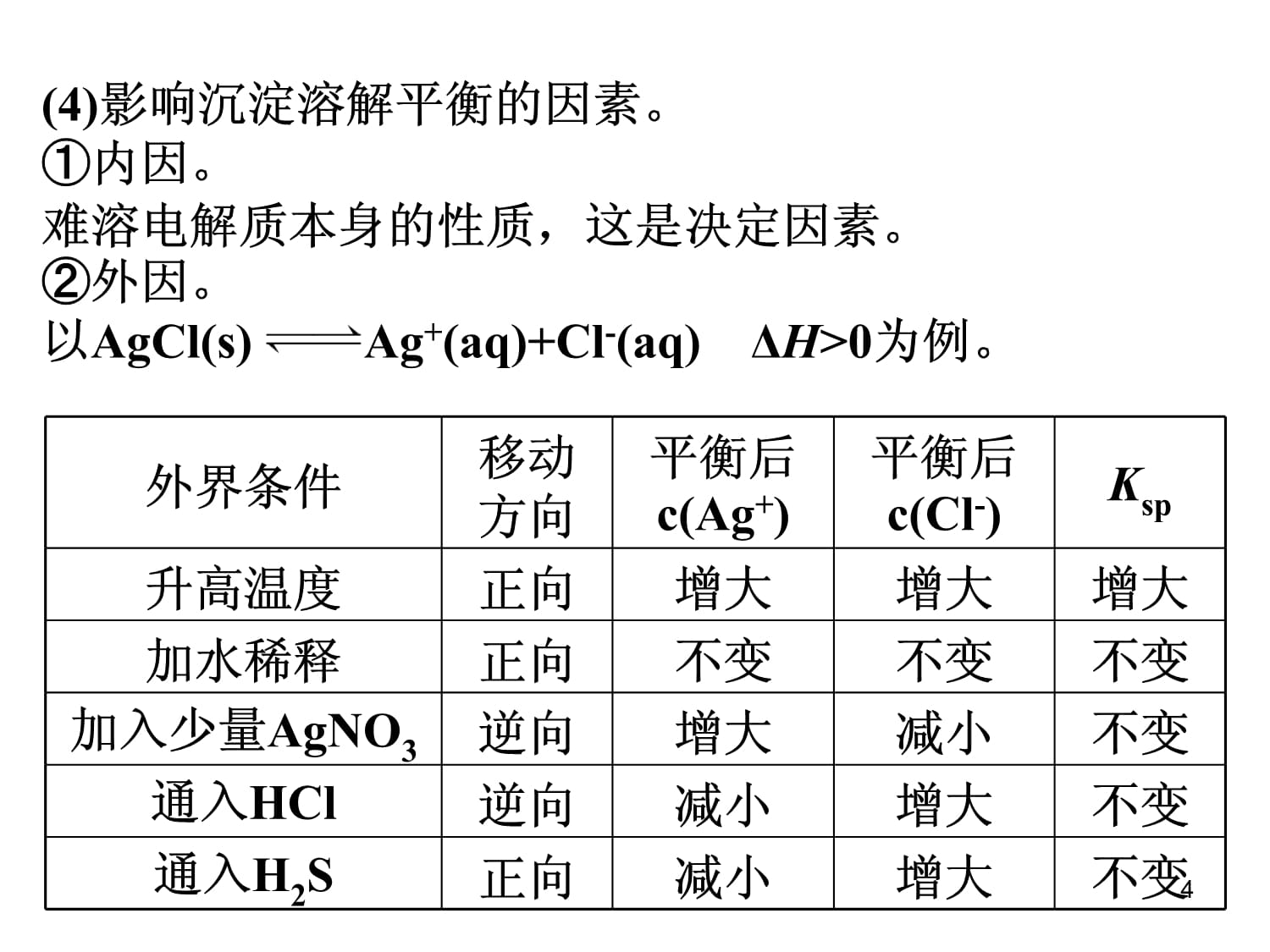
高三化学组第25讲难溶电解质的溶解平衡1考纲要求:1.了解难溶电解质的沉淀溶解平衡。2.理解溶度积(Ksp)的含义,能进行相关的计算。考纲要求:2一、沉淀溶解平衡及应用1.沉淀溶解平衡:(1)沉淀溶解平衡的概念。在一定温度下,当难溶电解质溶于水形成饱和溶液,溶解速率和生成沉淀速率相等的状态。(2)溶解平衡的建立。固体溶质溶液中的溶质。①v溶解>v沉淀,固体溶解。②v溶解=v沉淀,溶解平衡。③v溶解<v沉淀,析出晶体。(3)溶解平衡的特点。逆、动、等、定、变一、沉淀溶解平衡及应用3外界条件移动方向平衡后c(Ag+)平衡后c(Cl-)Ksp升高温度正向增大增大增大加水稀释正向不变不变不变加入少量AgNO3逆向增大减小不变通入HCl逆向减小增大不变通入H2S正向减小增大不变(4)影响沉淀溶解平衡的因素。①内因。难溶电解质本身的性质,这是决定因素。②外因。以AgCl(s)Ag+(aq)+Cl-(aq)
ΔH>0为例。外界条件移动平衡后平衡后Ksp升高温度正向增大增大增大加水稀4(5)电解质在水中的溶解度。20℃时,电解质在水中的溶解度与溶解性存在如下关系:(5)电解质在水中的溶解度。52.沉淀溶解平衡的应用:(1)沉淀的生成。①调节pH法。例如,除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为_________________________________。②沉淀剂法。例如,用H2S沉淀Cu2+,离子方程式为____________________。3Fe3++3NH3·H2O=Fe(OH)3+3NH4+H2S+Cu2+=CuS+2H+2.沉淀溶解平衡的应用:3Fe3++3NH3·H2O=Fe(6(2)沉淀的溶解。①酸溶解法。例如,CaCO3溶于盐酸,离子方程式为__________________________。②盐溶液溶解法。例如,Mg(OH)2溶于NH4Cl溶液,离子方程式为______________________________。③氧化还原溶解法。例如,不溶于盐酸的硫化物Ag2S溶于稀硝酸。④配位溶解法。例如,AgCl溶于氨水,离子方程式为_____________________________________。CaCO3+2H+=Ca2++H2O+CO2↑Mg(OH)2+NH4+=Mg2++2NH3·H2OAgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O(2)沉淀的溶解。CaCO3+2H+=Ca2++H2O+CO7(3)沉淀的转化:①实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化)。②应用:锅炉除垢、矿物转化等。锅炉除垢:将CaSO4转化为CaCO3。CaSO4+CO32-=CaCO3+SO42-矿物转化:CuSO4溶液遇ZnS转化为CuSCu2++ZnS=CuS+Zn2+(3)沉淀的转化:81.(2020·合肥模拟)已知溶液中存在平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)
ΔH<0,下列有关该平衡体系的说法正确的是(
)①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入Na2CO3溶液,其中固体质量增加⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A.①⑥B.①⑥⑦C.②③④⑥D.①②⑥⑦A能力提升A能力提升92.(2020·天津模拟)某兴趣小组进行下列实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解下列说法中不正确的是(
)A.将①中所得浊液过滤,所得滤液中含少量Mg2+B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶D.NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因C①中NaoH是过量的2.(2020·天津模拟)某兴趣小组进行下列实验:C①中Na10二、溶度积常数及其应用1.表达式:对于溶解平衡MmAn(s)mMn+(aq)+nAm-(aq),Ksp=_______________。2.意义:溶度积(Ksp)反映了物质在水中的溶解能力。3.影响因素:溶度积常数只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。cm(Mn+)·cn(Am-)二、溶度积常数及其应用cm(Mn+)·cn(Am-)11AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。①中浊液中存在沉淀溶解平衡:③v溶解<v沉淀,析出晶体。矿物转化:CuSO4溶液遇ZnS转化为CuS例如,用H2S沉淀Cu2+,离子方程式为(5)电解质在水中的溶解度。②应用:锅炉除垢、矿物转化等。将①中所得浊液过滤,所得滤液中含少量Mg2+②v溶解=v沉淀,溶解平衡。②③④⑥D.5、酸性锌锰干电池是一种一次性电池,回收处理该废电池可以得到多种化工原料。4、在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。(2)溶解平衡的建立。5、酸性锌锰干电池是一种一次性电池,回收处理该废电池可以得到多种化工原料。1mol·L-1FeCl3溶液,出现红褐色沉淀③将①中浊液过滤,取少量白色沉淀,滴加0.难溶电解质本身的性质,这是决定因素。固体溶质溶液中的溶质。5mol·L-1NaOH溶液等体积混合得到浊液②取少量①中浊液,滴加0.4.溶度积规则:某难溶电解质的溶液中任一情况下有关离子浓度的乘积Qc(离子积)与Ksp的关系:Qc<
Ksp溶液不饱和,无沉淀析出Qc=
Ksp溶液饱和,沉淀与溶解处于平衡状态Qc>
Ksp溶液过饱和,有沉淀析出AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+123、①已知t℃时AgCl的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(
)能力提升3、①已知t℃时AgCl的Ksp=2×10-10;②在t℃时13A.在t℃时,Ag2CrO4的Ksp为1×10-9B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点C.在t℃时,以0.01mol·L-1AgNO3溶液滴定20mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液,CrO42-先沉淀D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107正确的是D计算Cl-和CrO42-沉淀时需要的c(Ag+)最小值K=Ksp(Ag2CrO4)Ksp2(AgCl)A.在t℃时,Ag2CrO4的Ksp为1×10-9正确的是D144、在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为___________mol·L-1,此时溶液中c(CrO42-)等于__________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)2.0×10-55.0×10-3能力提升4、在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶155、酸性锌锰干电池是一种一次性电池,回收处理该废电池可以得到多种化工原料。有关数据如下表所示:用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加稀H2SO4和H2O2溶解,铁变为_____,加碱调节至pH为_____时,铁刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol·L-1)。若上述过程不加H2O2后果是__________________,原因是______________。化合物Zn(OH)2Fe(OH)2Fe(OH)3Ksp近似值10-1710-1710-39Fe3+2.76Zn2+和Fe2+分离不开Fe(OH)2和Zn(OH)2的Ksp相近5、酸性锌锰干电池是一种一次性电池,回收处理该废电池可以得到16高三化学组第八单元水溶液中的离子平衡第25讲难溶电解质的溶解平衡第一课时
高三化学组第25讲难溶电解质的溶解平衡17考纲要求:1.了解难溶电解质的沉淀溶解平衡。2.理解溶度积(Ksp)的含义,能进行相关的计算。考纲要求:18一、沉淀溶解平衡及应用1.沉淀溶解平衡:(1)沉淀溶解平衡的概念。在一定温度下,当难溶电解质溶于水形成饱和溶液,溶解速率和生成沉淀速率相等的状态。(2)溶解平衡的建立。固体溶质溶液中的溶质。①v溶解>v沉淀,固体溶解。②v溶解=v沉淀,溶解平衡。③v溶解<v沉淀,析出晶体。(3)溶解平衡的特点。逆、动、等、定、变一、沉淀溶解平衡及应用19外界条件移动方向平衡后c(Ag+)平衡后c(Cl-)Ksp升高温度正向增大增大增大加水稀释正向不变不变不变加入少量AgNO3逆向增大减小不变通入HCl逆向减小增大不变通入H2S正向减小增大不变(4)影响沉淀溶解平衡的因素。①内因。难溶电解质本身的性质,这是决定因素。②外因。以AgCl(s)Ag+(aq)+Cl-(aq)
ΔH>0为例。外界条件移动平衡后平衡后Ksp升高温度正向增大增大增大加水稀20(5)电解质在水中的溶解度。20℃时,电解质在水中的溶解度与溶解性存在如下关系:(5)电解质在水中的溶解度。212.沉淀溶解平衡的应用:(1)沉淀的生成。①调节pH法。例如,除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为_________________________________。②沉淀剂法。例如,用H2S沉淀Cu2+,离子方程式为____________________。3Fe3++3NH3·H2O=Fe(OH)3+3NH4+H2S+Cu2+=CuS+2H+2.沉淀溶解平衡的应用:3Fe3++3NH3·H2O=Fe(22(2)沉淀的溶解。①酸溶解法。例如,CaCO3溶于盐酸,离子方程式为__________________________。②盐溶液溶解法。例如,Mg(OH)2溶于NH4Cl溶液,离子方程式为______________________________。③氧化还原溶解法。例如,不溶于盐酸的硫化物Ag2S溶于稀硝酸。④配位溶解法。例如,AgCl溶于氨水,离子方程式为_____________________________________。CaCO3+2H+=Ca2++H2O+CO2↑Mg(OH)2+NH4+=Mg2++2NH3·H2OAgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O(2)沉淀的溶解。CaCO3+2H+=Ca2++H2O+CO23(3)沉淀的转化:①实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化)。②应用:锅炉除垢、矿物转化等。锅炉除垢:将CaSO4转化为CaCO3。CaSO4+CO32-=CaCO3+SO42-矿物转化:CuSO4溶液遇ZnS转化为CuSCu2++ZnS=CuS+Zn2+(3)沉淀的转化:241.(2020·合肥模拟)已知溶液中存在平衡:Ca(OH)2(s)Ca2+(aq)+2OH-(aq)
ΔH<0,下列有关该平衡体系的说法正确的是(
)①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入Na2CO3溶液,其中固体质量增加⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A.①⑥B.①⑥⑦C.②③④⑥D.①②⑥⑦A能力提升A能力提升252.(2020·天津模拟)某兴趣小组进行下列实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色沉淀④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解下列说法中不正确的是(
)A.将①中所得浊液过滤,所得滤液中含少量Mg2+B.①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶D.NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因C①中NaoH是过量的2.(2020·天津模拟)某兴趣小组进行下列实验:C①中Na26二、溶度积常数及其应用1.表达式:对于溶解平衡MmAn(s)mMn+(aq)+nAm-(aq),Ksp=_______________。2.意义:溶度积(Ksp)反映了物质在水中的溶解能力。3.影响因素:溶度积常数只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。cm(Mn+)·cn(Am-)二、溶度积常数及其应用cm(Mn+)·cn(Am-)27AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。①中浊液中存在沉淀溶解平衡:③v溶解<v沉淀,析出晶体。矿物转化:CuSO4溶液遇ZnS转化为CuS例如,用H2S沉淀Cu2+,离子方程式为(5)电解质在水中的溶解度。②应用:锅炉除垢、矿物转化等。将①中所得浊液过滤,所得滤液中含少量Mg2+②v溶解=v沉淀,溶解平衡。②③④⑥D.5、酸性锌锰干电池是一种一次性电池,回收处理该废电池可以得到多种化工原料。4、在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。(2)溶解平衡的建立。5、酸性锌锰干电池是一种一次性电池,回收处理该废电池可以得到多种化工原料。1mol·L-1FeCl3溶液,出现红褐色沉淀③将①中浊液过滤,取少量白色沉淀,滴加0.难溶电解质本身的性质,这是决定因素。固体溶质溶液中的溶质。5mol·L-1NaOH溶液等体积混合得到浊液②取少量①中浊液,滴加0.4.溶度积规则:某难溶电解质的溶液中任一情况下有关离子浓度的乘积Qc(离子积)与Ksp的关系:Qc<
Ksp溶液不饱和,无沉淀析出Qc=
Ksp溶液饱和,沉淀与溶解处于平衡状态Qc>
Ksp溶液过饱和,有沉淀析出AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+283、①已知t℃时AgCl的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(
)能力提升3、①已知t℃时AgCl的Ksp=2×10-10;②在t℃时29A.在t℃时,Ag2CrO4的Ksp为1×10-9B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点C.在t℃时,以0.01mol·L-1AgNO3溶液滴定20mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液,CrO42-先沉淀D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025年阳西县招教考试备考题库带答案解析(必刷)
- 2025年沈阳工业大学工程学院马克思主义基本原理概论期末考试模拟题含答案解析(必刷)
- 2025年陕西工运学院马克思主义基本原理概论期末考试模拟题带答案解析
- 2025年商丘学院单招职业倾向性考试题库带答案解析
- 2025年南京艺术学院马克思主义基本原理概论期末考试模拟题及答案解析(必刷)
- 2025年长兴县幼儿园教师招教考试备考题库及答案解析(必刷)
- 2024年潮安县幼儿园教师招教考试备考题库带答案解析
- 2025年普洱学院马克思主义基本原理概论期末考试模拟题含答案解析(夺冠)
- 2025年阳城县招教考试备考题库附答案解析(夺冠)
- 2025年康平县幼儿园教师招教考试备考题库附答案解析(夺冠)
- 2026年及未来5年市场数据中国带电作业机器人行业市场需求预测及投资规划建议报告
- 锰及化合物职业健康安全防护须知
- 春节后复产复工安全培训
- 森林管护培训
- 2026年北京市房山区公安招聘辅警考试试题及答案
- 军品生产现场保密制度
- DB32-T 5320-2025 疾病预防控制机构检验检测能力建设规范
- 46566-2025温室气体管理体系管理手册
- 数据保护及信息安全方案手册
- 电动重卡的可行性报告
- 中建物资管理手册

评论
0/150
提交评论