



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
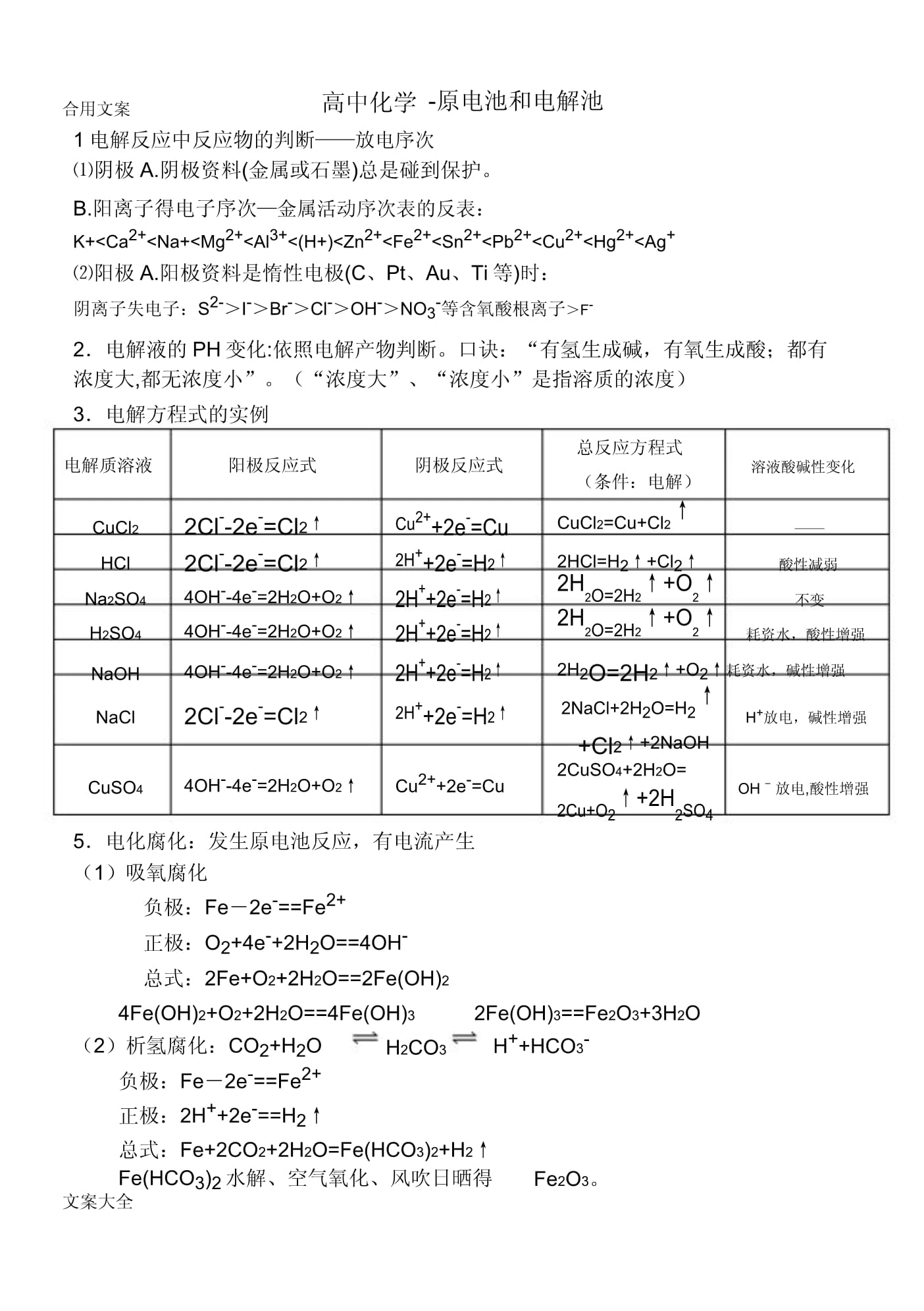
1、笔录学习记录学习学习记录高中化学原电池及电解池笔录学习记录学习学习记录高中化学原电池及电解池10/10笔录学习记录学习学习记录高中化学原电池及电解池合用文案高中化学-原电池和电解池1电解反应中反应物的判断放电序次阴极A.阴极资料(金属或石墨)总是碰到保护。B.阳离子得电子序次金属活动序次表的反表:K+Ca2+Na+Mg2+Al3+(H+)Zn2+Fe2+Sn2+Pb2+Cu2+Hg2+Ag+阳极A.阳极资料是惰性电极(C、Pt、Au、Ti等)时:阴离子失电子:S2-I-Br-Cl-OH-NO3-等含氧酸根离子F-2电解液的PH变化:依照电解产物判断。口诀:“有氢生成碱,有氧生成酸;都有浓度大,
2、都无浓度小”。(“浓度大”、“浓度小”是指溶质的浓度)3电解方程式的实例电解质溶液阳极反应式阴极反应式总反应方程式溶液酸碱性变化(条件:电解)CuCl22Cl-2e-=Cl2Cu2+2e-=CuCuCl2=Cu+Cl2HCl2Cl-2e-=Cl22H+2e-=H22HCl=H2+Cl2酸性减弱Na2SO44OH-4e-=2H2O+O22H+2e-=H22H2O=2H2+O2不变H2SO44OH-4e-=2H2O+O22H+2e-=H22H2O=2H2+O2耗资水,酸性增强NaOH4OH-4e-=2H2O+O22H+2e-=H22H2O=2H2+O2耗资水,碱性增强NaCl2Cl-2e-=Cl2
3、2H+2e-=H22NaCl+2H2O=H2H+放电,碱性增强+Cl2+2NaOHCuSO44OH-4e-=2H2O+O2Cu2+2e-=Cu2CuSO4+2H2O=OH放电,酸性增强2Cu+O2+2H2SO45电化腐化:发生原电池反应,有电流产生(1)吸氧腐化负极:Fe2e-=Fe2+正极:O2+4e-+2H2O=4OH-总式:2Fe+O2+2H2O=2Fe(OH)24Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3=Fe2O3+3H2O(2)析氢腐化:CO2+H2OH2CO3H+HCO3-负极:Fe2e-=Fe2+正极:2H+2e-=H2总式:Fe+2CO2+2H2O=Fe
4、(HCO3)2+H2Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。文案大全合用文案6.常有合用电池的种类和特点干电池(属于一次电池)结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。-2+-正极:2NH4+2e=2NH3+H2NH3和H2被Zn2、MnO2吸取:MnO2+H2=MnO+H2O,Zn24NH3=Zn(NH3)42铅蓄电池(属于二次电池、可充电电池)结构:铅板、填满PbO2的铅板、稀H2SO4。A.放电反应负极:Pb-2e-+SO42-=PbSO4正极:PbO2+2e-+4H+SO42-=PbSO4+2H2OB.充电反应-2-阴极:PbSO4+2e=Pb+SO4阳极
5、:PbSO4-2e-+2H2O=PbO2+4H+SO42-总式:Pb+PbO2+2H2SO4放电2PbSO4+2H2O=充电锂电池结构:锂、石墨、固态碘作电解质。电极反应负极:2Li-2e-=2Li+正极:-总式:2Li+I2=2LiII2+2e=2IA.氢氧燃料电池结构:石墨、石墨、KOH溶液。电极反应负极:H2-2e-+2OH-=2H2O正极:O2+4e-+2H2O=4OH-总式:2H2+O2=2H2OB铝、空气燃料电池4Al-12e-=4Al3+;电极反应:铝是负极石墨是正极3O-2+6H2O+12e=12OHB、电解冶炼铝+3-原料:(A)、冰晶石:Na3AlF6=3Na+AlF6、电解饱和食盐水(氯碱工业)反应原理阳极:2Cl-2e-=Cl2-文案大阴全极:2H+2e=H2电解总反应:2NaCl+2H2O=H2+Cl2+2NaOH(B)、氧化铝:NaOHNaAlO2铝土矿过滤CO2Al2O3Al(OH)3过滤原理阳极2-2O4e=O2阴极Al3+
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- DB31/T 729-2013提高大型冷却塔风机排风量的节能改造技术规范
- DB31/T 665-2012免煅烧脱硫石膏基胶凝材料
- DB31/T 1403-2023水稻机械化穴直播技术规范
- DB31/T 1242-2020数据中心节能设计规范
- DB31/T 1225-2020悬铃木白粉病防治技术规程
- 特需病房陪护人员雇佣合同书
- 5G通信技术股权投资预约合同
- DB31/T 1136-2019糯玉米生产技术规范
- DB31/T 1102-2018食品相关产品生产企业质量安全评价通则
- DB31/T 1073-2017特色乡村旅游园区(村)服务质量导则
- 反射疗法师理论考试复习题及答案
- 2023版中职教材-心理健康与职业生涯-第11课-主动学习-高效学习-课件
- 2024年重庆市高考思想政治试卷真题(含答案解析)
- 2024春期国开电大本科《外国文学》在线形考(形考任务一至四)试题及答案
- 阳光雨棚制作安装合同范本
- 福建小凤鲜禽业有限公司100万羽蛋鸡养殖基地项目环境影响报告书
- CJT 489-2016 塑料化粪池 标准
- 2024中考语文语言运用考点备考试题精练 (含答案)
- 苗木供应质量保证措施方案
- 2022-2023学年广东省广州市番禺区教科版(广州)四年级下册期末测试英语题卷(无答案)
- 【蔚来新能源汽车营销策略探究9200字(论文)】

评论
0/150
提交评论