



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、6.1 羰基化合物的反应机理羰基化合物的反应机理1.简单亲核加成历程简单亲核加成历程2.复杂亲核加成历程复杂亲核加成历程3.影响醛酮反应活性的因素影响醛酮反应活性的因素6.2 羰基加成反应及产物羰基加成反应及产物1.亲核加成反应亲核加成反应2.亲核加成亲核加成-消除反应消除反应6.3 羰基加成反应的立体化学羰基加成反应的立体化学1.Cram规则一规则一2.克莱姆规则二克莱姆规则二3.Cornforth规则规则4.环酮的还原环酮的还原6.4 碳负离子碳负离子1.碳负离子的结构碳负离子的结构6.5.碳负离子涉及的重要缩合反应碳负离子涉及的重要缩合反应1.羟醛缩合反应(羟醛缩合反应(Aldol缩合)
2、缩合)2.克脑文盖尔克脑文盖尔(Knoevenagel)反应反应3. 曼里许(曼里许(Mannich)反应)反应4. 克莱森(克莱森(Claisen)酯缩合反应)酯缩合反应5. 达森(达森(Darzen)反应)反应6.迈克尔迈克尔(Michael)加成反应加成反应7. 瑞佛马斯基(瑞佛马斯基(Reformatsky) 反应反应8.柏柏金金 (Perkin)反应反应9.安息香(安息香(Benzoin)缩合反应)缩合反应6.6羰基与叶立德(羰基与叶立德(ylide)的反应)的反应1.维蒂希(维蒂希(Witting)反应)反应2. 季磷盐与维蒂希试剂季磷盐与维蒂希试剂3.Wittig试剂在有机合成中
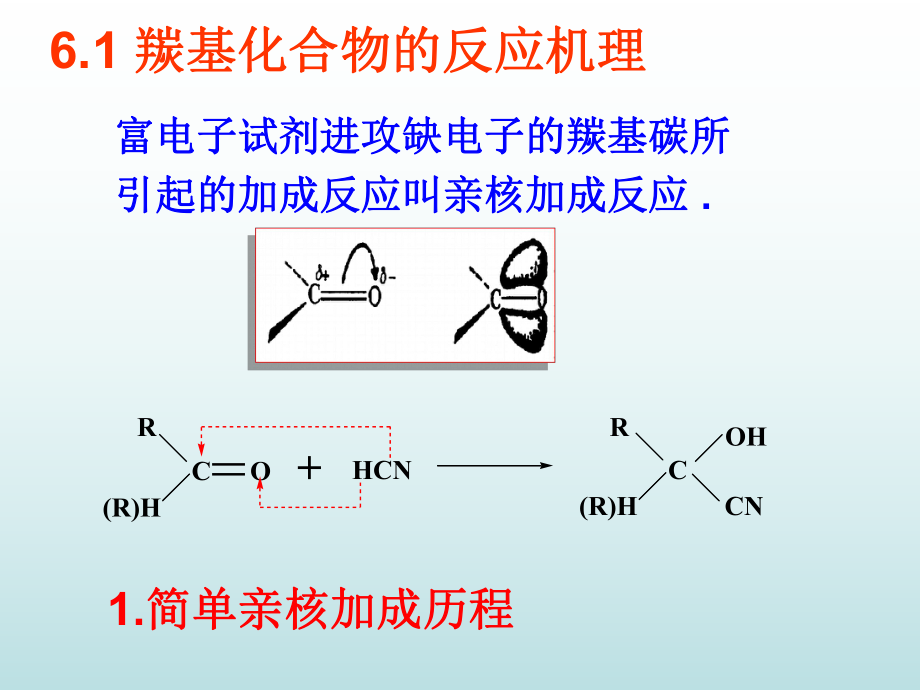
3、应用试剂在有机合成中应用4.硫叶立德与羰基的反应硫叶立德与羰基的反应6.7 羧酸极其衍生物的亲核取代羧酸极其衍生物的亲核取代1.BAc2机理机理 3.AAl1机理机理2.AAc2机理机理 4.AAc1机理机理6.8亲核性碳亲核性碳 1.烯醇负离子和硅醚烯醇负离子和硅醚2.仲胺与醛酮缩合成烯胺仲胺与醛酮缩合成烯胺3.噁唑啉衍生物的噁唑啉衍生物的-碳负离子碳负离子6.9特殊和普遍的酸碱催化特殊和普遍的酸碱催化6.10分子内催化作用分子内催化作用富电子试剂进攻缺电子的羰基碳所富电子试剂进攻缺电子的羰基碳所引起的加成反应叫亲核加成反应引起的加成反应叫亲核加成反应 .6.1 羰基化合物的反应机理羰基化合
4、物的反应机理R(R)HC=O+HCNR(R)HCOHCN1.简单亲核加成历程简单亲核加成历程反应历程的研究:反应历程的研究: .HCN加入丙酮中加入丙酮中3-4小时原料只反应一半小时原料只反应一半。.加一滴加一滴KOH反应几分钟内就完成。反应几分钟内就完成。.加入大量酸后放置几个星期也不反应。加入大量酸后放置几个星期也不反应。HCN H+ + CN-OH +H2O + H+HCN加碱促进加碱促进HCN的的离解离解加酸抑制加酸抑制HCN的离解的离解据以上现象可知反应须在弱碱性条件下进据以上现象可知反应须在弱碱性条件下进行,过程如下:行,过程如下:HCN CN- + H2O-OHH2OC=OCO-
5、OHCCH3-CNCNCNCH3CH3CH3CH3CH3+ HNHGC=OCNGHOH-H2OC=NGOG: -H -OH -NH2 -NH-C-NH2-NH-NHNO2O2N醛酮与氨或伯胺加成生成亚胺(西佛碱,醛酮与氨或伯胺加成生成亚胺(西佛碱,Schiff base) 亚胺亚胺(西佛碱西佛碱)不稳定不稳定,易失水易失水 Schiff碱系化合物由于在生化反应中起到转氨基作用而具碱系化合物由于在生化反应中起到转氨基作用而具有抗肿瘤、抗菌等生物活性。有抗肿瘤、抗菌等生物活性。2.2.复杂亲核加成反应复杂亲核加成反应CO+H+快COH+H2NB 慢COHNH2B+快COH2NHB+快,-H2OCN
6、+HB快,-H+CNBC+-OCOHNu+H+COHCOH+Nu-H+-H+首先是羰基质子化,其次亲核试剂进攻缺电子的羰基碳。首先是羰基质子化,其次亲核试剂进攻缺电子的羰基碳。酸催化:酸催化: 反应的推动力之一:反应的推动力之一:羰基碳上缺电子(亲电性);羰基碳上缺电子(亲电性); 反应的推动力之二:反应的推动力之二:进攻试剂上电子对可利用程度进攻试剂上电子对可利用程度(亲核试剂);(亲核试剂); 酸催化使羰基生成羰基氧正离子,而增加羰基酸催化使羰基生成羰基氧正离子,而增加羰基碳上的缺电性;碱催化是增加进攻试剂的亲核成分。碳上的缺电性;碱催化是增加进攻试剂的亲核成分。 若羰基上连有若羰基上连有
7、给电子基给电子基,会减少羰基碳的正电性,会减少羰基碳的正电性,推动力之一减弱。推动力之一减弱。 空阻空阻将增加中间体生成的难度(键角变小)将增加中间体生成的难度(键角变小) 由于由于p-p-共轭共轭,RCHO的中羰基碳的正电性下降,的中羰基碳的正电性下降,亲核反应活性下降。亲核反应活性下降。醛、酮亲核加成反应的活性的判断:醛、酮亲核加成反应的活性的判断:.羰基碳的正电性越强反应活性越大。羰基碳的正电性越强反应活性越大。.羰基碳上所连的烃基体积越小反应活性越羰基碳上所连的烃基体积越小反应活性越 大。大。 反应物反应物 过渡态过渡态 反应中间体反应中间体 产物产物 平面三角形平面三角形 四面体四面
8、体氧上氧上 四面体四面体 四面体四面体 带部分负电荷带部分负电荷 氧上带负电荷氧上带负电荷C+-+Nu-OCONu CO-NuCOHNu+H2O-3.影响醛酮反应活性的因素影响醛酮反应活性的因素CROCRROH空间效应空间效应CRRO(H) 中心碳杂化态中心碳杂化态SP2SP3,键角由键角由1200109.5,基团间斥力大。,基团间斥力大。R、R,的体积越大,的体积越大,K越小越小空阻对空阻对Nu的进攻障碍大。的进攻障碍大。 Nu 的体积越大,的体积越大,K越越小小 Nu不易接近羰基碳。不易接近羰基碳。电子效应电子效应诱导效应诱导效应 当羰基连有吸电子基时,使羰基碳上当羰基连有吸电子基时,使羰
9、基碳上的正电性增加,有利于亲核加成的进行;的正电性增加,有利于亲核加成的进行; 共轭效应共轭效应 羰基上连有与其形成共轭体系的基团时,羰基上连有与其形成共轭体系的基团时,由于共轭作用可使羰基稳定化,因而亲核加成速由于共轭作用可使羰基稳定化,因而亲核加成速度减慢。度减慢。 使羰基碳正电性加强的因素都有利于反应。使羰基碳正电性加强的因素都有利于反应。CHONO2CHOXCHORCHOOH CROCRROHCRRO(H)CR(H)O试剂的亲核性的影响试剂的亲核性的影响 :亲核性愈强,反应愈快。:亲核性愈强,反应愈快。CH3-CHOCH3-C-CH3OClCH2-CHOCl3C-CHOCH3-C-CH
10、2CH3CH3CH3CH-C-H-C-CH3OOO-C-HO下列化合物与下列化合物与HCN加成反应的活性:加成反应的活性:醛酮亲核反应活性:醛酮亲核反应活性:6.2 羰基加成反应及产物羰基加成反应及产物1.亲核加成反应亲核加成反应RRCO(H)+-+A Nu+-HCNANuNaHSO3RMgXCHCNaROHH2NHH2NH2NRHNH OHHNH NH2HNH C6H5HNH CONH2Ph3P+CRR-:CNuR(H)ROA与水加成与水加成 水是较弱的亲核试剂,只有与羰基活性很大的醛、水是较弱的亲核试剂,只有与羰基活性很大的醛、酮才能进行加成形成稳定的水合物。酮才能进行加成形成稳定的水合物
11、。水合三氯乙醛(安眠药)水合三氯乙醛(安眠药) mp. 5657CHCHO + H2OOHHCHOH100%CH3CHO + H2OOHCH3CHOH58%CH3CH2CHO + H2OOHCH3CH2CHOH 0%Cl3C-CHO + H2OOHCl3C-CHOH100%碱和酸都能催化水化反应碱和酸都能催化水化反应 RCHO-OHRCHO-OHRCH(OH)2 + OH碱:B- + H2O + RCH=O+ BH+ H2ORCH=OHARCH=OHARCHOH + A-OH2酸:RCH=O + HA+ H2O酸催化使羰基生成羰基氧正离子,而增加羰基碳上酸催化使羰基生成羰基氧正离子,而增加羰基
12、碳上的缺电性;碱催化是增加进攻试剂的亲核成分。的缺电性;碱催化是增加进攻试剂的亲核成分。 . 与醇与醇ROH反应反应RRCO+CRR干 HClH3O+CH2OHCH2OHOCH2OCH2RHCO+CORRHOHCORRHOHROH干 HClH3O+ROH干 HClH3O+缩 醛半缩 醛 (不 稳定)由半缩醛生成缩醛只能被酸催化由半缩醛生成缩醛只能被酸催化 环状半缩醛稳定,在糖类化合物中多见。环状半缩醛稳定,在糖类化合物中多见。酮在一般条件下形成缩酮较困难,用酮在一般条件下形成缩酮较困难,用1,2-二醇或二醇或1,3-二醇则易生成缩酮。二醇则易生成缩酮。R采取措施采取措施:使用二元醇,并除去反应
13、中生成的水。使用二元醇,并除去反应中生成的水。环环己己酮酮缩缩乙乙二二醇醇8 80 0% % 8 85 5% %+OOH2OO+CH2CH2OHOH对对甲甲苯苯磺磺酸酸苯苯水苯恒沸物组成与沸点恒沸物组成与沸点 水:苯水:苯=9:91 沸点:沸点:69CH+C=ORRCOC2H5OC2H5C2H5OH+COC2H5OC2H5RRHCOC2H5O+ 对于活性小的酮可使用原甲酸酯对于活性小的酮可使用原甲酸酯原甲酸三乙酯原甲酸三乙酯缩酮缩酮缩醛、酮的用途:缩醛、酮的用途: 在有机合成中可以用来保护醛酮的羰基。在有机合成中可以用来保护醛酮的羰基。 对碱、氧化剂、还原剂对碱、氧化剂、还原剂但对稀酸不稳定:
14、但对稀酸不稳定:CRORORH(R)H3O+C=O + 2ROHRH(R)缩醛酮的性质缩醛酮的性质醛醛 酮酮敏敏感感缩缩醛醛酮酮稳稳定定.与金属有机化合物加成与金属有机化合物加成 金属有机化合物含有一个极性共价键或离子金属有机化合物含有一个极性共价键或离子 键键 ,因而能与醛、酮进行亲核加成。,因而能与醛、酮进行亲核加成。+-RM曾认为曾认为Grignard试剂与羰基物试剂与羰基物的加成涉及到一个三分子六元的加成涉及到一个三分子六元环状络合物过渡态环状络合物过渡态Grignard试剂试剂(CH3)2CH C CH(CH3)2O1.CH3CH2MgBr 2. H3O+1.(CH3)2CHMgBr
15、 2. H3O+1.CH3CH2CH2MgBr 2. H3O+加成产物产率80%30%0%1.(CH3)2CHLi2. H3O+(CH3)2CH C CH(CH3)2CH(CH3)2OH 因此,制备烃基体积较大的叔醇时,就不能使用格因此,制备烃基体积较大的叔醇时,就不能使用格氏试剂。但若使用亲核性更强的有机锂化合物,仍能氏试剂。但若使用亲核性更强的有机锂化合物,仍能得到满意的结果。得到满意的结果。与炔化钠加成:与炔化钠加成:C=O+HCCONaCCHH3O+COHCCHCH3CH3CH3CH3CH3CH3C-Na+H+-H2OCH2=CCH3CCHCH2=CCH3CH=CH2 H异戊二烯OCC
16、H3O1. HC2. H3O+OHCCHCNaCCHH+-H2O+H2O/HgSO4OHNHHC=O-H2OC=NNHNHNO2O2N HNHOHHNHNH2HNHHNHHNHNH-C-NH2C=NHC=NOHC=NNH2C=NC=NNHNHNO2O2NONH-C-NH2氨亚胺羟氨肟肼腙苯肼苯腙2,4-二硝基苯肼2,4-二硝基苯腙氨基脲缩氨脲(白)(白)(白)(黄)2.亲核加成亲核加成-消除反应消除反应CO+NH2BCNHHOH HBCNB6.3 羰基加成反应的立体化学羰基加成反应的立体化学 羰基具有平面结构,羰基具有平面结构,NuNu可从任何一面进攻羰基碳。在可从任何一面进攻羰基碳。在下列的
17、下列的3中,加成后引入了第二个中,加成后引入了第二个C,生成的两个非对映生成的两个非对映体的量不相等,既亲核加成具有一定的立体选择性。体的量不相等,既亲核加成具有一定的立体选择性。 当当R=R时,加成产物为同一物。时,加成产物为同一物。 当当RR时,加成产物为外消旋体(时,加成产物为外消旋体(Nu从羰基两面进从羰基两面进攻的几率相等)。攻的几率相等)。 当羰基与手性碳原子相连时,当羰基与手性碳原子相连时,Nu从两面进攻的几率从两面进攻的几率就不一定相等,加成后引入第二个手性碳原子,生成就不一定相等,加成后引入第二个手性碳原子,生成的两个非对映体的量也不一定相等。的两个非对映体的量也不一定相等。
18、 设设-手性碳原子上所连的三个基团手性碳原子上所连的三个基团L、M、S代表代表其大、中、小,其大、中、小,将羰基与其将羰基与其 -碳上最大的基团摆放成碳上最大的基团摆放成反位,反位,Nu主要从最小基团一边进攻羰基。主要从最小基团一边进攻羰基。1.Cram规则一规则一由美国化学家克拉姆于由美国化学家克拉姆于1952年提出年提出1 RMgX2 H2O主要产物主要产物次要产物次要产物 Cram规则主要适用于金属氢化物和金属有机规则主要适用于金属氢化物和金属有机化合物与酮的作用。化合物与酮的作用。C CHC6H11CH3OCH3C CHC6H11CH3OHHCH3C CHC6H11CH3OHHCH37
19、2%28%实实例例: :LiAlH4Nu-H+OHNu主主次次MSLCCROMSLCCROHNuMSLCCR楔形式的表示法:楔形式的表示法:用纽曼式表示用纽曼式表示:72%28% 利用分子中已存在的不对称因素的诱导作用,通利用分子中已存在的不对称因素的诱导作用,通过某种立体选择性反应,生成特定的构型化合过某种立体选择性反应,生成特定的构型化合物物不对称合成。不对称合成。 醛酮中原有的手性碳原子为不对称因素。醛酮中原有的手性碳原子为不对称因素。2.2.克莱姆规则二克莱姆规则二 当醛、酮的当醛、酮的 - -C上有上有- -OH、-NH时,由于这些基团时,由于这些基团能与羰基形成氢键,所以形成能与羰
20、基形成氢键,所以形成如下构象(见图),若发生加如下构象(见图),若发生加成,亲核试剂主要从成,亲核试剂主要从S基团一基团一侧进攻侧进攻。Nu- 3.Cornforth规则规则 (p85) 当酮的当酮的不对称碳上连有卤原子时,由于卤原子不对称碳上连有卤原子时,由于卤原子与羰基的排斥作用,酮的优势构象是卤原子和羰与羰基的排斥作用,酮的优势构象是卤原子和羰基互为对位,羰基反应时,试剂仍优先从小基团基互为对位,羰基反应时,试剂仍优先从小基团一边进攻,称为一边进攻,称为Cornforth规则。规则。ClHCH3OCH31)C2H5MgBr2)H2OClHCH3OHCH3C2H54.环酮的还原环酮的还原O
21、HCH3HHOHCH3HHOCH3H(CH3)2CHOHNaBH4H2O+ + 69% 31% 脂环酮的羰基嵌在环内,环上所连基团空间位脂环酮的羰基嵌在环内,环上所连基团空间位阻的大小,明显的影响着阻的大小,明显的影响着Nu的进攻方向的进攻方向。CH3CH3HOHCH3CH3HOHCH3CH3OLiAlH4+从外侧进攻得内产从外侧进攻得内产物,产物不稳定。物,产物不稳定。(1)内内(2)外外樟脑樟脑 (1)异冰片异冰片(外型外型) (2)冰片冰片(内型内型) (90%) (10%)从内侧进攻得外型从内侧进攻得外型产物,产物稳定。产物,产物稳定。空阻差别空阻差别不大时,不大时,主要得稳主要得稳定
22、产物。定产物。 空阻差别大时,主要得从空阻小的方向空阻差别大时,主要得从空阻小的方向进攻的产物进攻的产物空间靠近控制。空间靠近控制。 空阻差别不大时,主要得稳定产物空阻差别不大时,主要得稳定产物产物生成控制产物生成控制对于同一反应物,所用对于同一反应物,所用Nu体积的大小,也影响其体积的大小,也影响其进攻方向。例如:进攻方向。例如: 6.4 碳负离子碳负离子 其结构和氨一样,大多是角锥形其结构和氨一样,大多是角锥形sp3杂化构型。杂化构型。 这样的构型一方面由于孤对电子是位于这样的构型一方面由于孤对电子是位于sp3(含有(含有25的的s成分)杂化轨道中,它与孤对电子位于成分)杂化轨道中,它与孤
23、对电子位于p轨道上的轨道上的sp2 杂化结构相比,孤对电子更靠近原杂化结构相比,孤对电子更靠近原子核,故能量低(子核,故能量低(S-特性效应特性效应) ; 另一方面,在角锥形构型中,孤电子对与另三对另一方面,在角锥形构型中,孤电子对与另三对成键电子之间的斥力也比平面形的构型小,前者成键电子之间的斥力也比平面形的构型小,前者的键角靠近的键角靠近109.50,后者的键角是,后者的键角是900。 但为形成烯醇化物而稳定的碳负离子和与不饱和但为形成烯醇化物而稳定的碳负离子和与不饱和键相连的碳负离子是平面形的,碳负离子为键相连的碳负离子是平面形的,碳负离子为sp2 杂化。杂化。 这样碳上负电荷所在的这样
24、碳上负电荷所在的p轨道可以与相邻基团的轨道可以与相邻基团的轨道发生最大程度的轨道重叠,因而体系能量下轨道发生最大程度的轨道重叠,因而体系能量下降。降。.杂化效应杂化效应 碳负离子中心杂化轨道碳负离子中心杂化轨道S成分越多,电子对靠近原子核,成分越多,电子对靠近原子核,碳负离子越稳定。碳负离子越稳定。.芳香性芳香性 具有芳香性的环状碳负离子有较好的具有芳香性的环状碳负离子有较好的稳定性,如环戊二烯负离子等。稳定性,如环戊二烯负离子等。.溶剂效应溶剂效应 极性非质子溶剂(极性非质子溶剂(DMSO)可溶剂化正离子,不能溶剂化)可溶剂化正离子,不能溶剂化负离子,因此负离子在极性非质子溶剂中更加活泼,这
25、也是负离子,因此负离子在极性非质子溶剂中更加活泼,这也是一些反应所需要的。一些反应所需要的。.电子效应电子效应 拉电子诱导基团、共轭体系均使碳负离子稳定拉电子诱导基团、共轭体系均使碳负离子稳定碳负离子的形成是酸碱反应,是碳负离子的形成是酸碱反应,是 C-H 键异裂的结果。键异裂的结果。有机物中碳原子与碱反应释放出质子,有机物中碳原子与碱反应释放出质子,C-H 键的键的电离也应当看作是酸性电离:电离也应当看作是酸性电离: RH + :B R- + BH+有机分子的碳氢键脱质子作用有机分子的碳氢键脱质子作用所有电负性基团邻近的所有电负性基团邻近的-C上都可能离解其氢。上都可能离解其氢。CH2NOH
26、BCH2NOCH2NOCH2CHBCH2CNNCH2CNCH2SH3COHBCH2SH3COCH2SH3COOOOOOO. 醛酮醛酮-氢的电离氢的电离 醛酮在羰基的影响下,醛酮在羰基的影响下, C-H的的键与键与C=O上上键存在超共轭效应,键存在超共轭效应,- -氢有一定的酸性,可以电氢有一定的酸性,可以电离并形成较稳定的碳负离子。酮和烯醇在碱的催化离并形成较稳定的碳负离子。酮和烯醇在碱的催化下形成动态平衡,中间体是碳负离子的共振体:下形成动态平衡,中间体是碳负离子的共振体: CHRCROHCHRCROHBCHRCROCHRCRO(g 位位 H 有弱酸性有弱酸性)CHRCROOHCHRCROO
27、CHRCROOBRORHROR ROR B. -酮酸酯中活性亚甲基的酸性离解酮酸酯中活性亚甲基的酸性离解 -酮酸酯分子中羰基和酯基之间的亚甲基,酮酸酯分子中羰基和酯基之间的亚甲基,受两个吸电子基团的影响而有很高的活性,称为受两个吸电子基团的影响而有很高的活性,称为活性亚甲基。活性亚甲基在碱性条件下容易失去活性亚甲基。活性亚甲基在碱性条件下容易失去氢原子,形成碳负离子。氢原子,形成碳负离子。一些一些 典型的典型的CH的酸性比较的酸性比较pKapKaHCH2CH3HCH2CH CH2HCH2HCH2C NHCH2SCH3OO 3550253429HCH2COC2H5OHCH2CCH3OHCH2CO
28、HCH2NOO201610.224一些羰基一些羰基-H酸性的比较酸性的比较-二羰基二羰基化合物化合物-氢酸性氢酸性相对较强。相对较强。pKaH2CCCH3OH2CCOC2H5OC2H5OCCHOCOC2H5OH3CCCHOCOC2H5OH3CCCHOCCH3OHHHHH242012.710.79.0. 有机金属化合物中的碳负离子有机金属化合物中的碳负离子 卤代烃与金属作用,生成烷基锂、格氏试剂等卤代烃与金属作用,生成烷基锂、格氏试剂等有机金属化合物,其中烷基都像碳负离子一样,是有机金属化合物,其中烷基都像碳负离子一样,是较强的亲核试剂,也是强碱。较强的亲核试剂,也是强碱。a.作为强碱可与比作为
29、强碱可与比RH强的酸反应:强的酸反应: RCCHR+MgXRCCMgXRH+nC C18H37BrMg纯纯醚醚,nC C18H37MgBrCH3(CH2)16CH2BrnC C18H37C18H37b.作为亲核试剂,易与活泼的卤代烃发生偶联反应。作为亲核试剂,易与活泼的卤代烃发生偶联反应。 活泼的卤代烃:烯丙基卤、苄基卤活泼的卤代烃:烯丙基卤、苄基卤.在脱羰反应、芳香族亲核取代反应及在脱羰反应、芳香族亲核取代反应及E1cb等等反应中产生碳负离子反应中产生碳负离子 . 亲核试剂加到活性烯、炔烃上亲核试剂加到活性烯、炔烃上 如如CN-、-OH、-SR、-OR 等加成到炔烃上。等加成到炔烃上。(7)
30、形成碳负离子的外界条件形成碳负离子的外界条件 碱(碱(B-)有亲质子性和亲核性二重特性。亲质有亲质子性和亲核性二重特性。亲质子性即碱进攻有机结构中的质子,使之脱去氢,形子性即碱进攻有机结构中的质子,使之脱去氢,形成碳负离子;亲核性即进攻该分子中正电荷较多的成碳负离子;亲核性即进攻该分子中正电荷较多的碳原子,发生亲核加成或亲核取代反应。如:碳原子,发生亲核加成或亲核取代反应。如: 欲形成碳负离子,应选择亲质子能力强而亲核欲形成碳负离子,应选择亲质子能力强而亲核能力弱的碱性化合物能力弱的碱性化合物 。一些常用于生成烯醇负离子的碱一些常用于生成烯醇负离子的碱强碱强碱较强碱较强碱叔胺类叔胺类吡啶衍生物
31、吡啶衍生物Na NH2Li NCH(CH3)2CH(CH3)2(LDA)SOCH3Na CH2Na HNaOHNaOR 位阻小的部位易生成碳负离子位阻小的部位易生成碳负离子碳负离子形成的碳负离子形成的动力学控制动力学控制 取代基多的部位由于有烯丙基共轭体系的共振式,取代基多的部位由于有烯丙基共轭体系的共振式,碳负离子更稳定碳负离子更稳定碳负离子形成的碳负离子形成的热力学控制热力学控制动力学控制动力学控制热力学控制热力学控制碳负离子形成的动力学控制和热力学控制碳负离子形成的动力学控制和热力学控制 为了某一合成要求,需要掌握、控制形成不为了某一合成要求,需要掌握、控制形成不同碳负离子的条件:同碳负
32、离子的条件: 一般在较低温度下和体积较大的碱时,易形成位一般在较低温度下和体积较大的碱时,易形成位阻小的中心碳负离子阻小的中心碳负离子 一般在较高温度和体积较小的碱时,易形成取代一般在较高温度和体积较小的碱时,易形成取代基较多部位的碳负离子基较多部位的碳负离子热力学控制热力学控制动力学控制动力学控制6.5 碳负离子涉及的重要缩合反应碳负离子涉及的重要缩合反应由两个或两个以上的化合物通过反应,失去一由两个或两个以上的化合物通过反应,失去一个小分子化合物(如水、醇、盐等)而形成一个小分子化合物(如水、醇、盐等)而形成一个新的较大分子化合物的反应称为缩合反应。个新的较大分子化合物的反应称为缩合反应。
33、本章主要讨论:本章主要讨论:由活泼氢形成的碳负离子型缩合由活泼氢形成的碳负离子型缩合碳负离子对羰基的亲核加成反应或加成碳负离子对羰基的亲核加成反应或加成- -消除反应消除反应一分子提供一分子提供C=O,另一分子提供活泼,另一分子提供活泼- H各种缩合反应的机理相似:先在碱的催化下形成各种缩合反应的机理相似:先在碱的催化下形成碳负离子作为亲核试剂;然后对另一分子羰基进碳负离子作为亲核试剂;然后对另一分子羰基进攻发生亲核反应:攻发生亲核反应:含有含有氢的醛或酮,在碱或酸的催化下,生成氢的醛或酮,在碱或酸的催化下,生成羟基醛羟基醛或酮类化合物的反应称为羟醛或醇醛(或酮类化合物的反应称为羟醛或醇醛(A
34、ldol)缩合反应。缩合反应。羟基醛或酮经消除便成羟基醛或酮经消除便成,不饱和醛酮不饱和醛酮。1.羟醛缩合反应(羟醛缩合反应(Aldol缩合)缩合)羟醛缩合、醇醛缩合羟醛缩合、醇醛缩合反应条件:稀碱,反应条件:稀碱, 含有含有氢的醛或酮;氢的醛或酮;产物:产物:-羟基醛(酮)羟基醛(酮) 或或-不饱和醛(酮)。不饱和醛(酮)。 CCOHH+COCCOHCOHOH CCOC-H2O反应机理反应机理: 羟醛反应广泛存在于自然界中。比如羟醛反应广泛存在于自然界中。比如糖酵解糖酵解中磷酸中磷酸葡萄糖分解成磷酸甘油和磷酸二羟基丙酮的反应(逆反葡萄糖分解成磷酸甘油和磷酸二羟基丙酮的反应(逆反应)等等。应)
35、等等。1,6-二磷酸果糖二磷酸果糖磷酸二羟丙酮磷酸二羟丙酮3-磷酸甘油醛磷酸甘油醛糖酵解是葡萄糖在无氧条件下降解为丙酮酸并伴随糖酵解是葡萄糖在无氧条件下降解为丙酮酸并伴随ATP生成生成的过程。是一切有机体中普遍存在的葡萄糖降解途径。的过程。是一切有机体中普遍存在的葡萄糖降解途径。是糖是糖有氧分解有氧分解的准备阶段。的准备阶段。是是厌氧生物厌氧生物获得能量的主要方式。获得能量的主要方式。碱催化的反应机理碱催化的反应机理: CH3CHOOH-CH2CHOO CH CH3-H2OOHCCH2CH CH3O-H2OOHCHCH CH3OH-OH-H-H2OCH3CH=CHCHOCH3CCH3OCH3C
36、-CH2-H+OHCH3C=CH2OHCH3CCH3+OHOHCH3-C-CH2-C(CH3)2+OH-H+OHCH3-C-CH2-C(CH3)2O-H2OCH3-C-CH=C(CH3)2O酸催化下的反应机理酸催化下的反应机理烯醇化烯醇化亲核加成亲核加成酸碱反应酸碱反应H+-H+-烯的较负部分和羰基和亲核加成 生成烯醇或烯醇盐的过程称为烯醇化。当一个非对称的酮烯生成烯醇或烯醇盐的过程称为烯醇化。当一个非对称的酮烯醇化的时候,存在两种可能。见上图。醇化的时候,存在两种可能。见上图。 实验表明,碱催化条件下反应受动力学控制,烯醇化脱质子,实验表明,碱催化条件下反应受动力学控制,烯醇化脱质子,位阻为
37、主要影响因素,产物以位阻为主要影响因素,产物以2b为主。为主。 而在酸催化下反应受热力学控制,生成取代度较高较稳定的而在酸催化下反应受热力学控制,生成取代度较高较稳定的烯醇,即对应于烯醇盐烯醇,即对应于烯醇盐2a的烯醇。的烯醇。2-丁酮酸催化缩合产物:丁酮酸催化缩合产物:2-丁酮碱催化缩合产物:丁酮碱催化缩合产物:例例H3CH2CCHCCH3COCH3OHCH3H2CCH3COCH3H3CH2CCOCH3H+HCCH3COH+CH3HHCCH3COHCH3H3CH2CCH2CC2H5COOHCH3H3CH2CCOCH3H3CC2H5CO-H2CC2H5CO3,4-二甲基二甲基-2-己酮己酮-4
38、-醇醇5-甲基甲基-3-庚酮庚酮-5-醇醇CH3CH2CH2CHO2KOHCH3CH2CH2CHCHCHOHOC2H5C7H15CHO2NaOEtC7H15CHCCHC6H13OCH3CH3OOKOHCH3OCH3OHCH3OCH3- - H2O缩合方式缩合方式 若用若用两种不同的有两种不同的有-H的醛进行羟醛缩合,则的醛进行羟醛缩合,则可能发生交错缩合,最少生成四种产物。可能发生交错缩合,最少生成四种产物。例如:例如:稀OHCH3CHO + CH3CH2CHOCH3CHCH2CHOOHCH3CH2CHCHCHOOHCH3CH3CH-CHCHOOH CH3CH3CH2CHCH2CHOOH产物复
39、杂无合成价值.交叉羟醛缩合(两种不同醛酮之间的羟醛缩合)交叉羟醛缩合(两种不同醛酮之间的羟醛缩合)l若选用若选用一种无一种无-H的醛和的醛和一种一种-H的醛进行交错羟醛缩合的醛进行交错羟醛缩合,则有合成价值。,则有合成价值。l常见常见无无-H的醛有甲醛、芳香醛、的醛有甲醛、芳香醛、2,2-二甲基丙醛等。二甲基丙醛等。CH3CHO+3HCHO稀OH-CHOH2CCH2OHCH2OHCHO浓碱HCHO季戊四醇(重要的高分子原料)CHOH2CCH2OHCH2OHCHOCHOH2CCH2OHCH2OHCH2OHC6H5CHO + CH3CHOOHC6H5CH=CHCHOn CH3OCH3CH3OCH3
40、CH3OCH3OCH3CH3CH3CH3OHCH3OCH3MgX+CH3OCH3OCH3CH3CH3CH3OHCH3OCH3MgX+A.BC.DCH3O(1) CH3MgX(2) H2OCH3CH3OHH+ CH3CH3(1) O3(2) H2OOHCH3OCH3OHCH3CH3OCH3CH3OOCH3CH2CH2CHOCH3CH2CH2CHC2H5CCOOHOCH3CH2CH2CHC2H5CCOOHOCH3CH2CH2CHC2H5CCOOHCH3CH2CH2CHC2H5CCHOCH3CH2CH2CHC2H5CH2CHOO+KOH2Ag(NH3)2OHCH3CH2CH2CHC2H5CCOOHR
41、CO3HCH3CH2CH2CHC2H5CCOOHOCH3CH2CH2CHOCH3CH2CH2CHC2H5CCHOCHO+CH3COCH3OC2H5ONaC2H5OH-5柠檬醛柠檬醛A假假紫罗兰酮紫罗兰酮- -紫罗兰酮紫罗兰酮l 用路易斯酸或用路易斯酸或80磷酸处理磷酸处理假紫罗兰酮假紫罗兰酮,主要得到动力学产,主要得到动力学产物物-紫罗兰酮;紫罗兰酮;l 如用强酸如浓硫酸和在较剧烈条件下处理,则得热力学产物如用强酸如浓硫酸和在较剧烈条件下处理,则得热力学产物-紫罗兰酮。紫罗兰酮。l -紫罗兰酮用于香料,紫罗兰酮用于香料,-紫罗兰酮用于合成维生素紫罗兰酮用于合成维生素A。 - -紫罗兰酮紫罗兰酮
42、 酮自身缩合困难,一般较难进行,只有丙酮在氢氧化酮自身缩合困难,一般较难进行,只有丙酮在氢氧化钡作用下,低产率得到缩合物钡作用下,低产率得到缩合物羟基酮。羟基酮。 但但二酮化合物二酮化合物可进行可进行分子内羟酮缩合分子内羟酮缩合,是目前合成环,是目前合成环状化合物的一种方法。状化合物的一种方法。例如:例如: 1957年,美国西北大学的年,美国西北大学的H.E. Zimmerman 和和M.D. Traxler 提出了著名的六元环过渡态模型。该模型提出了著名的六元环过渡态模型。该模型首次从立体化学角度对羟醛反应进行了剖析,指出首次从立体化学角度对羟醛反应进行了剖析,指出了烯醇盐构型与产物立体化学
43、之间的对应关系,成了烯醇盐构型与产物立体化学之间的对应关系,成为羟醛反应历史上的第一个理论突破。为羟醛反应历史上的第一个理论突破。羟醛缩合的立体化学羟醛缩合的立体化学六元环过渡态模型六元环过渡态模型 烯醇盐的顺反异构烯醇盐的顺反异构 碳负离子的共振结构中烯醇或烯醇盐相当于烯烃的衍碳负离子的共振结构中烯醇或烯醇盐相当于烯烃的衍生物,所以存在顺反异构体。一般用生物,所以存在顺反异构体。一般用E来表示反式,来表示反式,Z来表示顺式。见图:来表示顺式。见图: 不过这个命名法与烯烃体系有所区别,只要是羰基氧烯不过这个命名法与烯烃体系有所区别,只要是羰基氧烯醇化后与双键另一端的大基团处在一端的都认为是顺式
44、,醇化后与双键另一端的大基团处在一端的都认为是顺式,而与另一个而与另一个R,的基团大小优先原则无关。比如:的基团大小优先原则无关。比如:Z型(顺式)型(顺式) 羟醛反应产生两个手性中心羟醛反应产生两个手性中心, 根据排列组合,两根据排列组合,两个手性碳两两组合可以生成四种产物个手性碳两两组合可以生成四种产物,包括两种包括两种顺式顺式(syn)产物和两种产物和两种反式反式(anti)产物产物:烯醇盐构型对产物构型的影响烯醇盐构型对产物构型的影响 一般而言,产物两个手性碳原子结构的顺反问题受烯一般而言,产物两个手性碳原子结构的顺反问题受烯醇盐构型制约。醇盐构型制约。E-型的烯醇盐生成反式羟醛,型的
45、烯醇盐生成反式羟醛,Z-型的型的生成顺式。生成顺式。 运用建立在环己烷上的构象分析可以看出,醛分子在运用建立在环己烷上的构象分析可以看出,醛分子在受烯醇进攻时其主要姿势是:使羰基两侧较大的取代受烯醇进攻时其主要姿势是:使羰基两侧较大的取代基处在相当于环己烷平伏键的位置,基处在相当于环己烷平伏键的位置,E型烯醇式加成时型烯醇式加成时环状过渡态环状过渡态R基处于平伏键,过渡态的能量小,因而基处于平伏键,过渡态的能量小,因而也最容易形成,从而导致相应立体构型的产物占优势。也最容易形成,从而导致相应立体构型的产物占优势。 通过选择不同的碱和路易斯酸催化剂,可以有效地产生通过选择不同的碱和路易斯酸催化剂
46、,可以有效地产生97%以上的单一烯醇盐。以上的单一烯醇盐。 使用小位阻硬路易斯酸使用小位阻硬路易斯酸Bu2BOTf和大位阻碱和大位阻碱DIPEA有利于有利于生成顺式烯醇盐;生成顺式烯醇盐; 反之,大位阻软路易斯酸反之,大位阻软路易斯酸Chx2BCl和小位阻碱的搭配则有和小位阻碱的搭配则有利于生成反式烯醇盐。见下图:利于生成反式烯醇盐。见下图: 受碳负离子进攻的羰基化合物的活性顺序为:受碳负离子进攻的羰基化合物的活性顺序为:ROHROCH3ROCH2RROCHRRCHOCCH3OCC(CH3)3OROHArOHCH3CHO CH3CH=CHCHOOH2C-Y 醛酮与含活泼亚甲基的化合物如乙酰乙酸
47、乙酯、丙醛酮与含活泼亚甲基的化合物如乙酰乙酸乙酯、丙二酸等在有机碱胺催化下缩合成二酸等在有机碱胺催化下缩合成,-不饱和酸或酯等化不饱和酸或酯等化合物的反应。合物的反应。 E.Knoevenagel于于1896年发现水杨醛与含有活年发现水杨醛与含有活性亚甲基的醋酸衍生物在胺类存在下反应,可以性亚甲基的醋酸衍生物在胺类存在下反应,可以得到香豆素的初级衍生物。得到香豆素的初级衍生物。用克脑文盖尔反应合成香豆素类化合物用克脑文盖尔反应合成香豆素类化合物 香豆素:香料,用于定香剂、增香剂。香豆素:香料,用于定香剂、增香剂。抗凝血剂,香豆素类药物是维生素抗凝血剂,香豆素类药物是维生素K的的拮抗剂。香豆素最
48、早于拮抗剂。香豆素最早于1820年由年由Vogel从薰香豆中用乙醇萃取分离取得,现在从薰香豆中用乙醇萃取分离取得,现在已可人工合成。已可人工合成。CHOOH+H2CCOOC2H5COOC2H5OCOOEtO香豆素香豆素-3-羧酸乙酯。羧酸乙酯。 3. Mannich反应反应 有活泼氢的化合物有活泼氢的化合物(醛、酮、酯醛、酮、酯)和醛及胺和醛及胺进行缩合反应,结果活泼氢被胺甲基取代进行缩合反应,结果活泼氢被胺甲基取代胺甲基化反应,也叫迈尼许(胺甲基化反应,也叫迈尼许(Mannich)反应。反应。反应模式:反应模式:机理:R2NH + COHHR2NCHHOHH+R2NCHHOH2+R2N+CH
49、2亚胺离子CH3CCH3O H+CH3COHCHCH2=N+R2CH3COCH2CH2NR2+ H+含活泼氢的化合物:醛,酮,酸,酯都可以。 甲醛先与胺缩合成亚胺盐,后者再与醛酮的烯醇甲醛先与胺缩合成亚胺盐,后者再与醛酮的烯醇式起缩合反应。式起缩合反应。COCH3+ HCHO +NaOHCOCH2NHN合成实例:合成实例:-环已基环已基-苯基苯基-哌啶基哌啶基-丙醇盐酸盐丙醇盐酸盐(苯海索盐酸盐)的制备(苯海索盐酸盐)的制备苯海索盐酸盐:苯海索盐酸盐:为医用中枢性抗胆碱药,主要用于抗震为医用中枢性抗胆碱药,主要用于抗震颤麻痹症,颤麻痹症,对帕金森病及帕金森综合征有治疗作用,目对帕金森病及帕金森
50、综合征有治疗作用,目前为左旋多巴的辅助治疗剂。前为左旋多巴的辅助治疗剂。ClMg , Et2O40, 2hHClH2OC CH2CH2OHNHCll最常见含有最常见含有活泼氢类化合物是酮类活泼氢类化合物是酮类;l胺类中叔胺和芳胺不起反应,胺类中叔胺和芳胺不起反应,使用最方便的是仲胺使用最方便的是仲胺,如二甲胺、二羟乙基胺等;如二甲胺、二羟乙基胺等;l使用最多的醛是甲醛使用最多的醛是甲醛;l由于由于 氨基酮容易发生消除,取代等反应,所以氨基酮容易发生消除,取代等反应,所以Mannich反应在有机合成中有广泛的应用。例如,反应在有机合成中有广泛的应用。例如, , 不饱和酮的制备,可卡因合成都用到此
51、反应。不饱和酮的制备,可卡因合成都用到此反应。l可卡因:古柯树中提取,天然的中枢神经兴奋剂,古老的可卡因:古柯树中提取,天然的中枢神经兴奋剂,古老的麻醉药。麻醉药。1917年,年,Robinson只用两步合成颠茄酮,产率只用两步合成颠茄酮,产率90。 颠茄酮,又叫脱品酮,颠茄酮,又叫脱品酮,一种生物碱,从颠茄草中获得,一种生物碱,从颠茄草中获得,也可合成。具有镇痛,解痉挛的疗效,可用作胃肠解痉药;也可合成。具有镇痛,解痉挛的疗效,可用作胃肠解痉药;麻醉前给药;扩大瞳孔药;抢救有机磷中毒药。麻醉前给药;扩大瞳孔药;抢救有机磷中毒药。“著名著名”的颠茄酮的合成:的颠茄酮的合成:NCH3O1903年
52、德国年德国RWillstatter以环庚酮为原料经系列合成得颠茄酮:以环庚酮为原料经系列合成得颠茄酮:合成经合成经Hoffman彻底甲基化、双键加溴、二甲胺取代、消除等十五步,彻底甲基化、双键加溴、二甲胺取代、消除等十五步,由于反应繁多,反应的总收率仅为由于反应繁多,反应的总收率仅为0.75%。 4. Claisen酯缩合反应酯缩合反应 酯分子中的酯分子中的-活泼氢在醇钠的催化作用下,活泼氢在醇钠的催化作用下,可与另一分子酯脱去一分子醇而互相缩合,这类可与另一分子酯脱去一分子醇而互相缩合,这类反应称为反应称为Claisen Condensation反应。反应。反应历程反应历程 酯的酯的 -H与
53、醛酮的与醛酮的 -H相似呈酸性,可被碱打掉,形成相似呈酸性,可被碱打掉,形成负碳,然后去进攻另一分子的羰基,先亲核加成,后消去负碳,然后去进攻另一分子的羰基,先亲核加成,后消去(脱去一分子醇),形成(脱去一分子醇),形成 -羰基酯。羰基酯。碳负离子生成碳负离子生成亲核加成亲核加成烷氧基离去烷氧基离去碳负离子生成碳负离子生成亲核加成亲核加成烷氧基离去烷氧基离去 反应类型反应类型l分子之间缩合称为分子之间缩合称为克莱森(克莱森(Claisen)酯缩合反应。酯缩合反应。同种酯缩合同种酯缩合.交叉酯缩合交叉酯缩合 两种不同的有两种不同的有-H的酯的缩合产物复杂,无实用价值。的酯的缩合产物复杂,无实用价
54、值。无无-H的酯与有的酯与有-H的酯的缩合产物纯,有合成价值。的酯的缩合产物纯,有合成价值。 常见无常见无-H的酯:苯甲酸酯、甲酸酯、乙二酸酯和碳的酯:苯甲酸酯、甲酸酯、乙二酸酯和碳酸酯。酸酯。H COOC2H5+ CH3CH2COOC2H5C2H5ONaH COCHCOOC2H5CH3酯类化合物也能与腈或酮发生缩合反应酯类化合物也能与腈或酮发生缩合反应酮与酯进行缩合得到酮与酯进行缩合得到-羰基酮。羰基酮。 己二酸和庚二酸酯在强碱的作用下发生分子内酯缩合,生己二酸和庚二酸酯在强碱的作用下发生分子内酯缩合,生成环酮衍生物的反应称为成环酮衍生物的反应称为狄克曼(狄克曼(Dieckmann)反应。反
55、应。分子内酯缩合分子内酯缩合Dieckmann反应。反应。Dieckmann反应是合成五元和六元碳环的重要方法反应是合成五元和六元碳环的重要方法。 缩合产物经酸性水解生成缩合产物经酸性水解生成-羰基酸,羰基酸,-羰基酸受热易脱羧,羰基酸受热易脱羧,最后产物是环酮。最后产物是环酮。COOC2H5COOC2H5C2H5ONaCOOC2H5OCOOC2H5OCH3即碱催化时,取代基少的即碱催化时,取代基少的- -碳上的氢活性大些。碳上的氢活性大些。 5. Darzen反应反应 醛酮在强碱的作用下,和醛酮在强碱的作用下,和-卤代酸酯反应,缩合生卤代酸酯反应,缩合生成成,-环氧羧酸酯,进一步生成环氧羧酸
56、酯,进一步生成-取代醛取代醛达赞达赞(Darzen)反应。)反应。ClCH2COOCH3NaNH2ClCH-COOCH3CR1R2O+ClCH-COOCH3CR1R1HCOCOOCH3Darzen反应机理:反应机理:最后生成在原羰基碳上增加一个碳的醛。最后生成在原羰基碳上增加一个碳的醛。 卤代羧酸酯在碱的作用下,形成碳负离子(卤代羧酸酯在碱的作用下,形成碳负离子(i) ,(i)与醛或酮的羰基亲核加成,得到烷氧负离子()与醛或酮的羰基亲核加成,得到烷氧负离子(ii),),(ii)氧上的负电荷进攻)氧上的负电荷进攻碳,卤离子离去,形成碳,卤离子离去,形成,环氧羧酸酯(环氧羧酸酯(iii)()(ii
57、i)在很温和的条件下水解得到酸,酸易失去二氧化碳,变成烯醇,再互变)在很温和的条件下水解得到酸,酸易失去二氧化碳,变成烯醇,再互变异构为醛或酮。异构为醛或酮。 ClCH2COOC2H5ClC-HCOOC2H5RONaR1R2OR1CO-R2CHCH2OOC2H5ClOCCHCOOC2H5R1R21)OH-2)H+R1R2C=CHOHOCCHR1R2OHCO-CO2(ii)()()苯乙酮合成苯乙酮合成2-苯基丙醛苯基丙醛合成实例:(合成实例:(-甲氧基甲氧基-萘基)甲基脱水甘油酸萘基)甲基脱水甘油酸 甲酯的制备甲酯的制备本品为消炎镇痛药萘普生的中间体本品为消炎镇痛药萘普生的中间体 在生产维生素在
58、生产维生素A时,开始的原料就是用时,开始的原料就是用-紫罗兰酮和氯乙酸甲酯,进行达参反应,得到紫罗兰酮和氯乙酸甲酯,进行达参反应,得到一个一个14碳醛,产率为碳醛,产率为78 6.迈克尔迈克尔(Michael)加成反应加成反应 在碱性催化剂的作用下,活泼亚甲基与在碱性催化剂的作用下,活泼亚甲基与,不饱和不饱和醛、酮、酯或羧酸衍生物的碳碳双键发生亲核加成,生成醛、酮、酯或羧酸衍生物的碳碳双键发生亲核加成,生成1,5二羰基化合物二羰基化合物的反应,称为的反应,称为Michael反应反应,这也是活泼,这也是活泼亚甲基化合物进行烷基化的另一种途径。亚甲基化合物进行烷基化的另一种途径。 H2CCHCOR
59、N u :取代基对活性双键的活化能力的大小次序:取代基对活性双键的活化能力的大小次序:CHOCORCOORCNNO2-二酮、苯乙腈、乙酰乙酸乙酯和丙二酸二乙酯等二酮、苯乙腈、乙酰乙酸乙酯和丙二酸二乙酯等在碱性催化剂的存在下都能与双键起加成反应:在碱性催化剂的存在下都能与双键起加成反应:反应机理:反应机理:CH2(CO2Et)2+CH(CO2Et)2+EtOH-EtOOCHCHCH2+CH(CO2Et)2-OCHCHCH2CH(CO2Et)2-OCHCHCH2CH(CO2Et)2-OCHCH2CH2CH(CO2Et)2+-EtO1,4-加成加成OCH CH CH2CH(CO2Et)2-OCH C
60、H CH2 H+O CHCH2CH2CH(CO2Et)2可简单地认为:可简单地认为:OOCH2CHCO2Et+EtONa, EtOHOOCH2CH2CO2Et例:例:OCH2CH2COCH3CH3OCH3OHO+CH3HCH2CHCOCH3EtONa, EtOHMichael反应后在六元环系的基础上,再加上四个碳原子,形成反应后在六元环系的基础上,再加上四个碳原子,形成一个二并六元环化合物一个二并六元环化合物鲁宾逊(鲁宾逊(Robinson)增环反应)增环反应(Michael+Aldol) 。CH2CN+CH2CHCNKOHCHCH2CH2CNCNO+CH2COOEtCOOEtC2H5O-OC
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 低价转让转租合同范本
- 公共广播合同范本
- 饭店供应食品合同范本
- 早餐摊位加工合同范本
- 个人煤炭求购合同范本
- 彩钢瓦喷漆翻新合同范本
- 厨房线路改造合同范本
- 装饰工程佣金合同范本
- 2025标准商业租赁合同
- 2025建筑工程的设备采购合同范本
- 应急预案编制计划再改样本
- 中医治疗失眠课件
- 2022年河南工业和信息化职业学院单招面试题库及答案解析
- 聚焦核心素养《义务教育数学新课程标准》2022年小学数学新课标解读课件
- 教师资格证《小池》说课夏东
- 期末复习:苏教版四年级下《劳动与技术》含答案
- 接触网施工-接触网竣工验收
- 《脏之将军-肝》课件
- 黑龙江省哈尔滨市香坊区2023-2024学年八年级上学期期末数学试题
- GB/Z 43281-2023即时检验(POCT)设备监督员和操作员指南
- 主动披露报告表

评论
0/150
提交评论