



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、第第3 3章章 络合滴定法络合滴定法3.1 概述概述3.2 配位平衡配位平衡3.3 配位滴定基本原理配位滴定基本原理3.4 混合离子的选择性滴定混合离子的选择性滴定3.5 配位滴定的方式和应用配位滴定的方式和应用3 .1配位滴定法概述配位滴定法概述 配位滴定法配位滴定法以配位反应为基础的滴定方法以配位反应为基础的滴定方法。 例如,水样中例如,水样中CN的测定,以的测定,以AgNO3为标准溶液:为标准溶液: 2CN + Ag+ = Ag(CN)2 终点:终点:Ag(CN)2 + Ag+ = AgAg(CN)2(白色白色) 在配位滴定中,能用于此类滴定的无机配合物的在配位滴定中,能用于此类滴定的无
2、机配合物的 反应反应并不多,其原因为:并不多,其原因为: (1)配合物稳定性不高;)配合物稳定性不高; (2)存在分级配合。)存在分级配合。配位滴定反应,必须具备下列条件配位滴定反应,必须具备下列条件: Cd(CN)+ Cd(CN)2 Cd(CN)3 Cd(CN)42 K1=3.02105 K2=1.38105 K3=3. 63104 K4=3.8105 K相差很小,配位比难以确定,相差很小,配位比难以确定, 滴定终点难以判断。滴定终点难以判断。 1)形成的配合物要相当稳定,使配位反应能进行)形成的配合物要相当稳定,使配位反应能进行完全;完全; 2)在一定的条件下,配位数必须固定;)在一定的条
3、件下,配位数必须固定; 3)配位反应速度要快;)配位反应速度要快; 4)要有适当的指示终点的方法。)要有适当的指示终点的方法。H6Y2+H5Y+H4YH3Y-H2Y2-HY3-Y4-pKa1=0.9pKa2=1.6pKa3=2.07pKa4=2.75pKa5=6.24pKa6=10.343.1.1 EDTA的酸性的酸性六元酸六元酸HOOCH2CNHCH2COO-CH2COOHNHCH2CH2-OOCH2C+0.00.20.40.60.81.002468101214pH分布系数H2Y 2-HY 3-Y 4-H4YH3Y -H5Y +H6Y 2+分布分数分布分数3.1.2 EDTA的配位性质的配位
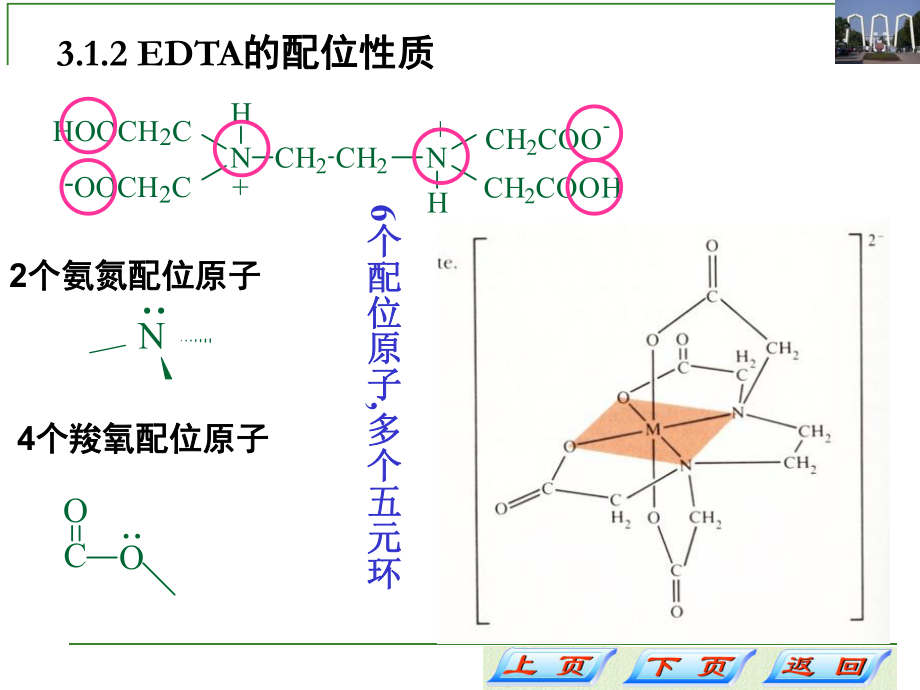
4、性质HOOCH2CNHCH2COO-CH2COOHNHCH2CH2-OOCH2C+2个氨氮配位原子个氨氮配位原子N.4个羧氧配位原子个羧氧配位原子OCO.6个配位原子个配位原子,多个五元环多个五元环某些金属离子与某些金属离子与EDTA的形成常数的形成常数lgKlgKlgKlgK Na+ 1.66Mg2+ 8.69Ca2+ 10.69Fe2+ 14.33La3+ 15.50Al3+ 16.30Zn2+ 16.50Cd2+ 16.46Pb2+ 18.04Cu2+ 18.80Hg2+ 21.8Th4+ 23.2Fe3+ 25.1Bi3+ 27.94ZrO2+ 29.93.1.3 EDTA及其二钠盐的
5、溶解度及其二钠盐的溶解度型体溶解度 (22 C)H4Y0.2 g / LNa2H2Y111 g / L, 0.3 mol /L 大多数的配合物稳定大多数的配合物稳定3.1.4 EDTA与金属离子形成的配合物的特点与金属离子形成的配合物的特点 EDTA具有广泛的配位性具有广泛的配位性 大多数形成大多数形成1:1的螯合物的螯合物M + Y = MY M可以是二价,三价,四价可以是二价,三价,四价 无色的金属离子形成的配合物无色;无色的金属离子形成的配合物无色;有色的金属离子形成的配合物颜色加深有色的金属离子形成的配合物颜色加深. EDTA配合物易溶于水。配合物易溶于水。多配位金属络合物多配位金属络
6、合物 2+2+331Cu+NH =CuNHK 2+333 22CuNH +NH =Cu(NH )K 2+2+3 233 33Cu( NH )+NH =Cu(NH )K 2+2+3 333 44Cu( NH )+NH =Cu(NH )K络合物的逐级稳定常数络合物的逐级稳定常数 Ki=K1MLML=nnnK-1ML MLL=K22ML MLL11 nK=K不不 稳稳 121nKK不不 稳稳 11nKK不不 稳稳 K 表示相邻络合物之间的关系表示相邻络合物之间的关系M + L = MLML + L = ML2MLn-1 + L = MLn(1)1niiKK 不 稳通 式 5.2.2 累积稳定常数累积
7、稳定常数 =11MLMLK ML = 1 M L1222ML MLMLMLLK K ML2 = 2 M L2 12ML MLnnnnK KK MLn = n M Ln=22ML ML重要公式重要公式 表示各级络合物与配体之间表示各级络合物与配体之间的关系。的关系。各级络合物的分布分数(或摩尔分数)nMnLML多元多元络合物络合物分布分数定义分布分数定义MML)ML(cxiii 据物料据物料平衡:平衡:ML.MLMLM2Mnc 2M12MMMLL.MLnncM1M 1Lniiic()MMMML L(1L )L(1L)iiiiiiiiiic),()ML(iiiLfx ),(pHKfai 比较酸的分
8、布分数:比较酸的分布分数:例题已知乙二胺(已知乙二胺(L)与与Ag+形成的络合物形成的络合物lg 1 和和lg 2分别为分别为4.7, 7.7。当当AgL为最大值时的为最大值时的pL为多少?;为多少?;AgL2为主要型体时的为主要型体时的pL范围是多少?范围是多少?解:解:7 . 4lglg11K0 . 37 . 47 . 7lglglg122KK0.00.20.40.60.81.00123456pL分布系数52218 . 30 . 320 . 37 . 4lg2lglgpLKKK1)AgL最大时,最大时,2)AgL2存在的主要范围,存在的主要范围,0 . 3lgpL2KlgK1 lgK2内在
9、因素内在因素金属离子的本身的性质金属离子的本身的性质配位剂的性质配位剂的性质外在因素外在因素酸度酸度 其它配位剂其它配位剂 共存(干扰)金属离子共存(干扰)金属离子 羟基配位羟基配位5.3 影响影响EDTA配合物稳定性的主要因素配合物稳定性的主要因素副反应系数副反应系数把主要考察的一种反应看作主反应,其它与之有关的反把主要考察的一种反应看作主反应,其它与之有关的反应看作应看作副反应副反应。副反应影响主反应中的反应物或生成物。副反应影响主反应中的反应物或生成物的平衡浓度。副反应进行的程度可由的平衡浓度。副反应进行的程度可由副反应系数副反应系数显示。显示。M+YMYOH-LH+NH+OH-M (O
10、H)MLHYNYMHYMOHYM (OH)n.ML2MLnH2YH6Y羟羟基基配配位位 效效应应辅辅助助配配位位 效效应应酸酸效效应应 共共存存离离子子 效效应应混混合合离离子子 效效应应主主反反应应副副反反应应M (OH)2使主反应受影响,平衡向左移动,使主反应受影响,平衡向左移动,MY 稳定性降低稳定性降低平衡向右移动,平衡向右移动,MY 稳稳 定性增加,但很小。定性增加,但很小。由于由于H+ 的存在,使配位体的存在,使配位体Y参加参加 主反应的能力降低的现象。主反应的能力降低的现象。M+YMYH+HY.H2YH6Y(1) 酸效应及酸效应系数酸效应及酸效应系数Y(H)65432YYHYHY
11、HYHYHHYY=酸效应酸效应 YYEDTA平衡浓度的总浓度未参加配位反应的=Y(H)将将Ka1,Ka2,Ka3,Ka4,Ka5,Ka6,分别代入上式中,得分别代入上式中,得pH愈大,愈大,lgY(H)或或Y(H)越小,酸的副反应越小,越小,酸的副反应越小, 既酸效应越小,配合物越稳定。既酸效应越小,配合物越稳定。 1) Y(H) 随溶液的酸度增加而增大,随溶液的随溶液的酸度增加而增大,随溶液的pH增增大而减少;大而减少; 2) Y(H) 越大,副反应越严重;越大,副反应越严重; 3) 通常通常 Y(H) 1,YY。当当Y(H)=1时,时, Y=Y;4) Y(H) =1 / Y261261H
12、H H Y(H)456356261aaaaaaKKKHKKHKH1234566aaaaaaKKKKKKH=+M+YMYNNY(2) 共存离子效应及共存离子效应系数共存离子效应及共存离子效应系数Y(N)由于其它金属离子的存在,使配位由于其它金属离子的存在,使配位 体体Y参加主反应的能力降低的现象。参加主反应的能力降低的现象。共存离子效应共存离子效应1 NKYYNYYYNYY(N)=NYNYKNY = EDTA的总副反应系数的总副反应系数YY(N)=+Y Y + HY +. H6Y + NY Y =Y(H)+1例:在例:在pH = 1.5 溶液中,含有浓度约为溶液中,含有浓度约为0.010 M F
13、e3+、Ca2+,当用同浓度的当用同浓度的EDTA滴定滴定Fe3+ 时,时,计算计算Y 。 解:查表解:查表5.1得得 logKCaY = 10.69 已知已知pH = 1.5时,查表时,查表5. 2得得 logY(H) = 15.5 Y(Ca) = 1 + KCaY Ca2+ = 1 + 1010.690.010 = 108.69 Y =Y(H) + Y(N) 1 = 1015.5 + 108.69 1忽略忽略 = 1015.5 主要影响为主要影响为酸效应酸效应由于由于L的影响,使的影响,使M参加主参加主反应的能力降低的现象。反应的能力降低的现象。5.3.2 金属离子的副反应及副反应系数(金
14、属离子的副反应及副反应系数(M)(1) 辅助配位效应及辅助配位效应系数辅助配位效应及辅助配位效应系数M(L)辅助配位效应辅助配位效应M+YMYLML.ML2MLn MMEDATA平衡浓度度配位的金属离子的总浓未与 M + ML +.+ MLn M =M(L)=MLn = n M Ln M(L)越大,M越小,即副反应越严重;M(L)与游离的L有关; 若没有其它配位剂L存在,M=M,M(L) =1。将各级稳定常数将各级稳定常数K代入上式中,得代入上式中,得=1 + K1 L + K1K2 L 2 +K1K2.Kn L nM(L)+=.1 +12 n L L 2 L n+(2) 羟基配位效应及羟基配
15、位效应系数羟基配位效应及羟基配位效应系数M(OH)M+YMYOH-M (OH)M (OH)n.M (OH)2.M(OH) M + MOH +.+ M(OH)n M = M(OH)2 +.1 +12 n+ OH - OH- 2OH- n+=由于由于OH- 的存在,使的存在,使金属离子金属离子M参加主反应的参加主反应的能力降低的现象。能力降低的现象。羟基配位效应羟基配位效应(水解效应水解效应)(3) 金属离子总的副反应系数金属离子总的副反应系数M =M+ MOH +.+ M(OH)n M =. M + ML + MLn + MOH +.+ M(OH)n M .+ M + ML + MLn M M
16、=M(L)M(OH)+M(L)M(OH)+-1-例:在例:在0.010 mol / L 锌氨溶液中,当游离氨的浓度为锌氨溶液中,当游离氨的浓度为0.10 mol / L 时,计算时,计算pH = 10;pH = 12锌离子的总副锌离子的总副反应系数反应系数Zn 。解:解:(1)pH = 10 ,Zn(OH)= 102.4Zn NH3的的log1 4 分别为:分别为:2.37、4.81、7.31、9.46。Zn(NH3)= 1 +1 NH3 +2 NH3 2 +3NH3 3 +4 NH3 4 = 1 + 10(2.371) +10(4.812)+10(7.313)+10(9.464) = 105
17、.49Zn =Zn(NH3)+Zn(OH)1 = 105.49 + 102.41 = 105.49(2)pH = 12 ,Zn(OH)= 108.5Zn =Zn(NH3)+Zn(OH)1 = 105.49 + 108.51 = 108.5忽略忽略忽略忽略副反应系数小结副反应系数小结 EDTA的副反应的副反应Y = YYM= MM 共存离子效应系数共存离子效应系数: Y (N) = 1+K NY N 酸效应系数酸效应系数 Y (H) : 1 / ,查表查表金属离子金属离子(M)的副反应的副反应辅助配位效应效应系数辅助配位效应效应系数: M (L) 羟基配位效应系数羟基配位效应系数 M (OH)
18、:查表查表=.1 +12 n L L 2 L n+=Y(H) +Y(N) 1M(OH) +M(L) 15.3.3 条件稳定常数条件稳定常数KMY绝对稳定常数绝对稳定常数:条件稳定常数条件稳定常数:lg KMY = lg KMYlgM lgYKMY =MYMYK MY =MYMYY = YYY = Y YM= MMM = M MK MY =MYMM YY =KMYMY5.3 络合滴定的基本原理络合滴定的基本原理5.3.1 滴定曲线滴定曲线5.3.2 金属指示剂金属指示剂5.3.3 终点误差与可行性判断终点误差与可行性判断5.3.4 单一离子滴定的酸度控制单一离子滴定的酸度控制5.3.1 滴定曲线
19、滴定曲线滴定过程中金属离子浓度的变化规律滴定过程中金属离子浓度的变化规律以以0.0100 molL EDTA 滴定滴定20.00 mL 0.01000molL Ca2+ 溶液(在溶液(在NH3 - NH4+ 缓冲溶液,缓冲溶液,pH=10)为例。为例。lgKCaY =10.69, pH=10,lgY(H) = 0.45 只有只有 酸效应酸效应lgKCaY =10.690.45 = 10.42KCaY =1.71010Ca2+ = 0.01000molL pCa = -lg 0.010 = 2.00(2)滴定开始至化学计量点前)滴定开始至化学计量点前总体积VVcCaCaCa2+ =加入加入19.
20、98mL EDTA, 20.00 Ca2+余余0.02mL6100 . 598.1900.2002. 0010. 0Ca2+ =mol / LpCa = 5.30(1)滴定前)滴定前(3)化学计量点)化学计量点Ca2+ + Y= CaY3100 . 500.2000.2000.20010. 0CaY=3100 . 52010. 0CaY=离解平衡:离解平衡:CaY = Ca2+ + YCa2+ = Y7103104 . 5107 . 1100 . 5CaYKCaY=Ca2+ pCasp=6.30或或(4)化学计量点后)化学计量点后总体积VcVYEDTA)( 加入加入20.02mL EDTA,过
21、量过量0.02ml6100 . 502.2000.2002. 0010. 0 Y 2YCaCaYKCaY810632109 . 5107 . 1100 . 5100 . 5 CaYKYCaYCapCa= 7.23突跃:突跃:pCa = 5.307.23影响突跃的因素影响突跃的因素(1)pHpH值越高,突跃越大,反之则小。值越高,突跃越大,反之则小。 pH决定突跃范围的决定突跃范围的上限上限。(2)金属离子的浓度)金属离子的浓度浓度大,突跃大,反之则小,浓度大,突跃大,反之则小, 金属离子的浓度决定突跃的金属离子的浓度决定突跃的下限下限。(3)KMYKMY 越大,突跃越大。越大,突跃越大。 KM
22、Y 决定突跃决定突跃上限上限。pH值越高,值越高,突跃越大,突跃越大,反之则小;反之则小;pH决定突跃决定突跃范围的范围的 上限。上限。金属离子的浓度金属离子的浓度 决定突跃的决定突跃的下限下限。浓度大,突跃大,浓度大,突跃大,反之则小;反之则小;KMY 越大,突跃越大;越大,突跃越大;KMY决定突跃决定突跃上限上限。 (a) 是一类有机配位剂是一类有机配位剂, 也是弱酸。也是弱酸。 (b) 与金属离子形成的配合物的颜色与指示剂本身与金属离子形成的配合物的颜色与指示剂本身的颜色显著不同。的颜色显著不同。 (c) 因是弱酸因是弱酸, 存在酸式色和碱式色。存在酸式色和碱式色。1) 金属指示剂特点:
23、金属指示剂特点:5.3.2 金属指示剂金属指示剂2) 金属指示剂的显色原理金属指示剂的显色原理滴定前加入指示剂滴定前加入指示剂In +MMIn 游离态颜色游离态颜色络合物颜色络合物颜色滴定开始至终点前滴定开始至终点前终点终点Y + MIn MY + In MY无色或浅色无色或浅色游离态颜色游离态颜色络合物颜色络合物颜色金属指示剂金属指示剂必备条件必备条件颜色的变化要敏锐颜色的变化要敏锐KMIn 要适当,要适当,KMIn KMY反应要快,可逆性要好。反应要快,可逆性要好。Y + M MY MY无色或浅色无色或浅色MIn形成背景颜色形成背景颜色MIn应易溶于水。应易溶于水。常用的金属指示剂常用的金
24、属指示剂指示剂指示剂 pH 范范围围颜色变化颜色变化InMIn直接被测定的离子直接被测定的离子铬黑铬黑TEBT810蓝蓝 红红pH=10, Mg2+,Zn2+,Cd2+,Pb2+ , Mn2+ ,稀土元素离子稀土元素离子钙指示剂钙指示剂 1213 蓝蓝 红红 pH=1213 Ca2+酸性铬蓝酸性铬蓝K 813 蓝蓝 红红 pH=10,Mg2+, Zn2+,Mn2 + pH=13,Ca2+ PAN 212 黄黄 紫红紫红 pH=23,Th4+,.Bi3+pH=45, Cu2+,Ni2+ ,Pb2+, .Cd2+,Zn2+, Mn2+,Fe2+ 二甲酚橙二甲酚橙 6 亮黄亮黄 红红 pH1,ZrO
25、2+, pH 1- 3.5 Bi3+.Th4+ pH56,Tl3+.Zn2+ Pb2+.Cd2+.Hg2+稀土元素离子稀土元素离子XO4) 指示剂的封闭现象、僵化现象及其消除方法指示剂的封闭现象、僵化现象及其消除方法(1) 指示剂的封闭现象:终点时,看不到颜色变化。指示剂的封闭现象:终点时,看不到颜色变化。MIn+Y = MY+In反应不能向右进行,不能发反应不能向右进行,不能发 生置换反应,看不到终点。生置换反应,看不到终点。 产生的原因产生的原因(a)溶液中某些干扰离子溶液中某些干扰离子的存在,与指示剂形成很稳的存在,与指示剂形成很稳定的配合物,不能被定的配合物,不能被EDTA破坏。破坏。
26、N + In NIn(b)不可逆反应所致不可逆反应所致M + In MIn消除的方法消除的方法a)加入掩蔽剂,消除加入掩蔽剂,消除干扰离子的影响。干扰离子的影响。b)若是被测金属离子产若是被测金属离子产 生的封闭现象,采用返生的封闭现象,采用返滴定法滴定法 例如测定水的硬度例如测定水的硬度取水样100mL三乙醇胺NH4ClNH3pH = 10红色蓝色EBTEDTA滴定以以EBT为指示剂,为指示剂,pH=10,滴定滴定Ca2+、Mg2+时,时, Fe3+、Al3+、Co2+、Ni2+对指示剂有封闭作用,对指示剂有封闭作用,加入三乙醇胺掩蔽加入三乙醇胺掩蔽Fe3+、Al3+,加入加入KCN(或或N
27、a2S),),掩蔽掩蔽Co2+、Ni2+,消除干扰:消除干扰:(2) 指示剂的僵化现象指示剂的僵化现象终点时颜色变色缓慢,终点时颜色变色缓慢, 出现终点拖长的现象。出现终点拖长的现象。 产生的原因:产生的原因: MIn形成胶体或沉淀形成胶体或沉淀 消除的方法:消除的方法: 加入有机溶剂(乙醇);加入有机溶剂(乙醇); 加热;加热; 用力振摇。用力振摇。金属指示剂的选择金属指示剂的选择金属指示剂的选择原则:金属指示剂的选择原则: 指示剂能在滴定突跃范指示剂能在滴定突跃范 围内变色,尽量使指示围内变色,尽量使指示 剂变色点的剂变色点的pMep与计量与计量 点的点的pMsp值一致。值一致。在实际工作
28、中,由于金在实际工作中,由于金 属指示剂的有关常数不属指示剂的有关常数不 很齐全,故大多采用实很齐全,故大多采用实 验方法进行选择。验方法进行选择。4.3.3 终点误差与可行性判断终点误差与可行性判断化学计量点化学计量点 spspYM化学计量点后化学计量点后 epepYM epepYYM过, epeptM epM spYMYECC过终点误差终点误差如果用如果用pM表示表示EP和和SP之间的之间的pM差值,经推导后,计算公式为:差值,经推导后,计算公式为:pMpMspM1010100%tMYEC K接近化学计量接近化学计量点,点,Csp Cep滴定终点和化学计量点的滴定终点和化学计量点的pM不完
29、全相同不完全相同终点误差终点误差林邦林邦(Ringbom)误差公式误差公式误差公式的应用误差公式的应用可行性的判断可行性的判断用络合滴定法测定时所需的条件,也取决于允许的误差用络合滴定法测定时所需的条件,也取决于允许的误差(Et)和检测终点的准确度(和检测终点的准确度( pM)。)。目测确定终点:目测确定终点: pM = 0.2 0.5, 以以 pM = 0.2 为例为例M,splg( )4CK0.20.2410101%10tEM,splg( )6CK0.1%tE 同理同理M,splg( )8CK0.01%tE 则准确滴定的条件:则准确滴定的条件:M,splg( )CK6当当5.3.4 单一离
30、子滴定的酸度控制单一离子滴定的酸度控制 lgcM KMY6 对单一离子的滴定,副反应只有络合剂的酸效应和金属对单一离子的滴定,副反应只有络合剂的酸效应和金属离子羟基配位效应。离子羟基配位效应。lgKMY=lg KMY-lgM(OH)- lgY(H)(1) 最高酸度:最高酸度: 在高酸度时,在高酸度时,M(OHM(OH) )可忽略可忽略,lgY(H) =lg KMY- lgKMY lg Y(H) lgKMY lgc 6在在pMpM0.20.2,相对误差相对误差TETE0.10.1时,由终点误时,由终点误差公式得差公式得准确滴定单一金属离子的判别式:准确滴定单一金属离子的判别式:最低酸度:最低酸度
31、:水解酸度水解酸度金属离子都有水解的倾向,所以,在最高酸度允许值下,金属离子都有水解的倾向,所以,在最高酸度允许值下,只要金属离子不发生水解或形成只要金属离子不发生水解或形成M(OH)n ,就可进行滴定。就可进行滴定。因此,一般通过金属离子氢氧化物的溶度积因此,一般通过金属离子氢氧化物的溶度积(Ksp) 来求最低来求最低酸度。酸度。spOH MnK 10 -15.3- 6.8-1-210OH =mol L2 10例例 Ksp(Zn(OH)2)=10-15.3即即 pH7.2? 可在可在pH10的氨性缓冲液中用的氨性缓冲液中用Zn2+标定标定EDTA例例:用用0.02mol/LEDTA滴定滴定0
32、.02mol/L Fe3+ 溶液,计溶液,计算适宜的酸度范围。算适宜的酸度范围。解解: (1) 求最高酸度求最高酸度lg(c.KFeY) 6 得:得:lgY(H) =25.12817.1查表得到最高酸度:查表得到最高酸度: pH=1.2要使要使EDTA的酸效应不影响滴定,必须满足:的酸效应不影响滴定,必须满足:由由 lg Y(H) lgKMY lgc 6(2) 求最低酸度求最低酸度若若pH值太高,则值太高,则Fe3+会发生水解,所以只要会发生水解,所以只要将将Fe3+不发生水解的最高不发生水解的最高pH值求出即可。值求出即可。 Fe3+3OH-Fe(OH)3 Ksp=10-37.4337.41
33、1.93310100.02FeKspOHc pH=14.0-11.9=2.1所以,滴定所以,滴定Fe3+的适宜酸度范围为的适宜酸度范围为pH1.22.1最低酸度最低酸度最高酸度最高酸度 pHL 适宜酸度适宜酸度 pHH 但滴定终点误差还与指示剂的变色点有关,即但滴定终点误差还与指示剂的变色点有关,即与与 pM有关,这就有一个有关,这就有一个最佳酸度最佳酸度的问题。的问题。pH0从滴定反应本身考虑,滴定的适宜酸度是处于滴定的最从滴定反应本身考虑,滴定的适宜酸度是处于滴定的最高酸度与最低酸度之间,即在这区间,有足够大的条件高酸度与最低酸度之间,即在这区间,有足够大的条件稳定常数,稳定常数,KMY。
34、金属离子滴定的适宜酸度金属离子滴定的适宜酸度络合滴定中缓冲溶液的使用络合滴定中广泛使用络合滴定中广泛使用pH缓冲溶液,这是由于:缓冲溶液,这是由于:(1)滴定过程中的)滴定过程中的H+变化:变化:M + H2Y = MY + 2H+(2)KMY与与KMIn均与均与pH有关;有关;(3)指示剂需要在一定的酸度介质中使用)指示剂需要在一定的酸度介质中使用 。络合滴定中常用的缓冲溶液络合滴定中常用的缓冲溶液pH 45 (弱酸性介质),弱酸性介质), HAc-NaAc, 六次甲基四胺缓冲溶液六次甲基四胺缓冲溶液pH 810 (弱碱性介质),弱碱性介质), 氨性缓冲溶液氨性缓冲溶液 pH 1, 强酸或强
35、碱自身缓冲体系强酸或强碱自身缓冲体系M, NKMY KNYKMY 12NaOHFe3+ - Mg2+Ca2+三乙醇胺钙指示剂Fe3+ - Mg(OH)2Ca2+三乙醇胺Al3+ - 三乙醇胺pH=12,消除消除Mg2+干扰干扰加沉淀剂,使干扰离子浓度降低,在不分离沉加沉淀剂,使干扰离子浓度降低,在不分离沉淀的情况下直接滴定,这种消除干扰的方法称淀的情况下直接滴定,这种消除干扰的方法称为沉淀掩蔽法。为沉淀掩蔽法。(3)氧化还原掩蔽法)氧化还原掩蔽法例:例: Bi3+、Fe3+共存时,共存时, 在在pH=1测定测定Bi3+, Fe+干扰。干扰。已知:已知: lgKBiY = 27.94 lgKFe
36、Y = 25.1 lgKFeY2 = 14.33设设 : Bi3+、Fe3+浓度相等浓度相等则则 lgKBiY lgK FeY 5 不能控制酸度进行滴定不能控制酸度进行滴定加入抗坏血酸或盐酸羟胺,加入抗坏血酸或盐酸羟胺, 使使Fe3+Fe2+,则则lgKBiYlgKFeY2+=13.61 5在抗坏血酸存在下,在抗坏血酸存在下, 可在可在pH=1时测定时测定Bi3+, 而而Fe3+不干扰。不干扰。利用氧化还原反应改变干扰离子的价态以消除干扰的利用氧化还原反应改变干扰离子的价态以消除干扰的方法,称为氧化还原掩蔽法方法,称为氧化还原掩蔽法。(4)解蔽法)解蔽法例:例:Cu2+、Zn2+、 Pb2+
37、共存溶液,测定共存溶液,测定Zn2+和和Pb 。Cu2+Cu(CN)4EDTACu(CN)4Zn2+Zn(CN)4Zn2+ZnYpb2+KCNpb2+pbYV2V1氨性滴定滴定酒石酸甲醛Cu(CN)4Zn(CN)4pbYEDTACu(CN)4pbY测定测定pb2+测定测定Zn2+先加络合掩蔽剂先加络合掩蔽剂L,使使N生成生成NL后,后, EDTA 准确滴准确滴定定M,再用再用X破坏破坏NL,从从NL 中将中将N释放出来,以释放出来,以EDTA再准确滴定再准确滴定N。X为解蔽剂。为解蔽剂。5.5.1 各种滴定方式各种滴定方式配位滴定的方式配位滴定的方式直接滴定法直接滴定法返滴定法返滴定法置换滴定
38、法置换滴定法间接滴定法间接滴定法5.5 配位滴定的方式和应用配位滴定的方式和应用1)直接滴定法直接滴定的条件:直接滴定的条件:(1)lg CK 6;(2)反应速度快:)反应速度快:(3)有合适的指示剂,无指示剂封闭现象;)有合适的指示剂,无指示剂封闭现象;(4)在控制的)在控制的pH条件下,条件下, 金属离子不发生水解;金属离子不发生水解;例:例: 在酸性介质中在酸性介质中 Zr2+, Th3+, Ti3+, Bi3+, 在弱酸性介质中在弱酸性介质中 Zn2+, Cu2+, Pb2+, Cd2+, 在氨性介质中在氨性介质中 Ca2+, Mg2+, 2)返滴定法例:例:Al3+的测定,的测定,
39、lg K = 16.1, 足够稳定,但由于足够稳定,但由于(1) Al3+与与EDTA的络合反应缓慢;的络合反应缓慢;(2) Al3+对二甲酚橙有封闭作用,缺乏合适的指示剂;对二甲酚橙有封闭作用,缺乏合适的指示剂;(3) Al3+易水解生成多核羟基化合物;易水解生成多核羟基化合物;故不能用故不能用EDTA进行直接滴定。进行直接滴定。Al3+ + Y = AlY + Y ( 过量)过量) Zn2+ZnYEDTAAlZnnnn返滴定中应注意的问题返滴定中应注意的问题(1)热力学条件)热力学条件MYNYlglgKK若用若用N作为返滴定剂作为返滴定剂,要求要求:否则会发生置换反应否则会发生置换反应MY
40、 + N = NY + M(2)动力学条件)动力学条件AlYZnYlg16.1lg16.5KK由于由于Al3+与与EDTA的反应缓慢,的反应缓慢,且逆向反应同样是缓慢的,即,且逆向反应同样是缓慢的,即,AlY 一旦形成就很稳定,故实一旦形成就很稳定,故实际上可用际上可用Zn2+作返滴定剂。作返滴定剂。3)置换滴定法a)置换出金属离子置换出金属离子例:例:Ag+的测定的测定AgYlg7.3K若若 C(Ag+ ) = 0.01 mol /L,那么那么lg()6cK难以直接滴定。一般采用的方案是难以直接滴定。一般采用的方案是22422AgNi(CN)2Ag(CN)NiNi2+ + Y 4- NiY
41、2-pH = 10紫尿酸胺紫尿酸胺EDTANinnAgEDTA2nnAgNi2nnb) 置换出置换出EDTA例:复杂铝试样的测定例:复杂铝试样的测定Al3+ Mn+pH = 35 过量过量EDTAAlYMYY 过量过量+ZnYZn2+pH 56NH4FAlF6MY+YZnYZn2+pH 56AlZnnnc)改善指示剂的性能改善指示剂的性能例:例: EDTA 滴定滴定Ca2+, EBT +MgY 作指示剂。作指示剂。CaInlg5.4KMgInlg7.4KCaYlg10.7KMgYlg8.7KMgY +EBT + Ca2+蓝色蓝色 无色无色滴定前,加入指示剂:滴定前,加入指示剂:终点时:终点时:
42、Mg-EBT+ YMg-EBT+ CaY MgY + EBT红色红色4)间接滴定法222622KK NaCo(NO ) .6H OCo 溶解例:钾盐的测定例:钾盐的测定EDTA2CoCoY EDTAK2nn5.5.2 配位滴定法的应用配位滴定法的应用(1) 水中总硬度的测定水中总硬度的测定硬度硬度暂时硬度暂时硬度永久硬度永久硬度Ca(HCO3)2 Mg(HCO3)2CaCO3 MgCO3 CaCl2 ,CaSO4 , MgCl2 , MgSO4 不能不能 除去除去硬度的单位硬度的单位CaO mg / L ,CaCO3 mg / L 度度10mg CaO / L = 1度度取水样100mL三乙醇胺NH3pH = 10红色蓝色EBTEDTA滴定-NH4Cl(2) 锅炉水中锅炉水中Ca2+ ,Mg2+ ,Fe3+ ,Cl的测定的测定Ca2+ ,Mg2+ ,Fe3+的测定的测定 试液pH = 1-2,
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 职业健康促进服务供给侧改革与可持续发展
- 职业健康中的人机环境评估
- 黔西南2025年贵州黔西南高新区实验中学临聘教师招聘12人笔试历年参考题库附带答案详解
- 西双版纳2025年云南西双版纳勐海县党政储备人才专项招引18人笔试历年参考题库附带答案详解
- 肇庆2025年广东肇庆市高要区教育局招聘中小学教师59人笔试历年参考题库附带答案详解
- 河池2025年广西河池市南丹县参加2025届河池学院毕业生双选会招聘22人笔试历年参考题库附带答案详解
- 榆林2025年陕西榆林市榆阳区招聘编外学科教师和教辅人员389人笔试历年参考题库附带答案详解
- 张家界2025年湖南张家界市桑植县职业中等专业学校选调笔试历年参考题库附带答案详解
- 山西2025年山西农业大学软件学院招聘人事代理人员10人笔试历年参考题库附带答案详解
- 宁波浙江宁波一院龙山医院医疗健康集团(慈溪市龙山医院)招聘4人笔试历年参考题库附带答案详解
- 2025年医疗器械收货与验收管理制度培训试题(附答案)
- 2025年急诊科面试常见问题及答案
- 北师大版初中九年级下册数学3.2圆的对称性课件
- 建筑起重司索信号工安全操作规程
- 青光眼病人的健康宣教
- 2024-2025学年天津市河西区七年级下英语期中考试题(含答案和音频)
- 商业地产运营管理手册
- 哈铁面试试题及答案
- 质量小品完整版本
- 《家禽的主要传染病》课件
- 试用期员工转正申请书(汇编15篇)

评论
0/150
提交评论