



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、第第 7 章章化学反应速率化学反应速率271 反应速率的定义反应速率的定义 72 反应速率与反应物浓度的关系反应速率与反应物浓度的关系73 反应机理反应机理74 反应物浓度与时间的关系反应物浓度与时间的关系75 反应速率理论简介反应速率理论简介76 温度对化学反应速率的影响温度对化学反应速率的影响77 催化剂与催化反应简介催化剂与催化反应简介7 1 反应速率的定义反应速率的定义 化学反应速率是指在一定条件下反应物转变为生成物化学反应速率是指在一定条件下反应物转变为生成物的速率。化学反应速率经常用单位时间内反应物浓度的减的速率。化学反应速率经常用单位时间内反应物浓度的减少或生成物浓度的增加表示。
2、少或生成物浓度的增加表示。单位:单位:moldm3s1 , moldm3min1或或 moldm3h1。 47 1 1 平均速率平均速率 例例7 71 1 乙酸乙酯的皂化反应乙酸乙酯的皂化反应 CH3COOC2H5 OH CH3COO CH3CH2OH式中的负号是为了使反应速率保持正值。式中的负号是为了使反应速率保持正值。 21OHOHOHOH() ()()() 21ccctttr562525(N O )(N O )ct r22(NONO)()ctrtc)O()O(22r2522(N O(NO(O111241)cccttt例例7 2 N2O5的分解反应的分解反应 2 N2O5 4 NO2 O2
3、252211(N O )(NO )(O )24或 rrr7对于一般的化学反应对于一般的化学反应 aA bB gG hH原则上,用任何一种反应物或生成物的浓度变化均可表示原则上,用任何一种反应物或生成物的浓度变化均可表示化学反应速率,但我们经常采用其浓度变化易于测量的那化学反应速率,但我们经常采用其浓度变化易于测量的那种物质来进行研究。种物质来进行研究。tctctctc)H(h1)G(g1)B(b1)A(a187 1 2 瞬时速率瞬时速率 瞬时速率:某一时刻的化学反应速率称为瞬时速率。瞬时速率:某一时刻的化学反应速率称为瞬时速率。AB的斜率表示时间间隔的斜率表示时间间隔 t tBtA 内反应的平
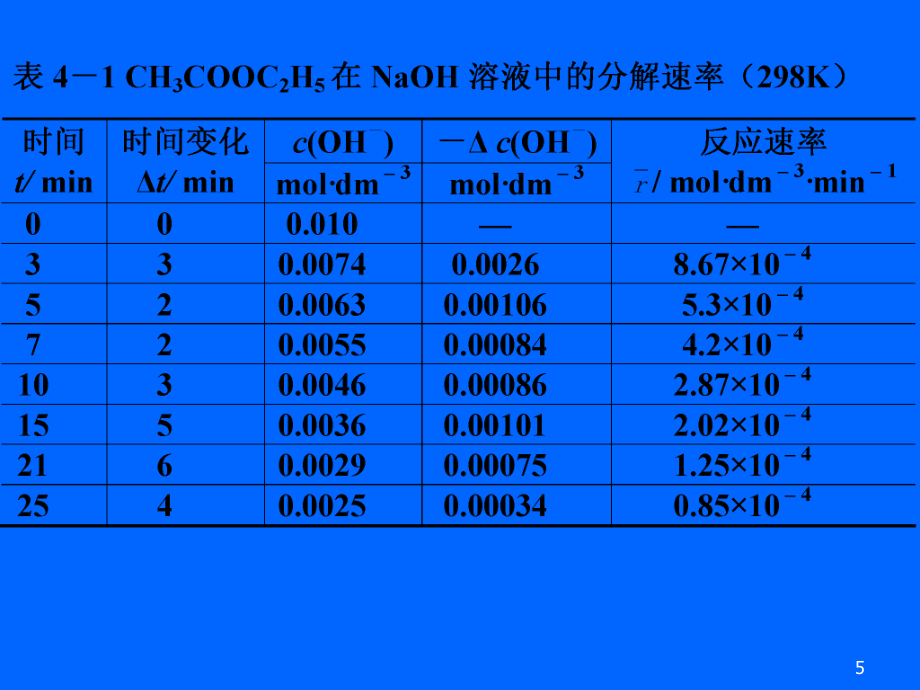
4、均速率内反应的平均速率 DEOHEF() rOHOH ()() dcdtr例例73 利用表中反应物的浓度对时间作图。利用表中反应物的浓度对时间作图。 972 反应速率与反应物浓度的关系反应速率与反应物浓度的关系实验事实表明,一定温实验事实表明,一定温度下,增加反应物的浓度下,增加反应物的浓度可以增大反应速率。度可以增大反应速率。从图中可观察从图中可观察0、5、10、15min时的各条切线,时的各条切线,看出它们的斜率所代表看出它们的斜率所代表的瞬时速率依次减小。的瞬时速率依次减小。 107 2 1 速率方程速率方程基元反应:指反应物分子一步直接生成产物的反应。基元反应:指反应物分子一步直接生成
5、产物的反应。 质量作用定律:基元反应的速率与反应物浓度以其质量作用定律:基元反应的速率与反应物浓度以其化学计量数为幂指数的连乘积成正比。化学计量数为幂指数的连乘积成正比。对于基元反应对于基元反应 a A b B g G h H质量作用定律的数学表达式:质量作用定律的数学表达式:r k c(A)m c(B) nk 称为速率常数称为速率常数m,n 称反应物称反应物A,B的反应级数的反应级数k,m和和n 均可由实验测得均可由实验测得1112解:对比实验解:对比实验 1,2,3,发现,发现 r c(H2)对比实验对比实验4,5,6,发现,发现,r c(NO) 2所以反应速率所以反应速率 r c(H2)
6、 c(NO) 2建立速率方程建立速率方程 r k c(H2) c(NO) 2利用实验数据得利用实验数据得 k 8.86 104 dm6 mol 2 s1在恒温下反应速率常数在恒温下反应速率常数k不因反应物浓度的改变而变化。不因反应物浓度的改变而变化。137 2 2 反应级数反应级数 若某化学反应若某化学反应 a A b B g G h H 其速率方程为其速率方程为 r k c(A ) m c(B) n 则反应级数为则反应级数为 m n 对于化学反应对于化学反应 2 H2 2 NO 2 H2O N2其速率方程为其速率方程为 r k c(H2) c(NO)2该反应是三级反应,或者说反应对该反应是三
7、级反应,或者说反应对H2是是1级,对级,对NO是是2级。级。14有的反应速率方程较复杂,不属于有的反应速率方程较复杂,不属于 r k c(A) m c(B) n 形式,对于这样的反应则不好谈反应级数。形式,对于这样的反应则不好谈反应级数。如如 H2 (g) Br2 (g) 2 HBr (g)的速率方程为:的速率方程为: )()(1)( )( 22/122BrHBrBrHcccckk 反应级数可以为零,也可以为分数。例如反应反应级数可以为零,也可以为分数。例如反应2 Na (s) 2 H2O 2 NaOH (aq) H2 (g)其速率方程为其速率方程为 r k零级反应的反应速率与反应物浓度无关。
8、零级反应的反应速率与反应物浓度无关。157 2 3 速率常数速率常数k化学反应速率常数化学反应速率常数k是在给定温度下,各反应物浓是在给定温度下,各反应物浓度皆为度皆为 1 moldm3时的反应速率,因此也称比速率常数。时的反应速率,因此也称比速率常数。速率常数是温度的函数。速率常数是温度的函数。速率常数的单位与反应级数有关:速率常数的单位与反应级数有关: 一级反应一级反应 s1 二级反应二级反应 dm3mol1s1 n级反应级反应 dm3(n1)mol1(n1)s116即不同的速率常数之比等于各物质的计量数之比。即不同的速率常数之比等于各物质的计量数之比。1111( )( )( )()r A
9、r Br Gr Habgh1111abghkkkkabgh用不同物质来表示反应速率时,速率常数的数值是用不同物质来表示反应速率时,速率常数的数值是不同的。例如反应不同的。例如反应 a A b B g G h H177 3 反应机理反应机理7 3 1 基元反应基元反应所谓基元反应是指反应物分子一步直接转化为产物所谓基元反应是指反应物分子一步直接转化为产物的反应。的反应。 如:如:NO2 CO NO CO2 反应物反应物NO2 分子和分子和CO分子经过一次碰撞就转变成为产物分子经过一次碰撞就转变成为产物NO分子和分子和CO2 。 基元反应是动力学研究中的最简单的反基元反应是动力学研究中的最简单的反
10、应,反应过程中没有任何中间产物。应,反应过程中没有任何中间产物。18又例如:又例如: H2 ( g ) I2 ( g ) 2 HI ( g )实验上或理论上都证明,它并不是一步完成的基元反应,实验上或理论上都证明,它并不是一步完成的基元反应,它的反应历程可能是如下两步基元反应:它的反应历程可能是如下两步基元反应: I2 I I (快)(快) H2 2 I 2 HI (慢)(慢) 化学反应的速率由反应速率慢的基元反应决定。化学反应的速率由反应速率慢的基元反应决定。 基元反应或复杂反应的基元步骤中发生反应所需要的微基元反应或复杂反应的基元步骤中发生反应所需要的微粒(分子、原子、离子)的数目一般称为
11、反应的分子数。粒(分子、原子、离子)的数目一般称为反应的分子数。19单分子反应单分子反应SO2Cl2 的分解反应的分解反应 SO2Cl2 SO2 Cl2双分子反应双分子反应NO2 的分解反应的分解反应 2 NO2 2 NO O2三分子反应三分子反应 HI 的生成反应的生成反应 H2 2 I 2 HI 四分子或更多分子碰撞而发生的反应尚未发现。四分子或更多分子碰撞而发生的反应尚未发现。207 3 2 反应机理的探讨反应机理的探讨反应反应 2 NO O2 2 NO2 实验得实验得 r k c(NO) 2 c(O2)设反应历程:设反应历程: 2 NO N2O2 (快)(快) N2O2 2 NO (快
12、)(快) N2O2 O2 2 NO2 (慢)(慢)是控速步骤,是控速步骤, 其速率方程为其速率方程为 r k3 c(N2O2 ) c(O2)因为有因为有 r1 r2 故有故有 k1 c(NO)2 k2 c(N2O2 )所以所以 c(N2O2 ) k1 / k2 c(NO) 2 可以推导出反应的总速率方程可以推导出反应的总速率方程 r k c(NO)2 c(O2)217 4 反应物浓度与时间的关系反应物浓度与时间的关系若零级反应若零级反应 A H c(A) c(A) 0 k t7 4 1 零级反应零级反应(A)dckdt反应物消耗一半所需的时间称为半衰期,用反应物消耗一半所需的时间称为半衰期,用
13、t1/2表示。表示。即零级反应的半衰期公式,即零级反应的半衰期公式,零级反应半衰期零级反应半衰期与速率常数与速率常数k和初始浓度和初始浓度c0 有关。有关。012(A)2ctk227 4 2 一级反应、二级反应和三级反应一级反应、二级反应和三级反应一级反应一级反应 SO2Cl2 SO2 Cl2 速率方程为速率方程为 dc/dt k c即:即:lnc lnc0 k t231002111kt tcckc122220011322 kt tcckc只有只有1种反应物的二级反应:种反应物的二级反应: 只有只有1种反应物的三级反应:种反应物的三级反应:247 5 反应速率理论简介反应速率理论简介 20世纪
14、,反应速率理论的研究取得了进展;世纪,反应速率理论的研究取得了进展; 1918年路易斯(年路易斯(Lewis)在气体分子运动论的基础上)在气体分子运动论的基础上提出的化学反应速率的碰撞理论;提出的化学反应速率的碰撞理论; 三十年代艾林(三十年代艾林(Eyring)等在量子力学和统计力学的)等在量子力学和统计力学的基础上提出的化学反应速率的过渡状态理论。基础上提出的化学反应速率的过渡状态理论。25 7 5 1 碰撞理论碰撞理论 碰撞理论认为:碰撞理论认为:反应物分子间的相互碰撞是反应进行反应物分子间的相互碰撞是反应进行的先决条件。反应物分子能量高;碰撞频率越大;碰撞方的先决条件。反应物分子能量高
15、;碰撞频率越大;碰撞方向有利;有效碰撞次数多,反应速率越大。向有利;有效碰撞次数多,反应速率越大。即即 Z*Z f P f 为能量因子为能量因子 ;RTEaef P为取向因子;为取向因子; P 取值在取值在1109之间。之间。Ea 称活化能,一般的化学反应称活化能,一般的化学反应 Ea 为几十到几百为几十到几百 kJmol1 。267 5 2 过渡状态理论过渡状态理论过渡状态理论认为:过渡状态理论认为:当两个具有足够能量的反应物当两个具有足够能量的反应物分子相互接近时,分子中的化学键要发生重排,即反应物分子相互接近时,分子中的化学键要发生重排,即反应物分子先形成活化配合物的中间过渡状态,活化配
16、合物能量分子先形成活化配合物的中间过渡状态,活化配合物能量很高,不稳定,它将分解部分形成反应产物。很高,不稳定,它将分解部分形成反应产物。该理论认为,活化配合物的浓度;活化配合物分解该理论认为,活化配合物的浓度;活化配合物分解成产物的几率;活化配合物分解成产物的速率均将影响化成产物的几率;活化配合物分解成产物的速率均将影响化学反应的速率。学反应的速率。27例如例如 反应反应 NO2 CO NO CO2 正反应活化能正反应活化能Ea 活化配合物的势能活化配合物的势能 反应物平均势能反应物平均势能逆反应活化能逆反应活化能Ea 活化配合物的势能活化配合物的势能 产物平均势能产物平均势能反应的热效应反
17、应的热效应 rHm Ea Ea28结论:结论:若正反应是放热反应,其逆反应必定吸热。不论是若正反应是放热反应,其逆反应必定吸热。不论是放热还是吸热反应,反应物必须先爬过一个能垒反应才能放热还是吸热反应,反应物必须先爬过一个能垒反应才能进行。进行。如果正反应是经过一步即可完成的反应,则其逆反如果正反应是经过一步即可完成的反应,则其逆反应也可经过一步完成,而且正逆两个反应经过同一个活化应也可经过一步完成,而且正逆两个反应经过同一个活化配合物中间体。这就是微观可逆性原理。配合物中间体。这就是微观可逆性原理。化学反应的热效应化学反应的热效应 rHm Ea Ea 当当 Ea Ea时,时, rHm 0 反
18、应吸热;反应吸热; 当当 Ea Ea时,时, rHm 0 反应放热。反应放热。297 6 温度对化学反应速率的影响温度对化学反应速率的影响过渡状态理论认为:过渡状态理论认为:在反应过程中反应物必须爬过一个能在反应过程中反应物必须爬过一个能垒才能进行。升高温度,反应物分子的平均能量提高,减垒才能进行。升高温度,反应物分子的平均能量提高,减小了活化能的值,反应速率加快。小了活化能的值,反应速率加快。碰撞理论认为:碰撞理论认为:温度高时分子运动速率增大,活化分子的温度高时分子运动速率增大,活化分子的百分数增加,有效碰撞的百分数增加,反应速率增大。百分数增加,有效碰撞的百分数增加,反应速率增大。301
19、899年年Arrhenius总结了大量实验事实,归纳出反应总结了大量实验事实,归纳出反应速率常数和温度的定量关系速率常数和温度的定量关系式中式中k为反应速率常数,为反应速率常数,Ea为活化能,为活化能,A为指前因子。为指前因子。aER TkA e通常温度升高,化学反应速率常数增加。通常温度升高,化学反应速率常数增加。2a12TTREkk11303.2lg1317 7 催化剂与催化反应简介催化剂与催化反应简介 H2 (g) 1/2 O2 (g) H2O (l) rG 237.1 kJmol1 H2 (g) O2 (g) H2O2 (l) rG 120.4 kJmol13/2H2 (g) 1/2
20、N2 (g) NH3 (g) rG16.4 kJmol1在热力学上看,均为常温常压下可以自发进行的的反应。在热力学上看,均为常温常压下可以自发进行的的反应。但是由于反应速率过慢,在通常的条件下不能得到人们所但是由于反应速率过慢,在通常的条件下不能得到人们所希望的希望的“反应反应 释放的能量和反应释放的能量和反应 、 的产物的产物”。32催化剂的作用机理改变反应历程催化剂的作用机理改变反应历程33 多相催化在化工生产和科学实验中最为常见。催化剂多相催化在化工生产和科学实验中最为常见。催化剂经常是固体,不论反应物为气体还是液体,反应都是在催经常是固体,不论反应物为气体还是液体,反应都是在催化剂表面
21、进行的。化剂表面进行的。 反应的主要步骤是:反应物分子扩散到固体催化剂表反应的主要步骤是:反应物分子扩散到固体催化剂表面并被吸附;被吸附在催化剂表面的反应物分子发生反应,面并被吸附;被吸附在催化剂表面的反应物分子发生反应,生成产物;产物物分子从固体催化剂表面脱附并扩散离开生成产物;产物物分子从固体催化剂表面脱附并扩散离开催化剂。催化剂。 化工生产中的合成氨反应,就是由被吸附在铁催化剂化工生产中的合成氨反应,就是由被吸附在铁催化剂表面上的表面上的N2 和和 H2完成的。生成的完成的。生成的NH3 分子解吸后扩散离分子解吸后扩散离开铁催化剂表面。开铁催化剂表面。34 酶催化反应广泛地存在于生物体内,蛋白质、脂肪和酶催化反应广泛地存在于生物体内,蛋白质、脂肪和碳水化合物的合成及分解均属此类反应。碳水化合物的合成及分解均属此类反应。 酶是生物体内反应的催化剂,酶本身就是一种蛋白
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025年度金融创新项目借款抵押合同范本
- 2025年度新型防火门采购及安装服务合同
- 二零二五年度高端品牌形象标志设计知识产权授权协议
- 二零二五年度大学生实习就业指导服务劳动合同
- 二零二五年度洗浴中心装修承揽合同
- 2025版工厂租赁安全协议责任书(含安全生产责任)
- 二零二五年度车辆无偿租赁包含保养维修服务合同
- 二零二五年度旅游度假村租赁合同范本
- 二零二五年度港口航道工程经济合同
- 二零二五年度城市绿化工程分包合同范本
- 多媒体互动展厅建设规划设计方案
- TCALC 003-2023 手术室患者人文关怀管理规范
- 复方氨基酸(19)丙谷二肽注射液-临床用药解读
- 微创外科进展课件
- 人教版小学英语PEP三至六年级单词默写纸(汉译英+英译汉)
- 甲状腺肿瘤消融治疗理论知识考核试题及答案
- 《手穴保健操》课件
- 广东省广州市白云区2023-2024学年九年级上学期期中物理试卷
- 造林(绿化)工期计划安排及保证措施
- 柴油MSDS-安全技术说明书
- 国际数学与科学教育评价新动向-例析TIMSS 2023的主要特点

评论
0/150
提交评论