



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、武汉长江工商学院生物酶工程技术论文院: 工学院 专业: 生物工程 年级: 10 题目: -淀粉酶的酶学性质研究学生: 学号: 指导教师: 职称: 2013年 06 月02日目 录摘 要3关键词3Abstract3Key words3前言31.材料与方法411材料与设备41.2绘制糖含量标准曲线4试剂配制4绘制糖含量标准曲线42.-淀粉酶酶学性质研究关键技术52.1 -淀粉酶最适温度研究关键技术52.2 -淀粉酶最适PH研究关键技术62.3-淀粉酶耐热性研究关键技术72.4-淀粉酶动力学常数(Km)测定研究82.5-淀粉酶相对分子质量测定研究93.结论10参考文献10-淀粉酶的酶学性质研究摘 要
2、:本实验通过研究-淀粉酶的酶学性质,利用淀粉酶水解还原糖,还原糖能使3,5-二硝基水杨酸还原,生成棕色的3-氨基-5硝基水杨酸。淀粉酶活力与还原糖的量成正比,用比色法测定淀粉酶作用于淀粉后生成的还原糖的量,以单位质量样品在一定时间内生成还原糖的量表示酶活力。酶的活性又同时受到温度、PH、激活剂抑制剂等的影响。设计单因素试验研究-淀粉酶的最适条件,采用SDS-PAGE法测定-淀粉酶相对分子质量,结果如下:最适温度为60,最适PH为7.5,耐热性较好,100时-淀粉酶仍有活力,动力学常数(Km)为3.8g/L。关键词:-淀粉酶 活力 温度 PH 耐热性 动力学常数 相对分子质量Enzymatic
3、Properties of Mesophilic -AmylaseAbstract:-Amylase was purified to electrophoretic homogeneity. The molecular weight ofthe purified -amylase is 58 kD. Its optimum pH value of is in the range from 5.5 to 6.5,and the optimum temperature is 60 .With in 24 h at room temperature 80% enzyme activity keeps
4、 in the pH range from 7.0 to 10.0. The most enzyme activity loseswithin 15 min at 55 . But, the enzyme would be stable for 1 h with the presence of 10 mmol/L Ca2+. EDTA inhibits the enzyme activity, while, Ca2+, Mn2+ and Co2+ ions are activators. Km and Vmax of -amylase to soluble starch is 4.33 g/L
5、 and 1.19 g/Lmin, respectively. The main hydrolysates to soluble starch are oligosaccharides and dextrin.Key words:Bacillus amyloliquefaciens;-amylase;purification;characterization property 前言: 淀粉酶是水解淀粉和糖原酶类的总称。-淀粉酶(-1,4-D-葡萄糖-葡萄糖苷水解酶),普遍分布在动物、植物和微生物中,是一种重要的淀粉水解酶。它以随机作用方式切断淀粉、糖原、寡聚糖或多聚糖分子内的-1,4葡萄糖苷键
6、,产生麦芽糖、低聚糖和葡萄糖。 不同来源的-淀粉酶的酶学性质和理化性质有一定的区别,它们的性质对其工业应用的影响也较大,在工业生产中要根据需要使用合适来源的酶,因此对淀粉酶性质的研究非常重要。本实验所使用的是由芽孢杆菌深层发酵提取而得到的-淀粉酶,是一种高效性的淀粉酶,具有较高的催化能力,可用于制备糊精、麦芽糖、葡萄糖等,其最适反应温度为50-75,最适PH范围为5.5-7.5,耐热性为在100仍有少量活性,动力学常数Km值为1.74g/L,采用SDS-PAGE法测定-淀粉酶相对分子质量。通过研究淀粉酶的性质,能使我们更好的了解它,并充分利用于工业生产、食品加工、医疗等产业。1.材料与方法11
7、材料与设备材料: -淀粉酶;可溶性淀粉,硫酸,葡萄糖(粉末),氢氧化钠(粉末),3,5-二硝基水杨酸,酒石酸钾钠,柠檬酸,柠檬酸钠,磷酸氢二钠,磷酸二氢钠,甘氨酸,考马斯亮蓝G-250,95%乙醇,85%磷酸主要仪器:试管,恒温水浴锅,722型分光光度计,分析天平,烧杯,容量瓶,具塞刻度试管,玻璃棒,移液管,胶头滴管,洗耳球,垂直板电泳槽,电炉11.2绘制糖含量标准曲线1.2.1试剂配制1)1%-淀粉酶液的配制2准确称取-淀粉酶0.5g,适量水溶解后定容至50 mL,即得1-淀粉酶液,放入冰箱中保存,用时需过滤。2)1%淀粉溶液准确称取可溶性淀粉0.5g,用适量蒸馏水溶解后沸水浴中煮沸3min
8、后定容至50ml,临用现配。3)3,5-二硝基水杨酸3精确称取3,5-二硝基水杨酸10g,溶于200ml 2mol/lNaOH溶液中,加入500 ml蒸馏水,再加入300g酒石酸钾钠,待溶解后用蒸馏水定容至1000ml,摇匀后分装至试剂瓶中冰箱中保存。4)0.1mol/l柠檬酸称取柠檬酸21.01g,用蒸馏水溶解并定容至1000ml。5)0.1mol/l柠檬酸钠称取柠檬酸钠29.41g,用蒸馏水溶解并定容至1000ml。6)0.1mol/l磷酸氢二钠4称取二水磷酸氢二钠35.61g,用蒸馏水溶解定容至1000ml。7)0.1mol/l磷酸二氢钠称取一水磷酸二氢钠27.6g,用蒸馏水溶解定容至1
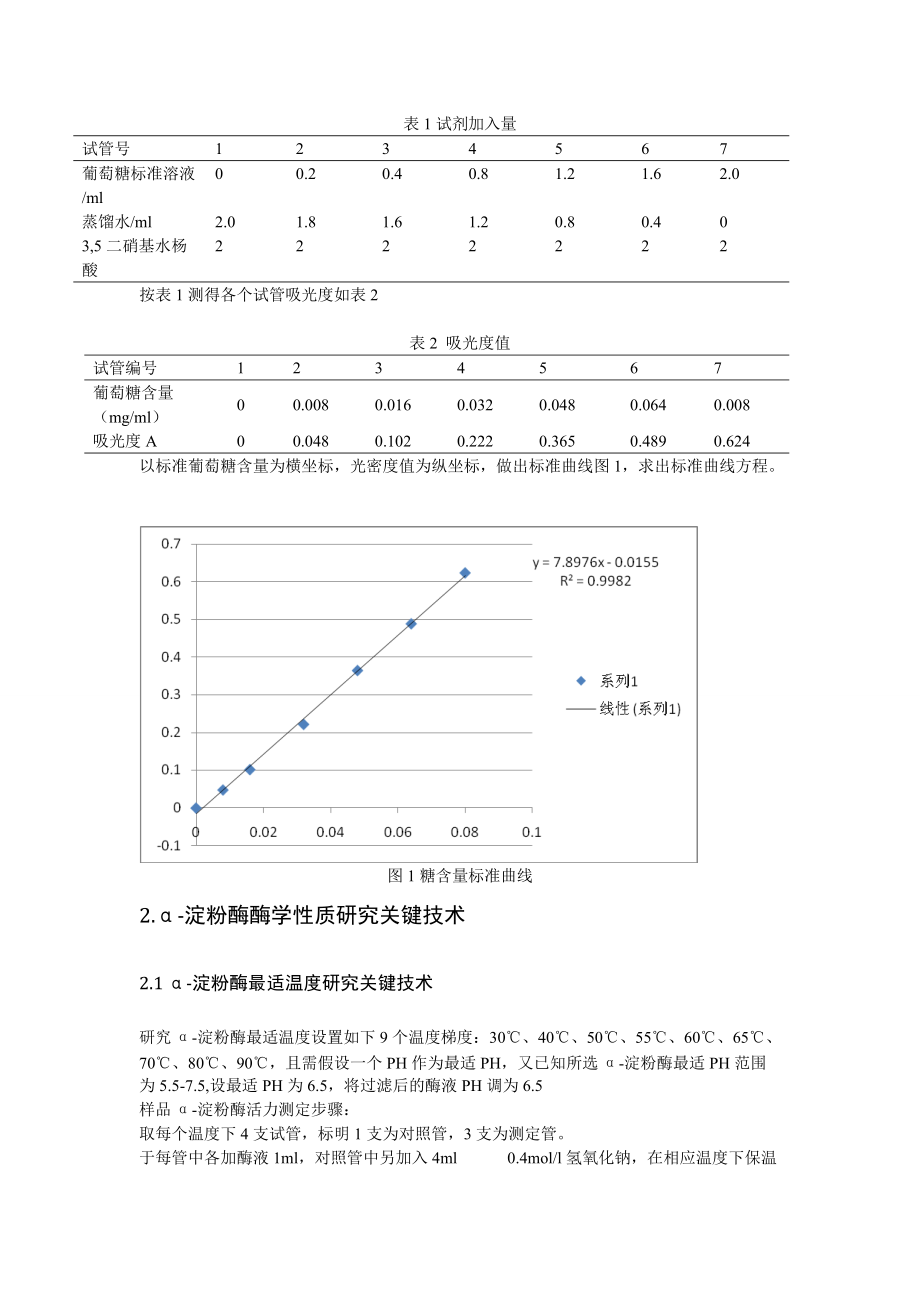
9、000ml。8)甘氨酸-氢氧化钠缓冲液(0.05mol/l)称取甘氨酸1.502g,用蒸馏水溶解定容至100ml,即为0.2mol/l甘氨酸。PH10.0 甘氨酸-氢氧化钠缓冲液,0.2mol/l甘氨酸,8ml 0.4mol/lNaOH加水稀释定容至100ml5。1.2.2绘制糖含量标准曲线 取7只干净的具塞刻度试管,编号,按下表加入试剂,混匀,置沸水浴中煮沸5min,取出后流水冷却,加蒸馏水定容至25ml。以1号管作为空白调零点,在540nm波长下比色测定5。以葡萄糖含量为横坐标,吸光度为纵坐标,绘制标准曲线6。表1试剂加入量试管号1234567葡萄糖标准溶液/ml00.20.40.81.2
10、1.62.0蒸馏水/ml2.01.81.61.20.80.403,5二硝基水杨酸2222222按表1测得各个试管吸光度如表2表2 吸光度值试管编号1234567葡萄糖含量(mg/ml)00.0080.0160.0320.0480.0640.008吸光度A00.0480.1020.2220.3650.4890.624以标准葡萄糖含量为横坐标,光密度值为纵坐标,做出标准曲线图1,求出标准曲线方程。图1糖含量标准曲线2.-淀粉酶酶学性质研究关键技术2.1 -淀粉酶最适温度研究关键技术研究-淀粉酶最适温度设置如下9个温度梯度:30、40、50、55、60、65、70、80、90,且需假设一个PH作为最
11、适PH,又已知所选-淀粉酶最适PH范围为5.5-7.5,设最适PH为6.5,将过滤后的酶液PH调为6.5样品-淀粉酶活力测定步骤:取每个温度下4支试管,标明1支为对照管,3支为测定管。于每管中各加酶液1ml,对照管中另加入4ml 0.4mol/l氢氧化钠,在相应温度下保温15min,再向各管分别加入对应温度下预热的1%淀粉溶液2ml,摇匀,立即放入对应温度恒温水浴,准确计时保温5min,取出后向测定管中迅速加入4ml 0.4mol/l氢氧化钠,终止酶活动,准备测糖7。样品的测定:取酶作用后的各管溶液2ml,分别放入相应的25ml具塞刻度试管中,各加入2ml 3,5-二硝基水杨酸试剂。以下操作同
12、标准曲线制作。根据样品比色吸光度,从标准曲线查出葡萄糖含量,最后进行结果计算。本实验设定60时在5min内水解淀粉释放1mg葡萄糖所需的酶量为1个酶活力单位(U)8。所测得的数据如下:表3 -淀粉酶最适温度研究温度304050556065708090对照管OD值0.3070.3020.2940.2820.2780.2940.2540.2430.217酶活力U4.14.354.7254.9755.6255.5255.254.9251.2酶活力计算公式:U=注:A测测量管对应吸光度;A对对照管对应吸光度;V酶反应体系总体积图2 温度对-淀粉酶活力的影响结论:由酶活力随温度变化而变化的趋势,得出酶反
13、应最适温度为60,在5570有较高活力,80以上活力较低9。2.2 -淀粉酶最适PH研究关键技术研究-淀粉酶最适PH设置如下9个PH梯度:3.0,4.0,5.6,6.0,6.5,7.0,7.5,8.0,10.0,同测最适温度一样需设定最适温度,根据所测最适温度为60,所以将恒温水浴设为60。准备PH缓冲液,PH7.0之前为柠檬酸-柠檬酸钠缓冲液,PH7.0至8.0为磷酸氢二钠-磷酸二氢钠缓冲液,PH10.0为甘氨酸缓冲液10。样品-淀粉酶活力测定步骤取每个温度下4支试管,标明1支为对照管,3支为测定管。于每管中各加酶液1ml,对应PH下的缓冲液1ml,对照管中另加入4ml 0.4mol/l氢氧
14、化钠,在相应温度下保温15min,再向各管分别加入对应温度下预热的1%淀粉溶液2ml,摇匀,立即放入对应温度恒温水浴,准确计时保温5min,取出后向测定管中迅速加入4ml 0.4mol/l氢氧化钠,终止酶活动,准备测糖。样品的测定:取酶作用后的各管溶液2ml,分别放入相应的25ml具塞刻度试管中,各加入2ml 3,5-二硝基水杨酸试剂。以下操作同标准曲线制作。根据样品比色吸光度,从标准曲线查出葡萄糖含量,最后进行结果计算11。表4 -淀粉酶最适PH研究PH3.04.05.66.06.57.07.58.010.0对照值OD0.2920.2930.2820.2790.2850.2900.2940.
15、3200.288酶活力U0.40.3251.0752.0251.856.0756.0255.0754.475酶活力计算公式:U=U=注:A测测量管对应吸光度;A对对照管对应吸光度;V酶反应体系总体积图3 缓冲液PH对-淀粉酶活力的影响结论:由酶活力随缓冲液PH变化而变化的趋势,得出酶反应最适PH为7.0,在pH7.010.0 有较高的活力12。2.3-淀粉酶耐热性研究关键技术研究-淀粉酶的耐热性温度设为如下7个温度:40,50,60,70,80,90, 100,最适PH设为6.5即将过滤后的酶液PH调为6.5,反应最适温度设为60。样品-淀粉酶活力测定步骤:取每个温度下4支试管,标明1支为对照
16、管,3支为测定管。于每管中各加酶液1ml,对照管中另加入4ml 0.4mol/l氢氧化钠,在相应耐热性温度下保温5min,再将试管取出放入60恒温水浴中保温15min,向各管分别加入60下预热的1%淀粉溶液2ml,摇匀,立即放入对应温度恒温水浴,准确计时保温5min,取出后向测定管中迅速加入4ml 0.4mol/l氢氧化钠,终止酶活动,准备测糖。样品的测定:取酶作用后的各管溶液2ml,分别放入相应的25ml具塞刻度试管中,各加入2ml 3,5-二硝基水杨酸试剂。以下操作同标准曲线制作。根据样品比色吸光度,从标准曲线查出葡萄糖含量,最后进行结果计算。所测得的数据如下:表5 -淀粉酶耐热性研究温度
17、405060708090100对照管OD0.2980.2290.1700.2560.2450.2180.170酶活力U5.2755.256.24.8754.654.80.65酶活力计算公式:U=U=注:A测测量管对应吸光度;A对对照管对应吸光度;V酶反应体系总体积图4 热处理温度研究耐热性对-淀粉酶活力的影响结论:由上表数据得出,在100时酶活力很低但还是有活力,说明100预热处理酶没有完全失活2.4-淀粉酶动力学常数(Km)测定研究实验步骤:4%淀粉溶液称取4g可溶性淀粉加适量水溶解,沸水浴中煮沸3mim,定容至100ml1%-淀粉酶液调节PH至6.5温度设置为恒温水浴60在不同底物( 可溶
18、性淀粉) 浓度的反应体系中,60反应5min,测定A540 以计算酶反应的初速度,以可溶性淀粉为底物,在pH6.5,温度60的条件下,取不同浓度的可溶性淀粉( S ) ,测得反应速度(V),得到1/V 与1/S的关系曲线13。表6 -淀粉酶动力学常数(Km)测定试管号123456酶液ml1.01.01.01.01.01.04%淀粉ml0.250.50.751.01.251.5蒸馏水ml1.751.51.251.00.750.5淀粉液溶度0.5%1.0%1.5%2.0%2.5%3.0%0.20.10.0670.50.40.30.680.890.720.490.460.36注: 4、5、6号测量管
19、在测定吸光度时大于1,故稀释了五倍。图5 动力学常数Km值测定曲线由标准曲线方程得:Km=g/L2.5-淀粉酶相对分子质量测定研究本研究采用SDS-PAGE法测定-淀粉酶相对分子质量实验方法与步骤如下: 安装垂直板电泳槽 配胶根据所测蛋白质相对分子质量范围,选择分离胶浓度 制备凝胶板10%分离胶制备、4%浓缩胶制备 样品处理及加样:取酶液与上样缓冲液1:1混合后沸水浴中煮沸3min 电泳 染色与脱色14原因分析如下:-淀粉酶可能没有浓缩好,且样品融解不佳或分离胶浓度过大引起的条带不清晰有拖尾和扩散现象。可以选择适当的样品缓冲液,加适量样品促溶剂;电泳缓冲液时间过长,重新配制;降低凝胶浓度。电泳
20、时间过长,可能由于凝胶缓冲系统和电级缓冲系统地pH选择错误,即缓冲系统地pH和被分离物质的等电点差别太小,或缓冲系统的离子强度太高。标准蛋白条带只有四条,可能是与缓冲液和分离胶的浓度有关,使蛋白未完全跑出。可以更换正确pH值的Buffer;适当降低分离胶的浓度15。3.结论 淀粉酶的最适温度在60,在5570有较高活力,80以上活力较低。最适作用pH 值7.0,在pH7.010.0 有较高的活力。在100时酶活力很低但还是有活力,说明100预热处理酶没有完全失活。通过测 淀粉酶动力学常数的Km=3.8g/L。采用SDS-PAGE法测定-淀粉酶相对分子质量,由于其它原因没有测出最终结果,原因在2.5已分析过,此处不再赘述。参考文献1柳辉,杨江科,闫云君.产-淀粉酶菌株的分离、鉴定及酶学性质研究J.生物技术,2007,17(2):34-37.2潘风光,刘海学,于师宇.重组耐高温-淀粉酶的分离纯化及其性质研究J.内蒙古民族大学学报:自然科学版,2007,22(1)43-47.3李辉,郭建强,岳丽丽,等.重组超耐热酸性-淀粉酶的分离纯化及其性质研究J.微生物学报,2005,45(4):547-550.4 韦平和. 生物化学
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025年高职设施农业工程技术(设施设计与建造)试题及答案
- 2025年高职(财务会计)固定资产核算阶段测试试题及答案
- 2026年职业兴趣综合测试(兴趣适配性评估)试题及答案
- 2025年中职社会保障事务(社保办理流程)试题及答案
- 2025 小学二年级科学下册学习养护多肉植物技巧课件
- 广告学专业就业趋势
- 政法暨安全生产讲解
- 2025河南洛阳市汝阳县审计局辅助性岗位招聘劳务派遣人员4人备考题库及参考答案详解
- 江西省宜春市高安市第九中学2025-2026学年上学期11月期中考七年级数学试题(含答案)
- 河南省濮阳市范县2024届高三下学期模拟测试(五)历史试题(含答案)
- 光纤激光打标机说明书
- 劳动者个人职业健康监护档案
- 《两角和与差的正弦、余弦、正切公式》示范公开课教学PPT课件【高中数学人教版】
- 治理现代化下的高校合同管理
- 境外宗教渗透与云南边疆民族地区意识形态安全研究
- GB/T 28920-2012教学实验用危险固体、液体的使用与保管
- GB/T 26389-2011衡器产品型号编制方法
- GB/T 16588-2009带传动工业用多楔带与带轮PH、PJ、PK、PL和PM型:尺寸
- 人大企业经济学考研真题-802经济学综合历年真题重点
- 建筑抗震鉴定标准课件
- 人教版二年级数学下册《【全册】完整版》优质课件

评论
0/150
提交评论