



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、“铝三角”的图像分析及计算一、镁、铝的工业制法1、镁的工业制法:(从海水中提取镁)盐酸 石灰 Mg(OH)2 海水过滤2、铝的工业制法:(以铝土矿为原料)除杂质 熔融、电解 铝土矿 AlO 23 冰晶石作熔剂 MgCl2 电解 熔融 Mg Al二、铝三角及应用1、三角关系:Al3+、Al(OH)3与AlO2相互转化的关系3+过量OH OH H + 过量HOHAl(OH)3 AlO2 H+有关离子方程式:A、Al3+与AlO2的相互转化Al3+AlO2:AlO2Al3+: B、AlO2与Al(OH)3的相互转化AlO2Al(OH)3: Al(OH)3AlO2:C、Al3+与Al(OH)3的相互转
2、化Al(OH)3Al3+: Al3+Al(OH)3:2、铝三角的应用制取Al(OH)3Al3+ + 3NH3H2O = Al(OH)3+3NH4+(常用方法)AlO2 + CO2 + 2H2O = Al(OH)3+ CO32离子共存问题:a、Al3+与OH、S2、AlO2 、HCO3、CO32、HSO32等离子因生成沉淀或双水解而不能大量共存; b、AlO2与Al3+、H+、NH+、Fe3+等离子因生成沉淀或双水解反应而不能大量共存。三、铝的化合物的有关图象1、向AlCl3溶液中逐滴滴入NaOH溶液至过量(如图) 有关反应:Al3+ + 3OH = Al(OH)3 Al(OH)3 + OH =
3、 AlO2 + 2H2O 现象:先产生白色沉淀,后沉淀逐渐消失2、向AlCl3溶液中逐滴滴入氨水至过量(如图)有关反应:Al3+ + 3NH3H2O = Al(OH)3 +3NH4+现象:产生白色沉淀,继续加氨水,沉淀不消失。3、向NaOH溶液中逐滴滴入AlCl3溶液至过量(如图) 有关反应:Al3+ + 4OH = AlO2 + 2H2O Al3+ +3 AlO2 + 6 H2O = 4Al(OH)3 现象:先无白色沉淀,后产生白色沉淀,继续滴加,沉淀不变化。5、向NaAlO2溶液中逐滴滴入AlCl3溶液至过量(如图)有关反应: Al3+ +3 AlO2 + 6 H2O = 4Al(OH)3
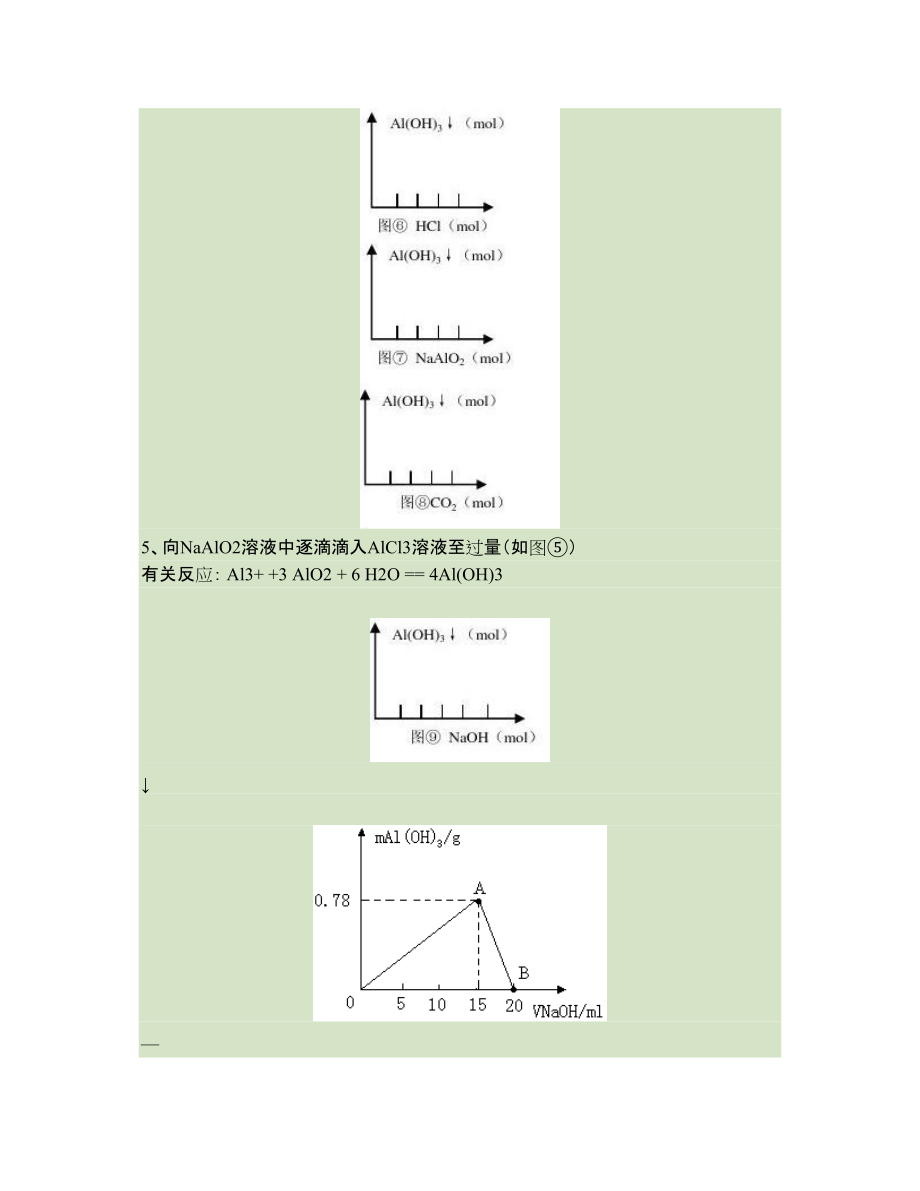
4、现象:产生白色沉淀,继续滴加,沉淀不变化。6、向NaAlO2溶液中逐滴滴入盐酸至过量(如图) 有关反应: AlO2+ H+ + H2O = Al(OH)3 Al(OH)3 + H+ = Al3+ +3 H2O现象:产生白色沉淀,继续滴加,沉淀消失。7、向盐酸中逐滴滴入NaAlO2溶液至过量(如图)有关反应: AlO2+ 4H+ = Al3+ +2 H2O Al3+ +3 AlO2 + 6 H2O = 4Al(OH)3 现象:先无白色沉淀,后产生白色沉淀,继续滴加,沉淀不变化。8、向NaAlO2溶液中通入过量的CO2(如图)有关反应: 2AlO2+ CO2 + 3H2O = 2Al(OH)3+
5、CO32 CO32 + CO2 + H2O = 2HCO3 现象:产生白色沉淀,继续通入CO2,沉淀不消失。9、向MgCl2、AlCl3和盐酸的混合液中滴加NaOH溶液至过量(如图) 有关反应: OH+ H+ = H2O Mg2+ + 2OH = Mg(OH)2 Al3+ + 3OH= Al(OH)3 Al(OH)3 + OH = AlO2 + 2H2O 现象:开始无沉淀,后产生白色沉淀,继续加入NaOH溶液,沉淀部分溶解。【典型例题】 向20mL某物质的量浓度的AlCl3溶液中滴入2mol/LNaOH溶液时,得到的Al(OH)3沉淀质量与所加NaOH溶液体积(mL)的关系如图所示,试回答下列
6、问题:(1)图中A点表示的意义是(2)图中B点表示的意义是(3)上述两步反应用总的离子方程式可表示为:(4)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH为 。【变式训练1】Al2(SO4)3和MgSO4混和,2 溶液的体积加适量水溶解,再加入KOH溶液,析出的沉淀量(W)与KOH溶液体积(V)的关系如图,则Al2(SO4)3和MgSO4的物质的量之比是A. 2:1 B. 1:2C. 1:1 D. 1:3【变式训练2】将一定质量的镁铝合金全部溶解在200mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得下图关系(1)求Mg、Al的质量各是多少?(2
7、)求盐酸的物质的量浓度为多少?【延伸拓展】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入4mol/L NaOH溶液,所加的NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。图中OC段没有沉淀生成,此阶段发生反应的离子方程式为:在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_。上述现象说明溶液中_离子结合OH-的能力最弱。B与A的差值为_ mol。B对应的沉淀量为_mol,C对应的溶液体积为_mL。【巩固练习
8、】1.在10mL含有AlO2-离子的溶液中逐滴加入1molL的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。问:(1)此溶液中同时含有_mol_离子;(2)线段AM表示的意义是,MN表示的意义是;(3)点M表示的意义是,点N表示的意义是 ;(4)C(或M)点的纵坐标为0.78,则c(AlO2-;(5)点B的横坐标为30,则到点N处滴入的HCl溶液体积为mL2.现有AlCl3和FeCl3的混合溶液,其中Al3+和Fe3+的物质的量之和为0.10mol,在此溶液中加入90 m L 4.0mol/L 的NaOH溶液,使其充分反应,设Al3+物质的量与总物质的量的比值为x。(1)根据反应的化学方程式计算x =0.4时,溶液中产生的沉淀是什么?物质的量是多少?(2)计算沉淀中只有Fe(OH)3的x的
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 干休所中医巡诊制度规范
- 如何规范村民议事会制度
- 路政大队档案管理制度
- 沉香木种植制度规范标准
- 办公室日常规范管理制度
- 幼儿园食品储存规范制度
- 司法鉴定人执业规范制度
- 消化科疾病防治规范制度
- 国企规范化经营管理制度
- 搅拌车行车制度规范标准
- 高级消防设施操作员试题及答案-3
- 反三违安全知识培训课件
- 2025年住院医师规培-广西-广西住院医师规培(骨科)历年参考题库含答案解析(5卷套题【单选100题】)
- 医院收费员个人年终总结范文(2篇)
- 肝性脑病的分级及护理
- 2025年中考数学二轮复习专题一 数与式中的化简与计算(含答案)
- T/CECS 10011-2022聚乙烯共混聚氯乙烯高性能双壁波纹管材
- GA/T 2157-2024毛细管电泳遗传分析仪
- 《胰高血糖素抵抗》课件
- 艾滋病实验室课件
- (高清版)AQ 1056-2008 煤矿通风能力核定标准

评论
0/150
提交评论