



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
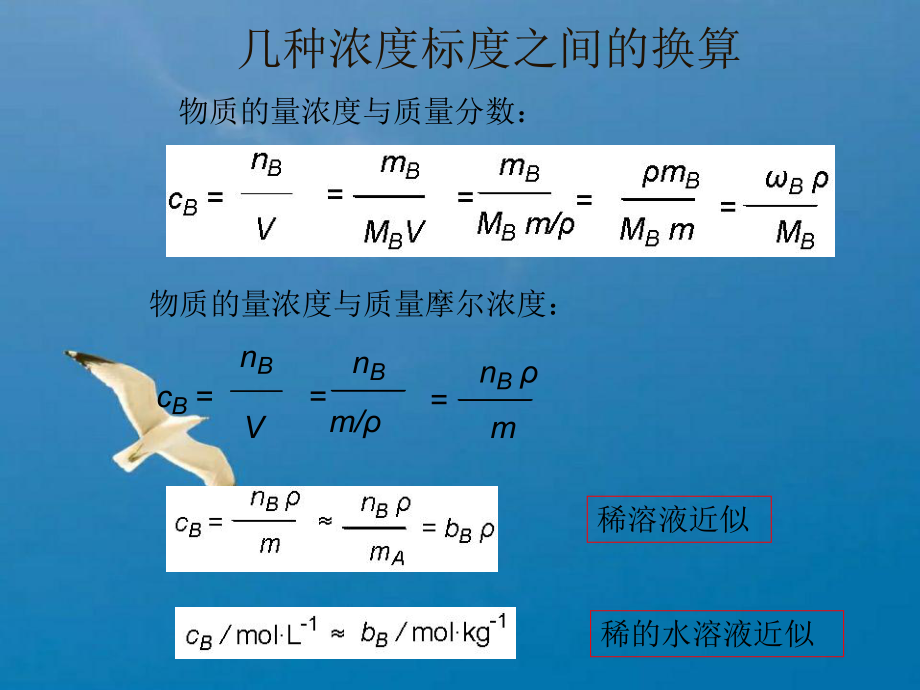
1、第一章第一章 气体、溶液和胶体气体、溶液和胶体 掌握溶液组成的标度掌握溶液组成的标度 掌握稀溶液的性质及其运用掌握稀溶液的性质及其运用 了解电解质溶液活度和离子强度的概念。了解电解质溶液活度和离子强度的概念。 了解理想气体的形状方程及其运用了解理想气体的形状方程及其运用 了解道尔顿分压定律了解道尔顿分压定律作业:作业:3, 4 , 6, 83. 当实验过程中温度有较明显的当实验过程中温度有较明显的变化时,运用变化时,运用 bB 还是还是 cB实实验误差更小些?验误差更小些?2. 实验时运用实验时运用bB 还是还是 cB更为方更为方便?便?第一节第一节 溶液溶液1.几种浓度标度之间的换算几种浓度
2、标度之间的换算几种浓度标度之间的换算物质的量浓度与质量分数:物质的量浓度与质量摩尔浓度:cB =nBV=nB m/=nB m稀溶液近似稀的水溶液近似一、分散系一、分散系分散质分散分散剂分散系固、液、气态分散系分散系一种或几种物质以细小的粒子分散在另一种物质里所构成的体系。分散质分散质被分散的物质。分散剂分散剂把分散质分散开来的物质。分散系 分类分子分散系 (d 100 nm)相相体系中物理性质和化学性质完全一样的一部分单相体系 多相体系存在界面分散系类型粗分散系胶体分散系分子分散系颗粒大小100 nm1001 nm1 nm高分子溶液 溶胶分散质存在方式分子的大聚集体大分子 小分子的聚集体小分子
3、、离子或原子主要性质不稳定很稳定 稳定最稳定多相单相 多相均相普通显微镜可见超显微镜可见电子显微镜也不可见不能透过滤纸能透过滤纸 不能透过半透膜能透过半透膜实 例泥浆血液 Fe(OH)3溶胶糖水分散系按分散质粒子的大小分类分散系按分散质粒子的大小分类 分子分散系分子分散系 (d1 nm)溶液溶液固态液态气态本节讨论的主要内容是 以水为溶剂的水溶液分散质以分子或者比分子更小的质点均匀地分散在分散剂中所得的分散系二溶液浓度的几种表示方法二溶液浓度的几种表示方法物质的量浓度质量摩尔浓度摩尔分数质量分数溶液组成标度之间的关系溶溶液液mmwBB wB为为B的质量分数,的质量分数,SI单位为单位为1mB为
4、为B的质量,的质量, Sl单位为单位为kgm 为溶液的质量,为溶液的质量, Sl单位为单位为kg二组分体系:A + B =1; 多组分体系BB= 1 ppm ppm和和ppbppb浓度浓度( (用于极稀的溶液用于极稀的溶液) )1mg1ppm1kg溶质溶液1 g1ppb1kg溶质溶液2 物质B的摩尔分数xB的单位为 1。二组分体系:xA + xB =1; 多组分体系xBB= 1摩尔分数溶液中一切组分物质的量的和组分B的物质的量溶溶液液VncBB Sl单位单位式中,式中,nB 是物质是物质B的物质的量的物质的量 mol V 是溶液体积是溶液体积 m3;常用常用L)cB molL-1ABBmnb式
5、中:式中: Sl单位为单位为 bB为溶质为溶质B的质量摩尔浓度的质量摩尔浓度 molkg-1; nB为溶质为溶质B的物质的量的物质的量 mol; mA为溶剂为溶剂A的质量的质量kg例例3.1:将:将2.67g萘萘 (C10H8)溶于溶于100g苯中,苯中, 计算该溶液的质量摩尔浓度。计算该溶液的质量摩尔浓度。 M(萘萘)=128.2g mol-11-1kgmol208.0kg100.0molg/128g67.2/ AABBmMmmnb例例 3.2 计算计算=10%的氯化钠水溶液中溶质和溶剂的摩的氯化钠水溶液中溶质和溶剂的摩尔分数。尔分数。解:根据题意,100g溶液中含有氯化钠10g, 水90g
6、。100g 溶液中NaCl和H2O 的物质的量分别为:n (NaCl) =m (NaCl)M (NaCl)=10 g58.5 g/mol= 0.17 moln (H2O) =m (H2O)=90 g18.0 g/mol=5.0 molM (H2O)所以:x (NaCl) =n (NaCl)n(NaCl) +n (H2O)=0.17= 0.030 x (H2O) = 1- x (NaCl) = 0.970.17 + 5.0例例 3.3 知知(H2SO4) =96.0%的浓硫酸,密度的浓硫酸,密度=1.84 gmL-1。计算。计算 c (H2SO4)及及 c (1/2)H2SO4。解:c (H2S
7、O4) =(H2SO4) M (H2SO4)=0.960 1.84 kg/L98.010-3kg/mol= 18.0 mol/Lc ( H2SO4) =(H2SO4) M ( H2SO4)=0.960 1.84 kg/L49.010-3kg/mol= 36.0 mol/L1212 稀溶液,是溶液中溶质与溶剂间没有相互作用的溶液,因此是一种理想化的溶液模型。稀溶液中的溶剂与纯溶剂相比,仅仅是稀溶液中溶剂的摩尔分数较小。三三 非电解质稀溶液的依数性非电解质稀溶液的依数性Colligative properties of dilute nonelectroiyte solution稀溶液的物理性质稀
8、溶液的物理性质与溶质本性有关,如酸碱性、导电性、颜色等。与溶质本性有关,如酸碱性、导电性、颜色等。与溶质本性无关,只与溶质的数量有关。与溶质本性无关,只与溶质的数量有关。 依数性:只与溶质粒子的数目有关而与依数性:只与溶质粒子的数目有关而与溶质本性无关的性质称为溶液的依数性,溶质本性无关的性质称为溶液的依数性,又叫溶液的通性。又叫溶液的通性。 依数性是指:依数性是指:溶液的蒸气压下降溶液的蒸气压下降 溶液的沸点上升溶液的沸点上升溶液的凝固点下降溶液的凝固点下降 溶液具有浸透压溶液具有浸透压1 溶液的蒸气压下降溶液的蒸气压下降v 溶剂的蒸发和蒸气压溶剂的蒸发和蒸气压液体外表的气化景象叫蒸发液面上
9、的气态分子群叫蒸气同种液体蒸气压随温度如何变化?不同液体蒸气压与什么有关?A 温度:B 物质本性:影响饱和蒸气压的要素影响饱和蒸气压的要素p=p纯纯p液液蒸汽压下降的缘由:蒸汽压下降的缘由:纯溶剂纯溶剂正常正常溶液溶液少少 拉乌尔定律:在一定温度下,难挥发非拉乌尔定律:在一定温度下,难挥发非电解质稀溶液的蒸气压等于电解质稀溶液的蒸气压等于纯溶剂的饱和蒸气压与溶剂纯溶剂的饱和蒸气压与溶剂的摩尔分数的乘积的摩尔分数的乘积 p :溶液的蒸气压:溶液的蒸气压 p*:纯溶剂的蒸气压:纯溶剂的蒸气压nA :溶剂的物质的量:溶剂的物质的量 nB :溶质的物质的量:溶质的物质的量幻灯片幻灯片 36 nA p=
10、 p* pp* xA nA + nBp液液 nB nA + nB nA nB p p* pp* xB nA nAmA/MA nB nB p p*p* MA nA mA nB p p * MA K b(B ) mA式中,式中,MA : kg/mol mA: kgK蒸蒸 =p* MA p = K蒸蒸 b(B) 拉乌尔定律的另一种表述。拉乌尔定律的另一种表述。K蒸与溶剂、蒸与溶剂、T有关的常数有关的常数同一温度,溶剂不同,其同一温度,溶剂不同,其K蒸不同;蒸不同;同一溶剂,温度不同,其同一溶剂,温度不同,其K蒸也不同蒸也不同在一定温度下,难挥发非电解质稀溶液的蒸气压下降只与溶液的质量摩尔浓度成正比,
11、与溶质的本性无关。 【例】假设某溶液的溶剂水为【例】假设某溶液的溶剂水为30mol,溶质蔗,溶质蔗糖是糖是0.054mol,那么其质量摩尔浓度,那么其质量摩尔浓度b(B)是多是多少?少?30 0.0541000/18.01 b(B)30 18.01 0.0541000 b(B)0.054()( )30()1000 18.01BAnb Bn0.054( )30 18.011000b B10.054 100018.010.054 55.52( )0.103030b Bmol kg代入代入: p = K蒸蒸b(B) 0.11 = 0.0571131000/(MB87) MB = 77.56 (g/m
12、ol)【例】【例】 在在25时时,w=13%的某难挥发的非电解的某难挥发的非电解质水溶液的蒸气压质水溶液的蒸气压p=3.06kpa,知同温度下水的蒸知同温度下水的蒸气压气压p*= 3.17kpa ,计算溶质的摩尔质量。,计算溶质的摩尔质量。解解: K蒸蒸 = 3.170.018 = 0.0571 p = 3.17- 3.06 = 0.11kPamolkg-1特点:液体的饱和蒸气压等于外压特点:液体的饱和蒸气压等于外压当外压为当外压为101.3kPa时液体沸点为正常沸点时液体沸点为正常沸点normal boiling point 。实验证明:难挥发物质溶液的沸点总是高于纯溶剂的沸点。实验证明:难
13、挥发物质溶液的沸点总是高于纯溶剂的沸点。缘由:溶液的蒸气压下降。见以下图缘由:溶液的蒸气压下降。见以下图根本缘由:蒸汽压下降根本缘由:蒸汽压下降 p p溶液溶液p V V蔗糖蔗糖分散方向:纯水分散方向:纯水 蔗糖蔗糖半透膜半透膜液面上升液面上升液面下降液面下降纯水纯水蔗糖蔗糖溶液溶液半透膜:指一类可以让小分子物质透过而大分子物质不能经过的薄膜的总称。小分子和大分子的界定根据膜种类的不同而划分范围不同。例如,对于鸡蛋的膜来说,葡萄糖分子就是大分子物质;而对于透析管来说,葡萄糖是小分子物质;对于肠衣来说,碘以及葡萄糖是小分子物质,而淀粉是大分子物质。在日常生活中,常见的半透膜有鸡蛋膜、鸡的嗉囊、鱼
14、鳔、蚕豆种皮、玻璃纸、青蛙皮、动物膀胱、肠衣、蛋白质胶膜,火棉胶膜以及其他一些可从生物体上剥离的薄膜类物质。 活细胞内的生物膜只允许水分子自在经过,它所选择的离子、小分子物质可以经过,而其他的离子、小分子和大分子不能透过,是严厉的半透膜。细胞丧失活力后生物膜的选择透过才干丧失。浸透:溶剂分子经过半透膜自动单向分散的浸透:溶剂分子经过半透膜自动单向分散的过程称为浸透。当过程称为浸透。当v v纯水纯水 = v = v蔗糖蔗糖 等渗溶液。等渗溶液。蔗糖溶液增高的这部分水的静压力就是蔗糖蔗糖溶液增高的这部分水的静压力就是蔗糖溶液的浸透压。溶液的浸透压。浸透压:在一定的温度下,恰能阻止浸透发生浸透压:在
15、一定的温度下,恰能阻止浸透发生所需施加的外压力,称为该溶液的浸透压。用所需施加的外压力,称为该溶液的浸透压。用符号符号表示。表示。纯水纯水蔗糖蔗糖溶液溶液 h纯水纯水蔗糖蔗糖溶液溶液浸透作用产生的条件:浸透作用产生的条件:半透膜存在;半透膜存在;膜两侧溶液的浓度不相等。膜两侧溶液的浓度不相等。浓差浓差实验证明:实验证明:1 1、同一温度下,溶液的浸透压与浓度成正比。、同一温度下,溶液的浸透压与浓度成正比。2 2、一样浓度时,浸透压与热力学温度成正比。、一样浓度时,浸透压与热力学温度成正比。计算公式:计算公式: V = n(B)RT = c(B)RT b(B)RT 溶液很稀时,溶液很稀时, c(
16、B) b(B) c(B) 物质的量浓度物质的量浓度 R:气体常数:气体常数 8.314 kPa L mol-1.K-1 T:热力学温度绝对温度:热力学温度绝对温度对于难挥发、非电解质稀溶液对于难挥发、非电解质稀溶液 cb(B)(RTKKTKpbbff蒸BbT【例】人体血的浸透压为【例】人体血的浸透压为709.275kPa, 人体温度人体温度为为37。试计算给人体输液时所用葡萄糖溶液。试计算给人体输液时所用葡萄糖溶液的的 是多少?是多少?(设葡萄糖溶液密度是设葡萄糖溶液密度是1.01g.ml-1;葡萄糖的分子摩尔质量葡萄糖的分子摩尔质量M为为180g.mol-1)。解:解: = c(葡葡) RT
17、 c = /RT c(葡葡) = 709.275/8.314(273.15+37) = 0.28 mol.L-1 = c(葡葡) M/1000 =(0.28180/10001.01)100% = 5.0%【例】海水在【例】海水在298K时的浸透压为时的浸透压为1479kPa,采用,采用反浸透法制取纯水,试确定用反浸透法制取纯水,试确定用1000cm3的海水经的海水经过只能使水透过的半透膜,提取过只能使水透过的半透膜,提取100cm3的纯水,的纯水,所需求的最小外加压力是多少所需求的最小外加压力是多少? 解:解: 随着反浸透的进展,海水中盐的浓度增随着反浸透的进展,海水中盐的浓度增大,当得到大,
18、当得到100cm3纯水时,最终海水的浸透压纯水时,最终海水的浸透压2和初始海水的浸透压和初始海水的浸透压1的比值为的比值为 222111c RTcc RTc2211ccc1 = n mol1000cm3c2 n mol (1000 -100)cm3 211000109009cc210147916439kPa 由于浸透前后溶质的物质的量未减少,由于浸透前后溶质的物质的量未减少,v 浸透压的运用浸透压的运用 医用等渗液 口渴时普通不宜饮用含糖等成分过高的饮料。 速溶咖啡和速溶茶的制造将稀溶液首先用反浸透方法变浓,再用蒸发法蒸干,生产本钱会大大降低。 测定溶质的分子量 利用反渗进展海水淡化四、依数性
19、的运用四、依数性的运用 植物细胞液中溶有氨基酸、糖类物质,有一定的抗旱性蒸气压下降蒸气压下降 植物还有一定的耐寒性凝固点下降凝固点下降 用NaCl等物质与冰混合而制成的冷冻剂 为何稀饭比水烫伤得厉害? 冬天,人们常往汽车的水箱中参与甘油 等物质,以防止水箱因水结冰而胀裂。沸点上升沸点上升不同物质溶液依数性的比较不同物质溶液依数性的比较 0.1mol.L-1 NaCl 溶液溶液 0.1mol.L-1 蔗糖蔗糖 溶液溶液 0.1mol.L-1 甘油甘油 溶液溶液 0.1mol.L-1 Na2SO4 溶液溶液 0.1mol.L-1 HAc 溶液溶液请将这五种溶液按沸点由高到低顺序陈列:请将这五种溶液
20、按沸点由高到低顺序陈列:答案:答案: = Na2SO4 2Na+ SO42- c 2c + c完全电离完全电离 NaCl Na+ + Cl- c c + c 完全电离完全电离HAc H+ + Ac- c x + x c 部分电离部分电离11.00克非电解质溶于克非电解质溶于20.0克水中,测定冰克水中,测定冰点是点是-0.50,该非电解质的相对分子量是,该非电解质的相对分子量是 Kf1.86 (A) 1.86 /( 0.500. 20) (B) 1.86/(0.5020.0) (C) 0.5020.0/1.86 (D) 1.86/( 0.500.020)D D自测题自测题2. 一样质量的蔗糖和
21、葡萄糖分别溶解于一样体积的水中,所得溶液的浸透压 蔗糖(C12H22O11)葡萄糖(C6H12O6) (A)前者大于后者 (B)后者大于前者 (C)两者一样 (D)不能判别B B留意 稀溶液依数性的定量关系只顺应于非电解质稀稀溶液依数性的定量关系只顺应于非电解质稀溶液难挥发,而对于浓溶液或电解质溶液,溶液难挥发,而对于浓溶液或电解质溶液,定量关系不再成立,但性质依然存在。定量关系不再成立,但性质依然存在。如:定性估计以下溶液如:定性估计以下溶液 0.1mol/kg 蔗糖溶液蔗糖溶液0.1mol/kg NaCl0.1mol/kg BaCl2蒸气压、沸点、凝固点蒸气压、沸点、凝固点五电解质溶液简介
22、五电解质溶液简介 电解质电解质在水溶液中或熔融形状下能导电的物质在水溶液中或熔融形状下能导电的物质 非电解质非电解质在水溶液中或熔融形状下不能导电的物质在水溶液中或熔融形状下不能导电的物质 弱电解质弱电解质 强电解质Arrhenius 电离学说电离学说1887当电解质溶于水时便自动地部分离解成当电解质溶于水时便自动地部分离解成 正、负离子正、负离子电离。电离。(2) 强电解质全部电离,弱电解质部分电离强电解质全部电离,弱电解质部分电离(3) 电离过程是可逆的电离过程是可逆的Arrhenius 由于电离实际而获由于电离实际而获1903年年Nobel 化学奖化学奖弱电解质在水中只需部分解离,解离度
23、较小,在水溶弱电解质在水中只需部分解离,解离度较小,在水溶液中存在解离平衡;而强电解质在水中解离比较完全,液中存在解离平衡;而强电解质在水中解离比较完全,在水溶液中不存在解离平衡。在水溶液中不存在解离平衡。 解离度解离度100%已解离的物质的量初始物质的量 强电解质溶液表观的解离度强电解质溶液表观的解离度 几种强电解质的实测解离度几种强电解质的实测解离度298.15K, 0.1molL-1298.15K, 0.1molL-1电解质电解质 KCl ZnSO4 HCl HNO3 H2SO4 NaOH KCl ZnSO4 HCl HNO3 H2SO4 NaOH Ba(OH)2Ba(OH)2实测解离度
24、实测解离度 (%) 86 40 92 92 (%) 86 40 92 92 61 91 8161 91 81 1887年,年,Arrhenius 是这样在电离实际中解释这个景象的:是这样在电离实际中解释这个景象的: 电解质在水溶液中是电离的电解质在水溶液中是电离的. 电离电离“似乎又是不完全的似乎又是不完全的. 然而,我们知道,强电解质离子晶体,在水中应是完全电然而,我们知道,强电解质离子晶体,在水中应是完全电离的,那么,这一矛盾又如何解释呢?离的,那么,这一矛盾又如何解释呢? 离子氛和离子强度离子氛和离子强度 强电解质在水溶液中是强电解质在水溶液中是 完全电离的完全电离的Debye-Huck
25、el强电解质强电解质溶液实际溶液实际活度(activity )ccBBB/电解质溶液中例子实践发扬作用的浓度电解质溶液中例子实践发扬作用的浓度-活度活度 B 为活度系数为活度系数(activity coefficient),与溶液中离子间的,与溶液中离子间的相互作用有关相互作用有关cB为物质为物质B的浓度的浓度b 为规范浓度为规范浓度1.0mol kg-1)通常用通常用c = 1.0mol L-1离子强度离子强度(ionic strength212iiZcIIIZZB1509. 0lg21离子浓度越大,电荷越高,离子强度越离子浓度越大,电荷越高,离子强度越大,活度系数越小。大,活度系数越小。通
26、常地:通常地:a.当电解质溶液浓度很稀或弱电解质溶液当电解质溶液浓度很稀或弱电解质溶液时,忽略离子间的相互作用,用浓度替时,忽略离子间的相互作用,用浓度替代活度进展计算。代活度进展计算。b.在进展实践丈量时如速度,酸度等,在进展实践丈量时如速度,酸度等,通常参与离子强度调理剂,来坚持溶液通常参与离子强度调理剂,来坚持溶液中离子强度稳定。中离子强度稳定。本节小结:本节小结: 1 1、浓度:物质的量浓度、质量摩尔浓、浓度:物质的量浓度、质量摩尔浓度、摩尔分数。度、摩尔分数。2 2、难挥发、非电解质、稀溶液通性的计、难挥发、非电解质、稀溶液通性的计算公式:算公式:p = K蒸蒸 b(B)Tb = K
27、b b(B)Tf = Kf b(B) = cRT b(B) RT运用条件:运用条件:1、难挥发物质、难挥发物质2、非电解质、非电解质3、稀溶液、稀溶液第二节第二节 胶体胶体Particles of 1-100 nm size 胶体溶液(溶胶)由小分子、原子或离子聚集成较大颗粒而构成的多相体系。如Fe(OH)3溶胶和As2S3溶胶由一些高分子化合物组成的溶液。如胶水。一一 、溶胶的制备、溶胶的制备v 分散相粒子大小v 稳定剂条件条件v 分散法:大粒子变小v 研磨法 超声波法v 电弧法 胶溶法v 凝聚法:小粒子变大v 物理凝聚:改换溶剂v 化学凝聚:利用化学反响生成难溶物方方 法法加FeCl3稳定
28、剂Fe(OH)3新颖沉淀 Fe(OH)3溶胶二、溶胶的性质二、溶胶的性质 动力学性质动力学性质-布朗布朗BrownBrown运动运动 光学性质光学性质-丁铎尔效应丁铎尔效应 电学性质电学性质(1)-(1)-电泳电泳 电学性质电学性质(2)-(2)-电渗电渗 吸附作用吸附作用 溶胶粒子带电缘由溶胶粒子带电缘由胶体粒子外表分子发生电离使胶粒带电胶体粒子外表分子发生电离使胶粒带电硅酸溶胶外表上硅酸溶胶外表上H2SiO3分子可以电离,如分子可以电离,如H2SiO3 = HSiO3- + H+ 或或 SiO32- + 2H+HSiO3-或或 SiO32- 留在外表而使粒子带负电荷,留在外表而使粒子带负电
29、荷,H+ 进入溶液。进入溶液。胶体粒子对溶液中的离子产生选择性吸附使胶粒带电胶体粒子对溶液中的离子产生选择性吸附使胶粒带电 离子选择吸附离子选择吸附优先吸附与它组成有关的离子优先吸附与它组成有关的离子 Ag Br Ag Br Ag Br Ag Br Ag Br Ag Br Ag Br Ag BrBrBr Ag Br Ag Br Ag Br Ag Br Ag Br Ag Br Ag Br Ag Ag+Ag+ 例二:AgNO3 与 KBr制备AgBr溶胶时AgNO3 过量,那么AgBr固体优先吸附Ag+ 而使固体外表带正电。 离子交换吸附离子交换吸附吸附某种离子的同时,将原来已存在于吸附剂外表吸附
30、某种离子的同时,将原来已存在于吸附剂外表的电荷符号一样的另一种离子等量地释放到溶液中去的电荷符号一样的另一种离子等量地释放到溶液中去Na+Ca2+ + 3NH4+ NH4+NH4+NH4+ Ca2+ + Na+ 浓度越大,离子价数越高,交换才干越强。浓度越大,离子价数越高,交换才干越强。例如,交换才干例如,交换才干NaMg2Al3价数一样时,与水化离子半径有关。例如价数一样时,与水化离子半径有关。例如水化离子半径:水化离子半径:LiNaKRbCs交换才干:交换才干:Li Na K Rb Cs三、胶团构造三、胶团构造AgImI-I-I-I-I-I-I-I-I-I-I-I-I-I-K+K+K+K+
31、K+K+K+K+K+K+K+K+K+ 胶团构造胶团构造AgNO3+KI(过量) AgI(溶胶)吸吸附附层层分散层分散层(AgI)mnI- (n-x)K+x- xK+胶核胶核吸附层吸附层分散层分散层胶团胶团I-: 电位离子电位离子 K+: 反离子反离子胶粒胶粒四、溶胶的稳定性与聚沉四、溶胶的稳定性与聚沉 稳定性的缘由 聚沉聚沉溶胶失去稳定要素,胶粒相互碰撞,将导致颗粒合并、变大最后以沉淀方式析出 聚沉值聚沉值能使一定量的溶胶在一定时间内开场聚沉所需电解质的最低浓度,单位为 mmolL-1。v 布朗运动:抑制沉降作用v 胶粒带电:使胶粒分开v 溶剂化作用:防止碰撞 动力学动力学 聚沉才干聚沉才干是
32、聚沉值的倒数。聚沉值越大的电解质,聚沉才干越小。 电解质的聚沉规律 价态影响 与胶粒带相反电荷的离子的价数影响 最大,价数越高,聚沉才干越强。负溶胶负溶胶 As2S3 As2S3:聚沉值:聚沉值AlCl3 : MgCl2 : NaCl = 1 : 8 : 548AlCl3 : MgCl2 : NaCl = 1 : 8 : 548。负溶胶负溶胶: : 聚沉才干是聚沉才干是Cs+ Rb+ K+ Na+ Li+ Cs+ Rb+ K+ Na+ Li+ 溶胶的相互聚沉将胶粒带相反电荷的溶胶相互混合,也会发生聚沉天然水中胶态的悬浮物大多数带负电荷如土壤胶体、有机质胶体,而明矾在水中水解而得Al(OH)3为
33、正溶胶,它们相互聚沉而使水净化。第三节气体第三节气体一、理想气体形状方程一、理想气体形状方程 在通常的温度及压力条件下,固态在通常的温度及压力条件下,固态Solids、液态液态Liquids和气态和气态Gases是物质的是物质的3种种主要物态主要物态 此外,在特定条件下,还有液晶态和等离子态。此外,在特定条件下,还有液晶态和等离子态。 物质的三态中,研讨较早较为深化的是气体物质的三态中,研讨较早较为深化的是气体理想气体形状方程:把描画气体形状的理想气体形状方程:把描画气体形状的3个参量个参量p,V ,T 归于一个方程式,称为理想气体形状归于一个方程式,称为理想气体形状方程。方程。pMRTpVn
34、RTmnMmpVRTMmVR: The Gas Constant333(101.325 10 Pa) (22.4 10 m)1mol 273.15KPVRnT规范情况规范情况3-111111118.315Pa m molK8.315kPa L molK8.315J molK0.08206atm L molK 留意单位的一致气体的最根本特征:气体的最根本特征: 具有可紧缩性和分散性。具有可紧缩性和分散性。 人们将符合理想气体形状方程式的气体,称为理想气体人们将符合理想气体形状方程式的气体,称为理想气体。 理想气体分子之间没有相互吸引和排斥,分子本身的体理想气体分子之间没有相互吸引和排斥,分子本身
35、的体积相对于气体所占有体积完全可以忽略。积相对于气体所占有体积完全可以忽略。O2 分子分子 理想气体: 分子不占体积 分子间无相互作用低压高温 实践气体: 分子有体积 分子间有相互作用实践气体的形状方程a,b为校正常数,可查表。对于不同的气体,有不同的数值。nRTnbVVanp)(22组分气体:组分气体: 理想气体混合物中每一种气体叫做组分气理想气体混合物中每一种气体叫做组分气体。体。分压:分压: 组分气体组分气体B在一样温度下占有与混合气体一在一样温度下占有与混合气体一样体积时所产生的压力,叫做组分气体样体积时所产生的压力,叫做组分气体B的分压的分压。BBn RTpV三三 分压定律分压定律道
36、尔顿分压定律道尔顿分压定律(1807)Daltons Law of Partial Pressure 2HP2.4atmHeP6.0atm20.50molH1.25molHetolP8.4atm1.25molHe20.50molH1.75molgas(a) 5.0 L at 20(b) 5.0 L at 20(c) 5.0 L at 20分压定律:分压定律:温度和体积恒定时,混合气体的总压力等于组分温度和体积恒定时,混合气体的总压力等于组分气体分压力之和。气体分压力之和。 某组分气体的分压力等于该气某组分气体的分压力等于该气体同温度下单独占有总体积时,所表现的压力。体同温度下单独占有总体积时,所表现的压力。 p = p1 + p2 + pi 或或 p = pB VnRTp ,2211VRTnpVRTnp1212iin RTn RTn RTRTpnnnVVVV n =n1+ n2+ni 分压的求解:分压的求解:x B B的摩尔分数的摩尔分数VRTnpBBBBBxnnppVnRTp BBBnppx pn 例题:某容器中含有例题:某容器中含有NH3、O2 、N
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2026安徽蚌埠五河县乡村医生招聘16人笔试备考题库及答案解析
- 2026年贵州工程职业学院单招综合素质笔试备考题库含详细答案解析
- 2026广东深圳宝安区航城街道中心幼儿园招聘笔试备考题库及答案解析
- 2026上半年云南事业单位联考红河州招聘1570人考试重点题库及答案解析
- 2026河北石家庄市元氏县人力资源和社会保障局从2022年三支一扶志愿者中专项招聘事业单位工作人员3人笔试备考题库及答案解析
- 2026年闽江师范高等专科学校高职单招职业适应性测试备考题库及答案详细解析
- 2026安徽合肥市五十中学西校教育集团心湖校区招聘教师笔试备考题库及答案解析
- 2026江西吉安市吉水县金滩新区开发建设有限公司面向社会招聘1名食堂经理笔试备考试题及答案解析
- 2026上半年陕西事业单位联考商洛市招聘307人笔试备考题库及答案解析
- 2026浙江绍兴市外服人力资源服务有限公司聘用制人员招聘1人笔试备考题库及答案解析
- 签字版离婚协议书范本
- 《神笔马良》:儿童读书分享
- 外研版五年级英语下册单词表
- 《木兰诗》历年中考古诗欣赏试题汇编(截至2024年)
- 技能认证催化高级考试(习题卷28)
- 拖欠工程款民事判决书
- 2011~2020年上海市高考语文文言文真题译文全集
- 设立年产20万吨固体氢氧化钠项目安全评估报告
- 主斜井管路安装

评论
0/150
提交评论