



已阅读5页,还剩51页未读, 继续免费阅读
版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
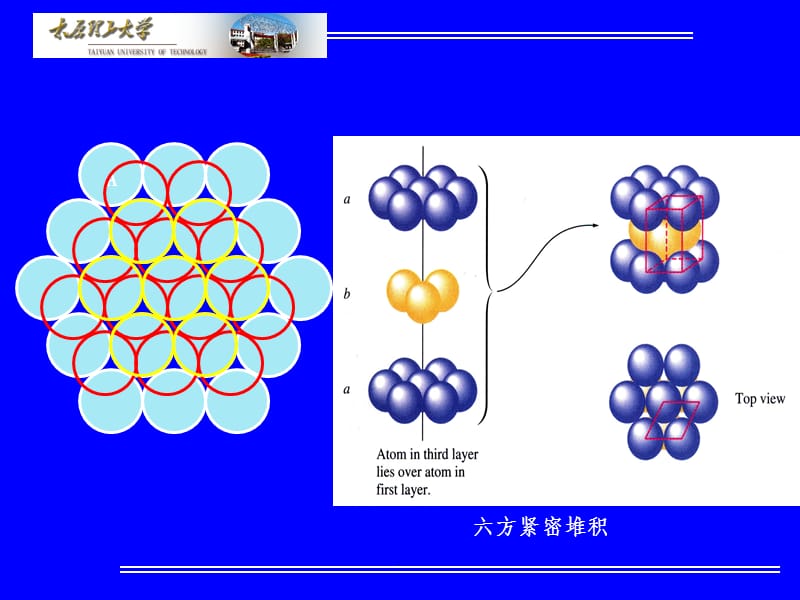
.,2-2常见的晶体结构,1.原子半径和离子半径原子半径或离子半径的概念根据波动力学的观点,原子或离子围绕核运动的电子在空间形成一个电磁场,其作用范围可视为球形。这个球形的大小可视为原子或离子的体积,球的半径即为原子半径或离子半径。原子或离子有效半径的概念原子或离子在晶体结构中处于相接触时的半径。这种状态下,离子或原子间的静电吸引和排斥作用达到平衡。,一.晶体化学基本原理,.,有效半径的确定金属晶体两个相邻原子中心距的一半。离子晶体一对相邻接触的阴、阳离子的中心距为离子半径之和。共价晶体两个相邻键合离子的中心距为两离子的共价半径之和。,原子或离子半径是晶体学中的重要参数原子或离子半径大小对结构中质点排列方式影响很大。原子或离子半径的概念并不十分严格,一种原子在不同的晶体中,与不同的元素相结合,其半径可能发生变化。离子晶体中存在极化,常是电子云向正离子方向移动,导致正离子的作用范围变大,而负离子作用范围要变小。共价键的增强和配位数的减少都可使原子或离子间距离缩短,从而相应使半径减少。,.,2.球体紧密堆积原理球体最紧密堆积的基本类型单一质点的等大球体最紧密堆积,如纯金属晶体。几种质点的不等大球体的紧密堆积,如离子晶体。等大球体的最密堆积等大球体的最紧密排列平面有如图的形式。在A球的周围有六个球相邻接触,每三个球围成一个空隙。其中一半是尖角向上的B空隙,另一半是尖角向下的C空隙,两种空隙相间分布。,.,B,C,.,六方紧密堆积,.,面心立方紧密堆积,.,密堆积层间的两类空隙,四面体空隙:一层的三个球与上或下层密堆积的球间的空隙。,八面体空隙:三层六个球空间排列形成的球间的空隙。,.,八面体空隙多面体和四面体空隙多面体,.,不等大球体的紧密堆积对不等大球体堆积,可看成较大的球体作等大球体的密堆积,而较小的球按其大小,充填在八面体或四面体空隙中,形成不等大球体的紧密堆积。这种堆积方式,在离子晶体构造中相当于半径较大的阴离子作密堆积,半径较小的阳离子充填于空隙中。在实际晶体中,阳离子的大小不一定无间隙地充填在空隙中,当阳离子的尺寸稍大于空隙,将会略微“撑开”阴离子堆积。当阳离子的尺寸较小,填充在阴离子空隙内有余量。这两种结果都将对晶体结构及性能产生影响。,.,3.原子和离子的配位数(CoordinationNumber,CN),金属材料:一个原子周围与它直接相邻结合的原子个数,常称为原子配位数。12、8。离子晶体材料:一个离子周围与它直接相邻结合的所有异号离子个数,常称为离子配位数。8、6、4。共价键晶体:由于方向性和饱和性,因此其配位数不符合紧密堆积原则,CN较低(4、3)。高分子材料:质点配位情况非常复杂,很难定义。,.,配位多面体是指物质结构中,与某个质点构成配位关系而相邻结合的各个质点中心连线所构成的多面体。该质点处于配位多面体的中心位置,而配位质点的中心处于配位多面体的顶角上。,几种典型的配位形式及其相应的配位多面体,.,正、负离子半径比与阳离子配位数及配位多面体形状,.,4.Pauling规则,Pauling第一规则在正离子周围,形成一个阴离子配位多面体,正离子处于中心位置,负离子处于多面体的顶角;正、负离子的间距决定于它们的半径之和,而离子的配位数则取决于它们的半径之比,与离子的价数无关,也称多面体规则。,Pauling第二规则在稳定的离子晶体结构中,一个阴离子从所有相邻接的阳离子分配给该阴离子的静电键强度的总和,等于阴离子的电荷数。静电价规则。,.,Pauling第三规则在晶体结构中,每个配位多面体以共顶方式连接,共棱连接,特别是共面连接方式存在时,会使结构的稳定性降低。,四面体或八面体相互连接情况,R1R2R3=10.580.33,R1R2R3=10.710.58,.,Pauling第四规则在一个含有多种阳离子的晶体中,电价高而配位数小的那些阳离子所形成的配位多面体不倾向于相互直接连接。,Pauling第五规则在一个晶体结构中,本质不同的结构组元的种类,倾向于最少,也称节约规则。,.,二.典型金属的晶体结构,面心立方结构fcc:FaceCentredCubic,体心立方结构bcc:BodyCentredCubic,密排六方结构hcp:HexgonalClosePacking,.,体心立方面心立方密排六方,.,.,原子半径与晶格常数,体心立方面心立方密排六方,.,.,.,.,.,体心立方中原子排列,在体心立方晶格中密排面为110,密排方向为,.,面心立方中原子排列,在面心立方晶格中密排面为111,密排方向为,.,密排六方中原子排列,.,密排六方面心立方(0001)+0001(111)+111,密排堆垛,体心立方(110)+110,.,.,.,.,.,密排六方晶格八面体间隙,密排六方晶格四面体间隙,.,三.常见无机化合物的晶体结构,1.NaCl型AB型最常见的晶体构型,晶胞中离子的个数:,晶格:面心立方,配位比:6:6,同类材料:MgO、CaO、SrO、BaO、MnO、CoO、NiO等。,.,NaCl结构中的正离子配位多面体,.,2.CsCl型结构,晶胞中离子的个数:,(红球Cs+,绿球Cl-),晶格:简单立方,配位比:8:8,同类材料:CsBr、CsI、TlCl、NH4Cl等。,.,CsCl型结构,.,3.-ZnS(闪锌矿)和-ZnS(钎锌矿)型结构,晶胞中离子的个数:,-ZnS,晶格:面心立方配位比:4:4(红球Zn2+,绿球S2-),.,S,-ZnS钎锌矿结构,.,半径比规则:,NaCl的R+/R-=95Pm/181Pm=0.52配位数6CsCl的R+/R-=163Pm/181Pm=0.90配位数8ZnS的R+/R-=74Pm/184Pm=0.40配位数4,.,4.CaF2(萤石)型结构,CaF2的晶体结构,立方晶系面心立方格子z=4,.,CaF2晶体结构,.,5.TiO2(金红石)型结构,TiO2(金红石)的结构,四方晶系简单四方点阵z=2ao=0.459nmco=0.296nm,.,金红石(TiO2),板钛矿(TiO2),.,锐钛矿(TiO2),.,6.CaTiO3(钙钛矿)型结构,通式:ABO3A二价(或一价)B四价(或五价),立方晶系(高温时)简单立方格子ao=0.385nmz=1,正交晶系(600C)简单正交格子PCmm空间群ao=0.537nm,bo=0.764nm,co=0.544nmz=4,.,立方晶系,正交晶系,.,CaTiO3立方晶体结构,.,钙钛矿结构的通式为ABO3,以CaTiO3为例讨论其结构:,Ca2+,O2-,Ti4+,.,配位关系的分析:,可以看出:Ca的CN=12Ti的CN=6O的CN=2+4=6,.,7.MgAl2O4(尖晶石)型结构,尖晶石颜色极其丰富,但主要为红色、蓝色、绿色、紫色、橙红、橙黄、褐色、黑色,其中重要颜色为红色和蓝色。,通式:AB2O3,.,历史上最为著名的两颗尖晶石是“铁木尔红宝石”和“黑太子红宝石”,“铁木尔红宝石”重361ct,深红色,可能来源于阿富汗,这颗著名的尖晶石自1612年以来被誉为东方的“世界贡品”。被称为“黑太子红宝石”重约170ct,产于缅,甸镶于英王冠中前方明显的位置。经专家评这颗著名的红色尖晶石的价值约55万美元。还有一些著名的尖晶石珍藏于不
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025-2030中国液压剪式升降机行业市场现状供需分析及投资评估规划分析研究报告
- 出院计划与健康教育试题及答案
- 2025-2030中国浴室厨房用品行业市场现状供需分析及重点企业投资评估规划分析研究报告
- 医学电生理技术试题及答案
- 2025-2030中国波纹金属板行业市场现状供需分析及投资评估规划分析研究报告
- 2025-2030中国泄漏试验设备行业市场现状供需分析及投资评估规划分析研究报告
- 教师资格笔试考情分析试题及答案
- 心理咨询师考试中实践技巧与理论知识结合的试题答案
- 2025年育婴师考试复习课程安排试题及答案
- 家电趣味测试题及答案
- 工业交换机内部培训
- 环境有害物质管理办法
- 《中国特色社会主义进入新时代》PPT课件下载
- 基于PLC的温室大棚控制系统设计
- 证券投资基金信息披露xbrl模板第3号《年度报告和半年度报告》
- 工程力学电子教材
- 70周岁以上老年人三力测试题库换领永久驾驶证
- 动物免疫学第五章细胞因子
- 新版防雷检测职业技能竞赛综合知识试题库(精简500题)
- 2023年新华人寿保险股份有限公司招聘笔试题库及答案解析
- GB/T 4513.1-2015不定形耐火材料第1部分:介绍和分类

评论
0/150
提交评论