



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、(五)氧化还原反应课程目标1 掌握氧化还原反应的基本概念和根据化合价的变化判断氧化还原反应。2 用电子转移的观点理解氧化还原反应的实质并能简单运用。3 了解常见的氧化剂和还原剂。4 复习巩固四种基本反应类型以及它们与氧化还原反应的关系。5了解氧化还原反应的电子得失和电子转移情况的两种表示方法。 要点精析一、氧化还原反应:在反应过程中有元素化合价变化的化学反应 1、氧化还原反应的本质:电子的转移(电子的得失或电子对的偏移)2、氧化还原反应的特征(判断依据):反应前后元素化合价发生了变化。3、氧化剂、还原剂、氧化反应、还原反应、氧化产物、还原产物的判断:氧化剂: 得到电子(所含元素化合价降低)的反
2、应物还原剂: 失去电子(所含元素化合价升高)的反应物(1) 氧化剂和还原剂均是指反应物质,是一种化学试剂,而不是某一种元素。(2) 氧化剂具有氧化性,氧化剂本身被还原,即发生还原反应,转化为还原产物;还原剂具有还原性,还原剂本身被氧化,即发生氧化反应,转化为氧化产物。例1:在下列各式中,当左边的物质能生成右边的物质时,试指出下列带点的元素是被氧化还是被还原?(1)KClO3KCl (2)HClOO2 (3)KII2 (4)NO2HNO3解析:(1)中氯元素化合价由+5下降到-1,被还原;(2)中氧元素化合价由-2升高到0,被氧化;(3)中碘元素化合价由-1升高到0,被氧化;(4)中氮元素化合价
3、由+4升高到+5,被氧化。答案:(1)中氯元素被还原;(2)中氧元素被氧化;(3)中碘元素被氧化;(4)中氮元素被氧化。例2:二氧化硫与硫化氢相遇,发生如下反应:SO22H2S=2H2O3S在这个反应中二氧化硫和硫化氢,哪个是氧化剂,哪个是还原剂?在反应的产物中,氧化产物与还原产物的物质的量之比是多少?解析:二氧化硫中硫元素的化合价由+4下降到0,二氧化硫被还原,做氧化剂;硫化氢中硫元素化合价由-2升高到0,硫化氢被氧化,做还原剂。每生成3molS中,有2molS是硫化氢中-2价的硫被氧化而来的,属氧化产物,有1molS是二氧化硫中的+4价的硫被还原来的,属还原产物,所以氧化产物与还原产物的物
4、质的量之比是2:1。答案:二氧化硫是氧化剂,硫化氢是还原剂;氧化产物与还原产物的物质的量之比是2:1。二、常见的氧化剂、还原剂1、常见的氧化剂:在化学反应中易得电子被还原的物质。(1)典型的非金属单质如:O2、Cl2、Br2、I2、S(其氧化性强弱与非金属活动性基本一致)。(2)有变价元素的高价态化合物如:、浓、。(3)金属阳离子如:Fe3+、Cu2+、(H+)(在金属与酸、盐溶液的置换反应,如反应FeCuSO4=FeSO4Cu中,实质上是Cu2+离子氧化Fe原子,Cu2+作氧化剂,Fe是还原剂)。2、常见还原剂:在化学反应是易失电子被氧化的物质。(1)典型的金属单质如:K、Ca、Na、Mg(
5、其还原性强弱与金属活动性基本一致)。(2)某些非金属单质及氧化物如:H2、C、CO、SO2。(3)有变价元素的低价态化合物如:H2S、HI、HBr、HCI、FeSO4 、Na2SO3。(4)非金属阴离子如:S2、I、Br、CI。例3:某元素在化学反应中,由化合态变为游离态,则该元素( )A 一定被氧化 B 一定被还原C 可能被氧化,也可能被还原 D 化合价降低为0解析:化合态时元素的化合价可能是正价,也可能是负价,转变成游离态0价,因此,元素可能是被还原也可能是被氧化,所以选C。小结:金属元素只能失电子,只有正价,所以金属单质只有还原性;非金属元素既能得电子表现负价,又能失(偏离)电子表现正价
6、,所以非金属单质多数既有氧化性又有还原性。例4:从氧化、还原的观点分析氯气和盐酸的化学性质。解析:氯气的化学性质,如氯气跟金属单质(钠、铁、铜)、非金属单质(氢气、磷)的反应中都是得电子,化合价降低被还原,作氧化剂,因此氯气具有强氧化性;但氯气也有还原性,如氯气跟水、碱溶液所发生反应,其中有一部分氯就是表现了还原性。盐酸也是既有氧化性又有还原性的。如在盐酸跟镁、铝、锌等较活泼金属发生的置换反应中,盐酸表现了氧化性。在浓盐酸跟二氧化锰反应制取氯气时,盐酸表现了还原性。由于盐酸的氧化性实质上是H+的氧化性,属于酸的通性,即绝大多数酸所具有的共同性质,因此不能把盐酸称为氧化性酸。三、氧化还原反应和四
7、种基本类型反应的关系1、把化学反应分成氧化还原反应、非氧化还原反应和四种基本类型反应,是两种不同的分类方法。前者分类根据化学反应实质,后者分类根据反应物、生成物种类的多少和类别,所以从分类的根据上看,前者较后者更深入本质。化学反应的不同分类方法的关系是:基本类型氧化还原反应非氧化还原反应化合2Cu+O22CuOCaOH2O=Ca(OH)2 没有单质参加反应分解2KClO32KCl+3O2NH4HCO3 NH3H2OCO2 没有单质生成置换Fe+2HCl=FeCl2+H2复分解H2SO4Ba(OH)2=BaSO42H2O 2、化合反应、分解反应、置换反应与氧化还原反应的交叉分类示意图置换反应一定
8、是氧化还原反应,化合反应、分解反应可能是氧化还原反应,复分解反应都不是氧化还原反应。四、氧化还原反应中电子得失情况的表示方法 (只是了解内容,不需要掌握)1、双线桥表示电子得失的结果要点:(1)双箭号(从反应物指向生成物);(2)箭号起、止所指为同一种元素;(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)。2、单线桥表示电子转移情况 要点:(1)单箭号(在反应物之间); (2)箭号起点为被氧化(失电子)元素,终点为被还原(得电子)元素;(3)只标转移电子总数,不标得与失(氧化剂得电子总数等于还原剂失电子总数)。例5判断下列反应哪些是氧化还原反应,哪些是非氧化还原反应?是氧化还
9、原反应的用单线桥(或双线桥)表示电子转移的方向和数目,并指出氧化剂和被氧化的物质。(1)Cl22KI=2KClI2(2)Ca(ClO)2CO2H2O=CaCO32HClO(3)3Cu8HNO3(稀)=3Cu(NO3)22NO4H2O解析: (1)中氯元素化合价由0下降到-1,被还原,Cl2是氧化剂;碘元素化合价由-1升高到0,被氧化,KI是被氧化的物质。(3)氮元素化合价由+5下降到+2,被还原,硝酸是氧化剂;铜元素化合价由0升高到+2,被氧化,铜是被氧化的物质;(2)中无元素化合价变化,是非氧化还原反应 答案:(1)(3)是氧化还原反应,(2)是非氧化还原反应。(1)中Cl2是氧化剂,KI是
10、被氧化的物质;(3)中硝酸是氧化剂,铜是被氧化的物质。五、探究铁及其化合物的氧化性和还原性(一)、铁的氧化物1FeO是一种_色粉末,不稳定,在空气里受热,就迅速被氧化成_。2Fe3O4是一种复杂的化合物,是具有_的_色晶体,俗称_。3Fe2O3是一种_色的粉末,俗称_,常用作_。_矿的主要成分是Fe2O3,是炼铁的主要原料。4FeO和Fe2O3都是_氧化物,与酸反应的离子方程式分别为:(1)_(2)_(二)、铁的氢氧化物1铁的氢氧化物的制备实验操作实验现象离子方程式(或化学方程式)试管中有_色沉淀生成Fe33OH=Fe(OH)3试管中先生成_色沉淀,迅速变成_色,最后变成_色2.Fe(OH)3
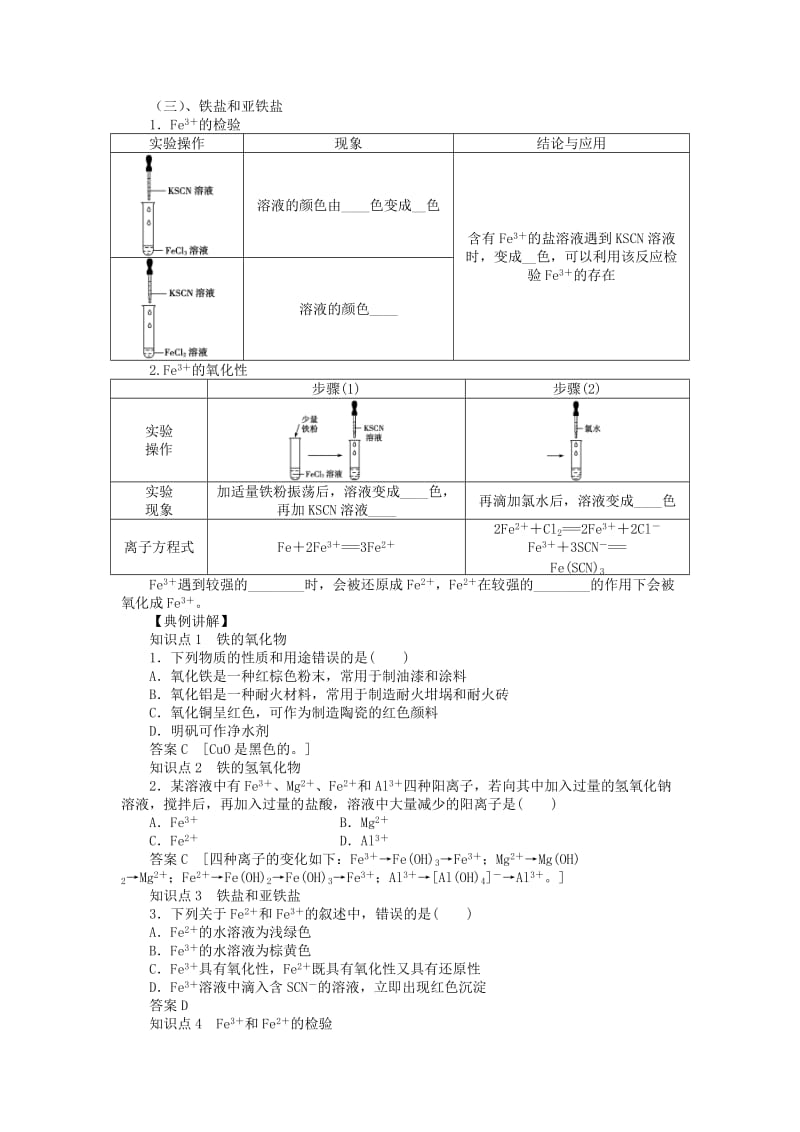
11、的分解加热Fe(OH)3时,它能失水生成_色的_粉末。化学方程式为:_。(三)、铁盐和亚铁盐1Fe3的检验实验操作现象结论与应用溶液的颜色由_色变成_色含有Fe3的盐溶液遇到KSCN溶液时,变成_色,可以利用该反应检验Fe3的存在溶液的颜色_2.Fe3的氧化性步骤(1)步骤(2)实验操作实验现象加适量铁粉振荡后,溶液变成_色,再加KSCN溶液_再滴加氯水后,溶液变成_色离子方程式Fe2Fe3=3Fe22Fe2Cl2=2Fe32ClFe33SCN=Fe(SCN)3Fe3遇到较强的_时,会被还原成Fe2,Fe2在较强的_的作用下会被氧化成Fe3。【典例讲解】知识点1铁的氧化物1下列物质的性质和用途
12、错误的是()A氧化铁是一种红棕色粉末,常用于制油漆和涂料B氧化铝是一种耐火材料,常用于制造耐火坩埚和耐火砖C氧化铜呈红色,可作为制造陶瓷的红色颜料D明矾可作净水剂答案CCuO是黑色的。知识点2铁的氢氧化物2某溶液中有Fe3、Mg2、Fe2和Al3四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是()AFe3 BMg2CFe2 DAl3答案C四种离子的变化如下:Fe3Fe(OH)3Fe3;Mg2Mg(OH)2Mg2;Fe2Fe(OH)2Fe(OH)3Fe3;Al3Al(OH)4Al3。知识点3铁盐和亚铁盐3下列关于Fe2和Fe3的叙述中,错误的是()A
13、Fe2的水溶液为浅绿色BFe3的水溶液为棕黄色CFe3具有氧化性,Fe2既具有氧化性又具有还原性DFe3溶液中滴入含SCN的溶液,立即出现红色沉淀答案D知识点4Fe3和Fe2的检验4要证明某溶液中不含Fe3,而可能含Fe2,进行如下实验操作时,最佳顺序是()加足量氯水加足量KMnO4溶液加少量KSCN溶液A BC D答案C本题检验方法的关键是Fe3遇SCN反应显红色,而Fe2遇SCN不显红色,加入KSCN溶液不显红色证明溶液中无Fe3,再加氯水,如有Fe2则被氧化为Fe3遇SCN反应显红色。KMnO4溶液也能氧化Fe2,但因其本身呈紫色,Fe3与SCN反应显红色不易观察。知识点5Fe3的氧化性
14、5印刷铜制线路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu2FeCl3=2FeCl2CuCl2,Fe2FeCl3=3FeCl2。现将一铜、铁混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是()A溶液中一定含FeCl3,固体一定是铁和铜B溶液中一定含FeCl2,固体一定含铜C溶液中一定含FeCl2、CuCl2,固体一定含铜D溶液中一定含FeCl2,固体一定是铁和铜答案B因为金属活动性FeCu,所以先发生Fe2FeCl3=3FeCl2,再发生Cu2FeCl3=2FeCl2CuCl2,充分反应后仍有
15、少量固体,该固体可能是Cu或Fe、Cu混合物;FeCl3反应完全,一定有FeCl2,故A错;B正确;C中CuCl2不一定含有,可能Fe没有反应完而FeCl3就已经反应完了,错误;D中固体中的铁可能已经反应完了,错误。6除去下列物质中所含的杂质(括号内为杂质),将选用的试剂和分离方法填在题后的横线上,并写出有关反应的离子方程式。(1)Fe2O3Fe(OH)3_;(2)Fe2O3(Al2O3)_;(3)FeCl3(FeCl2)_;(4)FeCl2(FeCl3)_; (5)FeCl2(CuCl2)_。答案(1)加热。2Fe(OH)3Fe2O33H2O(2)加入过量的NaOH溶液,过滤。Al2O32O
16、H3H2O=2Al(OH)4(3)通入足量的Cl2。2Fe2Cl2=2Fe32Cl(4)加入足量铁粉,过滤。2Fe3Fe=3Fe2(5)加入足量铁粉,过滤。FeCu2=Fe2Cu解析(1)根据Fe(OH)3的不稳定性,采用加热的方法,杂质可转化为被提纯物;(2)Al2O3能溶于NaOH溶液中,反应后过滤分离;(3)通入Cl2使杂质转化为被提纯物;(4)加入铁粉,将杂质转化为被提纯物;(5)加入铁粉,置换出铜,过滤加以分离。练基础落实1下列关于铁矿石的说法正确的是()A赤铁矿的主要成分是Fe3O4B铁矿石的主要成分与铁锈的主要成分相同C磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色DFeO俗
17、称铁红2现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是()A苹果汁中的Fe2变成Fe3B苹果汁中含有Cu2C苹果汁含有OHD苹果汁含有Fe33下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是()金属钠在纯氧中燃烧FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间FeCl3溶液中滴入KSCN溶液无水硫酸铜放入医用酒精中A BC D4将过量Na2O2投入FeCl2溶液中,可观察到的现象是()A有白色沉淀生成B有红褐色沉淀生成C溶液由浅绿色变为黄色D不可能有无色气体产生5能与Fe3反应,且能证明Fe3具有氧化性的是()SCNFeFe2CuZnOHA BC D练方法技巧6用
18、一定量的铁与足量的稀硫酸及足量的CuO制取单质铜,有人设计了以下两种方案:FeH2Cu CuOCuSO4Cu若按实验原则进行操作,则两者制得单质铜的量为()A一样多 B多 C多 D无法判断规律气体还原金属氧化物时,需先排净空气,且还原得的金属单质需在还原气氛中冷却。不要忽视这些实验的细节。练综合拓展7用下面两种方法可以制得白色的Fe(OH)2沉淀。方法一:用不含Fe3的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入_。(2)除去蒸馏水中溶解的O2常采用_的方法。(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的Na
19、OH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_。方法二:在如图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。(1)在试管中加入的试剂是_。(2)在试管中加入的试剂是_。(3)为了制得白色Fe(OH)2沉淀,在试管和中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_。(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_。强化训练一、选择题(以下各题只有1个正确答案) 1下列变化中,必须加入氧化剂才能发生的是 ( )ASO2S BSO32- SO2 CHCO32- CO32- DI-I22. 吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧
20、能加速人体衰老,被称为“生命杀手”,科学家尝试用Na2SeO3消除人体内活性氧,则Na2SeO3的作用是( )A氧化剂 B 还原剂 C既是氧化剂又是还原剂 D以上均不是3下列变化过程,属于还原反应的是( )A B C D 4对于司机酒后驾车,可对其呼出的气体进行检验而查出,所利用的化学反应如下:2CrO3(红色) + 3C2H5OH+3H2SO4=Cr2(SO4)3(绿色) + 3CH3CHO +6H2O 上述反应中的氧化剂是( )AH2SO4 BC2H5OH翰林汇 CCr2(SO4)3 D CrO35世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒
21、等方面有着广泛应用。则二氧化氯( )A是强氧化剂 B 是强还原剂C是离子化合物 D分子中氯为负1价6随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是( )A无水硫酸铜、蔗糖 B 硅胶、硫酸亚铁C食盐、硫酸亚铁 D 生石灰、食盐7. 在化学上,常用CaH2作为制取氢气的药剂,有关反应的化学方程式为:CaH22H2OCa(OH)22H2, 有下列四种判断,正确的是( ) A. H2O是氧化剂 B. CaH2中的氢元素被还原 C. H2只是氧化产物 D. 此反应中氧化剂与还原剂的物质的量之比是1:28Murad等
22、三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖。下列叙述不正确的是( ) ANO可以是某些含低价N物质氧化的产物 BNO不溶于水 CNO可以是某些含高价N物质还原的产物 DNO是红棕色气体 9今有三个氧化还原反应:2FeCl3+2KI=2FeCl2+2KCl+I22FeCl2+Cl2=2FeCl3 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O若溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是( )ACl2 BKMnO4 CFeCl3 DHCl10. 下列反应中
23、,盐酸既作还原剂,又表现出酸的性质的是( )A B C D 11盐酸和氯气都可以与铁反应,化学方程式: 2Fe+3Cl22FeCl3 Fe+2HCl=FeCl2 +H2从产物的比较可得出氯气比盐酸强的性质是( )A氧化性 B还原性 C酸性 D金属性12. 造纸工业常用Cl2漂白纸浆。漂白后的纸浆要用NaHSO3除去残留的Cl2,其反应为:Cl2 + NaHSO3 + H2O = NaCl+ HCl + H2SO4,在这个反应中,氧化产物与还原产物的物质的量之比( )A 1:1 B 1:2 C 2:1 D 2:313氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶
24、瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C 2 AlN + 3 CO 下列叙述正确的是( )A在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂B上述反应中生成 AlN的过程发生的反应是氧化反应C氮化铝中氮元素的化合价为3D氮化铝是氧化产物14下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反应的是( ) A烧菜用过的铁锅,经放置常出现红棕色斑迹B用煤气灶燃烧沼气主要成分为甲烷(CH4)为炒菜提供热量 C牛奶久置变质腐败 D把1 mL饱和三氯化铁溶液逐滴加入20 mL到沸水中,边加边振荡15在下列反应中,既是化合反应,又是氧化还原反应的
25、是( )A生石灰和水反应 B三氧化硫和水反应C铜和氯气反应 D氨气和氯化氢反应二、填空题:16. 过氧化氢H2O2,俗名双氧水,医疗上利用它的杀菌消毒作用来清洗伤口。将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫红色消失,此时双氧水表现出 性。17阅读下列材料后,回答相应问题:一个体重50Kg的健康人,含铁2g。这2g铁在人体中不是以单质金属的形式存在的,而是以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的二价铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的三价铁离子还原成二价铁离子,有利与铁的吸收。(1)人体中经常进行的转化,A中Fe2+做 剂,B中Fe3+做 剂。(2)“服用维生素C,可
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 灯具行业的新材料创新应用考核试卷
- 畜牧饲料成分与营养价值分析考核试卷
- 海洋生物多样性基因组学研究考核试卷
- 拍卖行业商业模式创新趋势考核试卷
- 灌溉技术对灌溉作物生长环境的影响考核试卷
- 广播发射机用rf信号发射器考核试卷
- 生物质能源在制药工业的替代研究考核试卷
- 河北省定州名校2025届高三年级下学期四调考试数学试题
- 玉石资源保护与可持续发展考核试卷
- 企业价值评估方法比较考核试卷
- 二年级下册语文《写字表》生字组词
- 《常见鱼类》课件
- 手术室的器械护士
- 劳动用工风险与规范培训
- 咯血病人的护理
- 安徽省2024年中考道德与法治真题试卷(含答案)
- 《公路建设项目文件管理规程》
- 2023年北京按摩医院招聘笔试真题
- 2024年山东省烟台市初中学业水平考试地理试卷含答案
- 中国生殖支原体感染诊疗专家共识(2024年版)解读课件
- 人教版小学三年级下期数学单元、期中和期末检测试题

评论
0/150
提交评论