



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
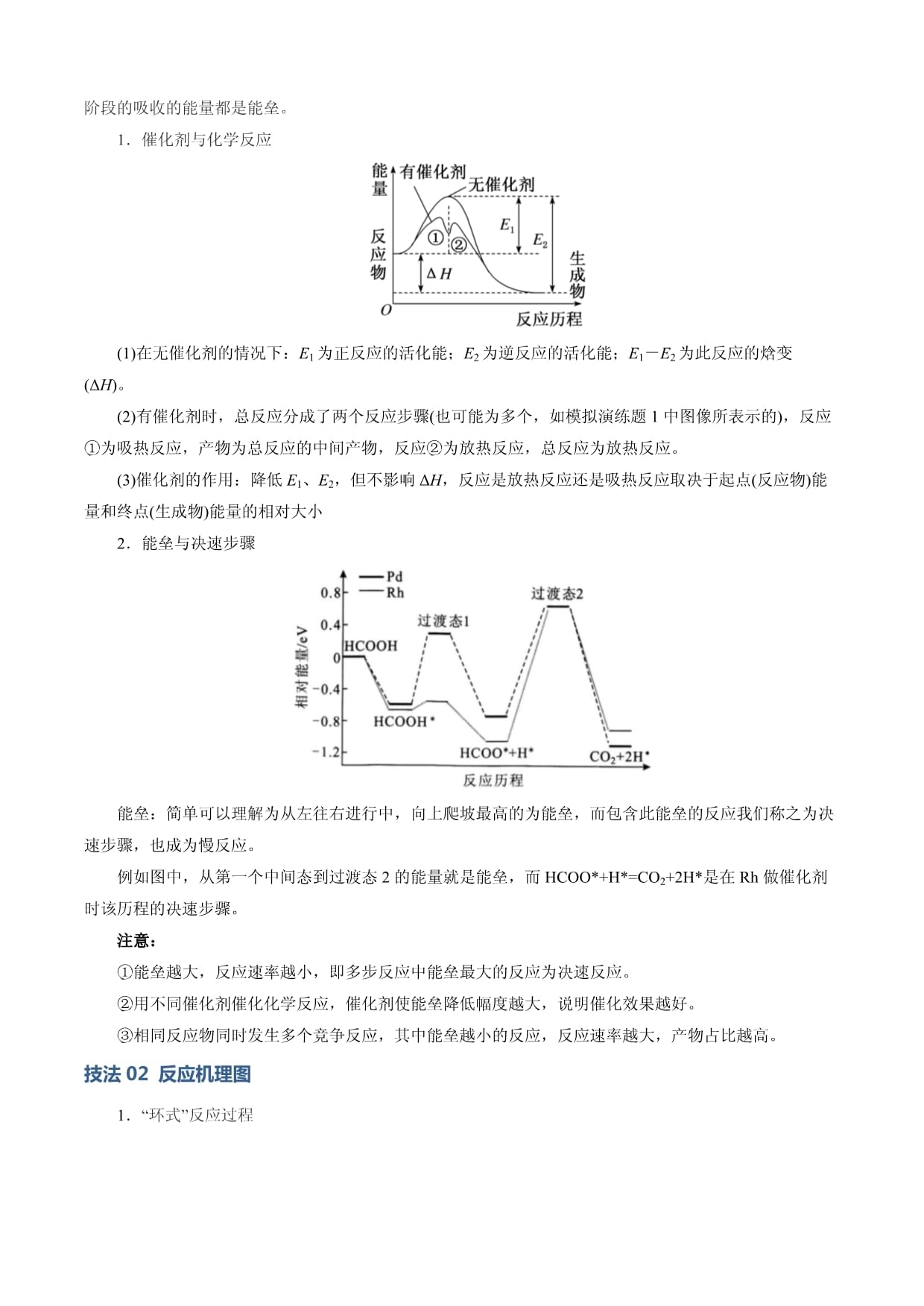
模板02化学反应机理图像分析识识·题型解读考情分析+命题预测/技巧解读明·模板构建答题模板+技巧点拨技法01基元反应和过渡态理论技法02反应历程能垒图技法03反应机理图通·模板运用真题示例+模板答题+变式训练练·模板演练最新模拟、预测考向本节导航新高考强调素养为本的情境化命题,高考通过真实情境的创设,考查学生的信息获取能力和创新思维。近几年高考中,化学反应机理(反应历程)试题频繁出现,主要以选择题的形式出现,题目主要以图示的形式来描述某一化学变化所经由的全部反应,就是把一个复杂反应分解成若干个反应,然后按照一定规律组合起来,从而达到阐述复杂反应的内在联系的目的。由于陌生度高,思维转化大,且命题视角在不断地创新和发展,成为大多数考生的失分点。所以,很有必要对这两类题型的解题模型进行掌握。新高考强调素养为本的情境化命题,高考通过真实情境的创设,考查学生的信息获取能力和创新思维。近几年高考中,化学反应机理(反应历程)试题频繁出现,主要以选择题的形式出现,题目主要以图示的形式来描述某一化学变化所经由的全部反应,就是把一个复杂反应分解成若干个反应,然后按照一定规律组合起来,从而达到阐述复杂反应的内在联系的目的。由于陌生度高,思维转化大,且命题视角在不断地创新和发展,成为大多数考生的失分点。所以,很有必要对这两类题型的解题模型进行掌握。第一步:仔细审题阅读题目获取对解题有价值的信息,排除无效信息,并作标记。第二步:明确类型判断图像类型是反应历程能垒图、反应机理循环图。第三步:提取信息提取图像关键信息,结合选项,分析判断。①反应历程能垒图:分析随反应历程发生的能量变化与物质变化;②反应机理图:分析机理图上物质的进出及转化关系。技法01基元反应和过渡态理论1.基元反应(1)大多数的化学反应往往经过多个反应步骤才能实现,其中每一步反应都称为基元反应。(2)基元反应速率方程对于基元反应aA+bB=gG+hH,其速率方程可写为v=k·ca(A)·cb(B)(其中k称为速率常数,恒温下,k不因反应物浓度的改变而变化),这种关系可以表述为基元反应的化学反应速率与反应物浓度以其化学计量数为指数的幂的乘积成正比。2.反应机理基元反应构成的反应序列称为反应历程(又称反应机理),基元反应的总和称为总反应。由几个基元反应组成的总反应也称复杂反应。例如H2(g)+I2(g)=2HI(g),它的反应历程有如下两步基元反应:①I2I·+I·(快)②H2+2I·=2HI(慢)其中慢反应为整个反应的决速步骤。3.过渡态理论(1)化学反应并不是通过反应物分子的简单碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能的过渡态,处于过渡态的分子叫做活化络合物。活化络合物是一种高能量的不稳定的反应物原子组合体,它能较快地分解为新的能量较低的较稳定的生成物。(2)活化能(Ea)是处在过渡态的活化络合物分子平均能量与反应物分子平均能量的差值。4.催化剂与反应历程(1)催化剂对反应速率的影响催化剂是通过降低化学反应所需的活化能来增大化学反应速率的。有催化剂参与的反应,活化能(Ea1)较小,反应速率较大;没有催化剂参与的反应,活化能(Ea1')较大,反应速率较小。使用催化剂同时降低了正反应和逆反应的活化能,但反应的ΔH不变。(2)加入催化剂后的反应历程如图所示:反应A+B→AB的活化能为Ea,加入催化剂K后,反应分两步进行:①A+K→AK
活化能为Ea1(慢反应)②AK+B→AB+K
活化能为Ea2(快反应)总反应:A+Beq\o(→,\s\up7(K))AB活化能为Ea1加入催化剂K后,两步反应的活化能Ea1和Ea2均小于原反应的活化能Ea,因此反应速率加快。由于Ea1>Ea2,第1步反应是慢反应,是决定整个反应快慢的步骤,称为“定速步骤”或“决速步骤”,第1步反应越快,则整体反应速率就越快。因此对总反应来说,第一步反应的活化能Ea1就是在催化条件下总反应的活化能。5.教材中的能量变化图示如下:反应历程与活化能催化剂对反应历程与活化能影响人教版新教材鲁科版新教材苏教版技法02反应历程能垒图在化学反应过程中,反应前后能量会发生变化。能垒指的是由于化学反应的成功发生对于反应物到达能量高的过渡态的过程的依赖性而产生的一个“阻碍”,只有一部分有足够能量的分子才能跨越能垒进行反应,每一个小的分步反应的从较低能量到过渡态所吸收的能量,可以理解成ΔH-t图中“爬坡”的阶段,这些阶段的吸收的能量都是能垒。1.催化剂与化学反应(1)在无催化剂的情况下:E1为正反应的活化能;E2为逆反应的活化能;E1-E2为此反应的焓变(ΔH)。(2)有催化剂时,总反应分成了两个反应步骤(也可能为多个,如模拟演练题1中图像所表示的),反应①为吸热反应,产物为总反应的中间产物,反应②为放热反应,总反应为放热反应。(3)催化剂的作用:降低E1、E2,但不影响ΔH,反应是放热反应还是吸热反应取决于起点(反应物)能量和终点(生成物)能量的相对大小2.能垒与决速步骤能垒:简单可以理解为从左往右进行中,向上爬坡最高的为能垒,而包含此能垒的反应我们称之为决速步骤,也成为慢反应。例如图中,从第一个中间态到过渡态2的能量就是能垒,而HCOO*+H*=CO2+2H*是在Rh做催化剂时该历程的决速步骤。注意:①能垒越大,反应速率越小,即多步反应中能垒最大的反应为决速反应。②用不同催化剂催化化学反应,催化剂使能垒降低幅度越大,说明催化效果越好。③相同反应物同时发生多个竞争反应,其中能垒越小的反应,反应速率越大,产物占比越高。技法02反应机理图1.“环式”反应过程“入环”的物质为反应物,如图中的;位于“环上”的物质为催化剂或中间体,如图中的;“出环”的物质为生成物,如图中的;由反应物和生成物可快速得出总反应方程式。2.催化剂与中间产物1,2-丙二醇脱氧脱水反应的催化循环机理催化剂:在连续反应中从一开始就参与了反应,在最后又再次生成,所以仅从结果上来看似乎并没有发生变化,实则是消耗多少后续又生成了多少。中间产物:在连续反应中为第一步的产物,在后续反应中又作为反应物被消耗,所以仅从结果上来看似乎并没有生成,实则是生成多少后续有消耗多少。在机理图中,先找到确定的反应物,反应物一般是通过一个箭头进入整个历程的物质,(产物一般多是通过一个箭头最终脱离这个历程的物质)与之同时反应的就是催化剂,并且经过一个完整循环之后又会生成;中间产物则是这个循环中的任何一个环节。如下图中,MoO3则是该反应的催化剂,图中剩余的三个物质均为中间产物。类型01反应历程能垒图1.(2024·北京卷)苯在浓HNO3和浓H2SO4作用下,反应过程中能量变化示意图如下。下列说法不正确的是()A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物ⅡB.X为苯的加成产物,Y为苯的取代产物C.由苯得到M时,苯中的大π键没有变化D.对于生成Y的反应,浓H2SO4作催化剂【答案】C【第一步明确类型】该图像是反应历程能垒图【第二步提取信息】1.(2024·贵州卷)AgCN与CH3CH2Br可发生取代反应,反应过程中CN-的C原子和N原子均可进攻CH3CH2Br,分别生成腈(CH3CH2CN)和异腈(CH3CH2NC)两种产物。通过量子化学计算得到的反应历程及能量变化如图(TS为过渡态,Ⅰ、Ⅱ为后续物)。由图示信息,下列说法错误的是A.从CH3CH2Br生成CH3CH2CN和CH3CH2NC的反应都是放热反应B.过渡态TS1是由CN-的C原子进攻CH3CH2Br的α-C而形成的C.Ⅰ中“N--Ag”之间的作用力比Ⅱ中“C--Ag”之间的作用力弱D.生成CH3CH2CN放热更多,低温时CH3CH2CN是主要产物2.(2024·安徽卷)某温度下,在密闭容器中充入一定量的X(g),发生下列反应:X(g)Y(g)(ΔH1<0),Y(g)Z(g)(ΔH2<0),测得各气体浓度与反应时间的关系如图所示。下列反应进程示意图符合题意的是A B.C. D.类型02反应机理图1.(2023·湖南卷)N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某Ru(Ⅱ)催化剂(用[L-Ru-NH3]+表示)能高效电催化氧化NH3合成N2H4,其反应机理如图所示。下列说法错误的是A.Ru(Ⅱ)被氧化至Ru(Ⅲ)后,配体NH3失去质子能力增强B.M中Ru的化合价为+3C.该过程有非极性键的形成D.该过程的总反应式:4NH3-2e-=N2H4+NH4+【答案】B【第一步明确类型】该图像是反应机理图【第二步提取信息】1.(2024·北京卷)可采用Deacon催化氧化法将工业副产物HCl制成Cl2,实现氯资源的再利用。反应的热化学方程式:4HCl(g)+O2(g)eq\o(=,\s\up7(CuO))2Cl2(g)+2H2O(g)ΔH=-114.4kJ·mol-1。下图所示为该法的一种催化机理。下列说法不正确的是()A.Y为反应物HCl,W为生成物H2OB.反应制得1molCl2,须投入2molCuOC.升高反应温度,HCl被O2氧化制Cl2的反应平衡常数减小D.图中转化涉及的反应中有两个属于氧化还原反应2.(2023·新课标卷)“肼合成酶”以其中的配合物为催化中心,可将与转化为肼(),其反应历程如下所示。下列说法错误的是A.、和均为极性分子B.反应涉及、键断裂和键生成C.催化中心的被氧化为,后又被还原为D.将替换为,反应可得1.(2024·浙江卷)酯在NaOH溶液中发生水解反应,历程如下:已知:①②RCOOCH2CH3水解相对速率与取代基R的关系如下表:取代基RCH3ClCH2Cl2CH水解相对速率12907200下列说法不正确的是A.步骤I是OH-与酯中Cδ+作用B.步骤III使I和Ⅱ平衡正向移动,使酯在NaOH溶液中发生的水解反应不可逆C.酯的水解速率:FCH2COOCH2CH3>ClCH2COOCH2CH3D.与OH-反应、与18OH-反应,两者所得醇和羧酸盐均不同2.(2024·甘肃卷)甲烷在某含催化剂作用下部分反应的能量变化如图所示,下列说法错误的是A.B.步骤2逆向反应的C.步骤1的反应比步骤2快D.该过程实现了甲烷的氧化3.如图(表示活化能)是与生成的部分反应过程中各物质的能量变化关系图,下列说法正确的是A.题述反应为吸热反应B.升高温度,、均减小,反应速率加快C.第一步反应的方程式可表示为D.第一步反应的速率大于第二步反应的速率4.甲酸常用于橡胶、医药等工业。在一定条件下可分解生成和,在无、有催化剂条件下的能量与反应历程的关系如下图所示,下列说法正确的是A.B.可以通过和计算的总键能C.途径二中参与反应,是该反应过程的中间产物D.途径二中反应的快慢由生成的速率决定5.已知催化反应历程如下图所示,催化历程中有参与。下列有关该反应的说法正确的是A.步骤①的速率常数大于步骤②B.反应历程中存在非极性键的断裂和形成C.催化历程中,仅氧元素的化合价未发生变化D.步骤②的热化学方程为:
6.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下(已知O2和Cl2的相对能量为0),下列说法错误的是A.B.可计算键能为C.相同条件下,O3的平衡转化率:历程Ⅱ=历程ⅠD.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g)=O2(g)+Cl(g)ΔH=(E4-E5)kJ∙mol−17.利用计算机技术测得乙炔()在催化作用下生成的反应历程及相对能量变化如图所示。下列说法正确的是A.的B.反应历程中能量最高的物质中含有两种官能团C.升高反应体系的温度可以提高乙炔的平衡转化率D.决速步骤的反应为8.某酮和甲胺的反应机理及能量图像如图所示:下列说法错误的是A.该历程中为催化剂,故浓度越大,反应速率越快B.该历程中发生了加成反应和消去反应C.反应过程中有极性键的断裂和生成D.该历程中制约反应速率的反应为反应②9.一定条件下,丙烯与反应生成和的反应历程如图所示。【已知Arrhenius经验公式为(为活化能,k为速率常数,R和C为常数)】,下列说法正确的是A.反应的为B.丙烯与的加成反应为放热反应,所以该反应一定能自发进行C.其他条件不变,适当升高温度可以提高加成产物的比例D.根据该反应推测,丙烯与加成的主要产物为2-溴丙烷10.如果在反应体系中只有底物和溶剂,没有另加试剂,那么底物就将与溶剂发生反应,溶剂就成了试剂,这样的反应称为溶剂解反应。如三级溴丁烷在乙醇中可以发生溶剂解反应,反应的机理和能量进程图如下所示:下列说法不正确的是A.三级溴丁烷在乙醇中的溶剂解反应属于取代反应B.不同卤代烃在乙醇中发生溶剂解反应的速率取决于相应碳卤键的键能C.该反应机理中的中间产物中的碳原子有两种杂化方式D.卤代烃在发生消去反应时可能会有醚生成11.为早日实现“碳中和碳达峰”目标,科学家提出用钌(Ru)基催化剂催化和反应生成HCOOH.反应机理如图所示,已知当生成46g液态HCOOH时放出31.2kJ的热量。下列说法正确的是A.反应历程中存在极性键、非极性键的断裂与形成B.物质Ⅰ为该反应的催化剂,物质Ⅱ、Ⅲ为中间产物C.催化剂能降低活化能,加快反应速率,改变反应热,从而提高转化率D.通过和反应制备液态HCOOH,每转移1mol,放出31.2kJ的热量12.氢能是一种重要的清洁能源,由可以制得。在催化剂作用下,催化释放氢的反应机理和相对能量的变化情况分别如图1和图2所示。下列叙述正确的是A.催化释放氢的过程中有非极性键的断裂与形成B.催化释放氢反应除生成外,还生成C.在催化剂表面解离键比解离键难D.催化释放氢的热化学方程式为:13.我国科研团队研究电催化合成氨反应[
]时,发现不同电解质溶液对催化历程的影响如图所示,其中吸附在催化剂表面的物种用*标注。下列说法错误的是A.反应放热是合成氨反应自发进行的主要助力B.选用作电解质的反应速率比选用的快C.
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 抗凝治疗实施过程中的安全保障
- 导尿管安全置入与护理规范
- 皮肤护理中的感染预防策略
- 2025年农艺工《动物、家畜繁殖学》专业技能知识考试题库与答案
- 无菌技术在护理中的安全应用
- 心脏病患者的饮食护理指导查房
- 输液反应处理的应急护理方案
- 广西十一月联考数学试卷
- 2025年吉林省安图县事业单位公开招聘辅警考试题带答案分析
- 巨变时代的组织管理课件
- 电气设备经典故障案例分析与处理
- QB/T 2660-2024 化妆水(正式版)
- 2023年运输公司安全生产管理制度(4篇)
- T-CACE 0109-2023 产业园区减污降碳协同增效评价指标体系
- OTA代运营协议文档
- 《龙族》读书交流party
- 荣誉室布置方案
- 小学生海洋生物知识讲课
- 工程竣工验收合同
- 离心式压缩机-新课件
- 湖南大学金融与统计学院《435保险专业基础》专业硕士历年考研真题汇编

评论
0/150
提交评论