



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
2021-2022学年高考化学模拟试卷
考生请注意:
1.答题前请将考场、试室号、座位号、考生号、姓名写在试卷密封线内,不得在试卷上作任何标记。
2.第一部分选择题每小题选出答案后,需将答案写在试卷指定的括号内,第二部分非选择题答案写在试卷题目指定的
位置上。
3.考生必须保证答题卡的整洁。考试结束后,请将本试卷和答题卡一并交回。
一、选择题(每题只有一个选项符合题意)
1、常温下,HNO2的电离平衡常数为K=4.6xl0-4(已知〃了=2.14),向20mL0.01mol・LrHNO2溶液中逐滴加入
相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
A.X=20
B.a点溶液中c(H+)=2.14xl0-3molL-1
C.a、b、c、d四点对应的溶液中水的电离程度逐渐减小
+
D.b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na)>c(NO;)
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2sO2(g)+O2(g)=2S(h(g)的平衡常数K与温度和压强的关系
C.据图丙,若除去CuSCh溶液中的Fe3+可向溶液中加入适量CuO至pH=4左右
D.图丁表示常温下向20mL0.001mol/L的醋酸溶液中滴加O.OOlmol/I,的NaOH溶液,溶液的pH随NaOH溶液体积
的变化关系
3、“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝、帛的使用有着悠久的历史,下列说
法错误的是()
A.丝的主要成分属于天然有机高分子化合物,丝绸制品不宜使用含酶洗衣粉洗涤
B.《墨子・天志》中记载“书之竹帛,镂之金石”。其中的“金”指的是金属,“石”指的是陶瓷、玉石等
C.《考工记》载有“沫帛”的方法,即利用“灰”(草木灰)和“蜃”(贝壳灰)混合加水所得液体来洗涤丝、帛。
这种液体能洗涤丝、帛主要是因为其中含有K2c03
D.《天工开物》记载“人贱者短褐、臬裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为臬、麻、荷、葛……”
文中的“臬、麻、荷、葛”属于纤维素
4、
2018年11月4日凌晨,福建泉州泉港区发生“碳九”泄露,对海洋环境造成污染,危害人类健康。“碳九”芳克主要成分
(b)、g-'CH,(C)等,下列有关三种上述物质说法错误的是
A.a、b、c互为同分异构体B.a、b、c均能与酸性高镒酸钾溶液反应
C.a中所有碳原子处于同一平面D.Imolb最多能与4m01%发生反应
5、能证明亚硫酸钠样品部分变质的试剂是
A.硝酸领,稀硫酸B.稀盐酸,氯化领
C.稀硫酸,氯化钢D.稀硝酸,氯化领
6、室温下,向100mL饱和的H2s溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S1+2H2。,
测得溶液pH与通入SO2的关系如图所示。下列有关说法正确的是
A.整个过程中,水的电离程度逐渐增大
B.该温度下H2s的数量级为KT,
C.曲线y代表继续通入SO2气体后溶液pH的变化
c(HSO;)
D.a点之后,随SO2气体的通入,的值始终减小
C(H2SO3)
7、下列操作不能达到目的的是
选项目的操作
A.配制100mL1.0mol/LC11SO4溶液将25gCUSO4-5H2O溶于100mL蒸储水中
B.除去KNCh中少量NaCl将混合物制成热的饱和溶液,冷却结晶,过滤
C.在溶液中将MnCh-完全转化为Mn2+向酸性KMnO』溶液中滴加H2O2溶液至紫色消失
D.确定NaCl溶液中是否混有Na2c03取少量溶液滴加CaCL溶液,观察是否出现白色浑浊
A.AC.CD.D
8、下列装置可达到实验目的是
证明酸性:醋酸〉碳酸〉苯酚
制备乙酸丁酯
昌
二
苯萃取碘水中12,分出水层后的操作
用NH4cl饱和溶液制备NH4a晶体
9、下列关于有机化合物的叙述中正确的是
A.用浸泡过高铳酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
B.汽油、柴油、花生油都是多种碳氢化合物的混合物
OOH
C.有机物Imol最多可与3mO1H2发生加成反应
D.分子式为G5Hl的同分异构体中不可能含有两个苯环结构
10、苹果酸(H2MA,Kai=1.4xlOJ;Ka2=L7xlO-5)是一种安全的食品保鲜剂,H2MA分子比离子更易透过细胞膜而杀灭
细菌。常温下,向20mL0.2mol/LH2MA溶液中滴加0.2mol/LNaOH溶液。根据图示判断,下列说法正确的是
A.b点比a点杀菌能力强
B.曲线ID代表HMA-物质的量的变化
C.MA?-水解常数Kh®7.14xl012
D.当V=30mL时,溶液显酸性
11、下列实验操作能产生对应实验现象的是
实验操作实验现象
A用玻璃棒蘸取氯化镀溶液,点在红色石蕊试纸上试纸变蓝色
向盛有K2Cr2O7溶液的试管中滴加浓硫酸,充分
B溶液由橙黄色逐渐变为黄色
振荡
向FeCh溶液中加入KI溶液,再加入苯,充分
C溶液分层,上层呈紫色
振荡,静置
向蔗糖在硫酸催化下水解后的溶液中,加入新制
D出现砖红色沉淀
氢氧化铜悬浊液并加热
A.AB.BC.CD.D
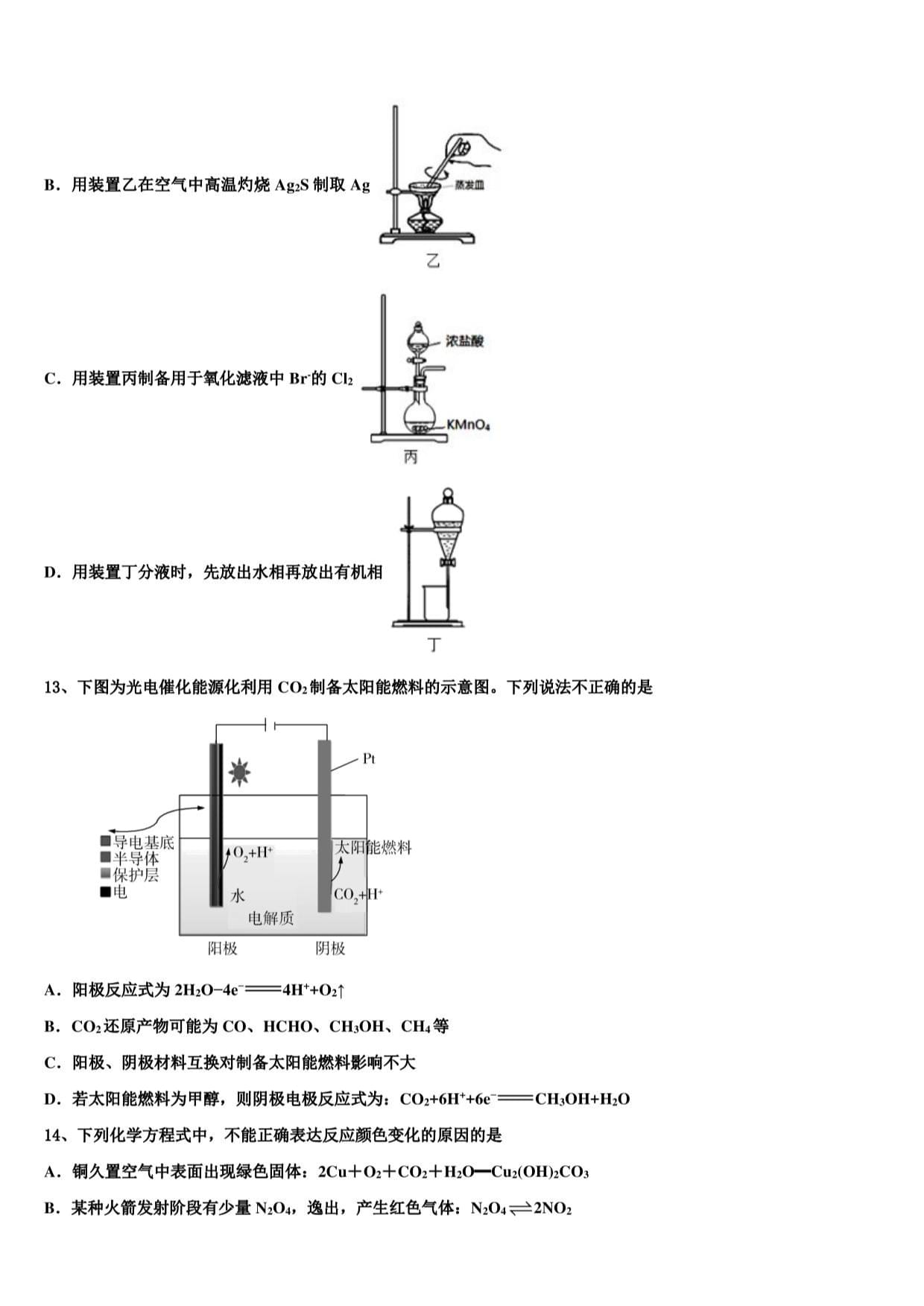
12、实验室从废定影液[含Ag(S2(h)23和Br-等]中回收Ag和Bn的主要步骤为:向废定影液中加入Na2s溶液沉银,过
滤、洗涤及干燥,灼烧Ag2s制Ag;制取CL并通入滤液氧化Bis用苯萃取分液。其中部分操作的装置如图所示,下
列叙述正确的是()
A.用装置甲分离Ag2s时,用玻璃棒不断搅拌
甲
B.用装置乙在空气中高温灼烧Ag2s制取Ag第胸
乙
C.用装置丙制备用于氧化滤液中Br的CL
D.用装置丁分液时,先放出水相再放出有机相
T
13、下图为光电催化能源化利用CO2制备太阳能燃料的示意图。下列说法不正确的是
+
A.阳极反应式为2H2O-4e=^4H+O2T
B.CO2还原产物可能为CO、HCHO、CH3OH、CH4等
C.阳极、阴极材料互换对制备太阳能燃料影响不大
+
D.若太阳能燃料为甲醇,则阴极电极反应式为:CO2+6H+6e^^CH3OH+H2O
14、下列化学方程式中,不能正确表达反应颜色变化的原因的是
A.铜久置空气中表面出现绿色固体:2Cu+Ch+CO2+H2dCu2(OH)2cCh
B.某种火箭发射阶段有少量N2O4,逸出,产生红色气体:N2O4U2NO2
C.FeSO4•7H2。在空气中久置变黄:2FeSO4•7H2。=FezCh+SCht+SO3t+14H2O
D.SO2通入KMnth溶液中,溶液紫色逐渐褪去:5so2+2KM11O4+2H2O-K2so4+2MnSCh十2H2sC>4
15、水凝胶材料要求具有较高的含水率,以提高其透氧性能,在生物医学上有广泛应用。由N-乙烯基嗽咯烷酮(NVP)
和甲基丙烯酸P-羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
Q-ow
L-OCHvCHrOH
CH2«C-O-CH2-CH2-OH
OCH=CHj
HEMA
商聚物A
下列说法正确的是
A.NVP具有顺反异构
B.高聚物A因含有-OH而具有良好的亲水性
C.HEMA和NVP通过缩聚反应生成高聚物A
D.制备过程中引发剂浓度对含水率影响关系如图,聚合过程中引发剂的浓度越高越好
•flVMtlt(%>
明友K及川会京牛箭密,
16、对下图两种化合物的结构或性质描述正确的是
pi.
(.H
A.不是同分异构体
B.分子中共平面的碳原子数相同
C.均能与溟水反应
D.可用红外光谱区分,但不能用核磁共振氢谱区分
二、非选择题(本题包括5小题)
17、化合物H是一种除草剂,可由下列路线合成(部分反应条件略去):
(1)B和A具有相同的实验式,分子结构中含一个六元环,核磁共振氢谱显示只有一个峰,则B的结构简式为,
A-B的反应类型是.
(2)C中含氧官能团的名称是;C1CH2COOH的名称(系统命名)是.
(3)D-E所需的试剂和条件是o
(4)F-G的化学方程式是.
(5)1是E的一种同分异构体,具有下列结构特征:①苯环上只有一个取代基;②是某种天然高分子化合物水解的产物。
I的结构简式是»
(6)设计由乙醇制备,“u的合成路线.(无机试剂任选)。
IKH(风Hi
18、白藜芦醇(结构简式:)属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的
H0
作用。某课题组提出了如下合成路线:
OH
已知:①RCHaRr+LJR~CHQ叫0
RCH2-CHR*
COOCHJCH2OHCH20H
ANaBH4ABBr3
VCH^OH*Q
OCH3OCH3OH
根据以上信息回答下列问题:
⑴白藜芦醇的分子式是
(2)CTD的反应类型是:;ETF的反应类型是,
(3)化合物A不与FeCb溶液发生显色反应,能与NaHCCh溶液反应放出CO2,推测其核磁共振谱「H-NMR)中显示不
同化学环境的氢原子个数比为(从小到大)。
(4)写出A-B反应的化学方程式:;
(5)写出结构简式;D、E;
(6)化合物CMOQ^CH。符合下列条件的所有同分异构体共种,
①能发生银镜反应;②含苯环且苯环上只有两种不同化学环境的氢原子。
写出其中不与碱反应的同分异构体的结构简式:。
19、某研究性学习小组的同学设计了如图装置制取溟苯和溟乙烷:
己知:乙醇在加热的条件下可与HBr反应得到溟乙烷(CH3cH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂)沸点(C)密度(g/mL)
乙醇与水互溶,易溶于有机溶剂78.50.8
溟乙烷难溶于水,易溶于有机溶剂38.41.4
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为»
(2)根据实验目的,选择下列合适的实验步骤:①一(选填②③④等)。
①组装好装置,(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溟的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液澳,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸储水封住管底,
向水槽中加入冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:.
(4)冰水的作用是o
(5)反应完毕后,U形管内的现象是;分离溟乙烷时所需的玻璃仪器有o
20、乙苯是主要的化工产品。某课题组拟制备乙苯:查阅资料如下:
①几种有机物的沸点如下表:
有机物苯澳乙烷乙苯
沸点/C8038.4136.2
②化学原理:[]+CH3cH2Br黑:>①CH2cH3+HBro
③氯化铝易升华、易潮解。
I.制备氯化铝
甲同学选择下列装置制备氯化铝(装置不可重复使用):
(1)本实验制备氯气的发生装置的玻璃仪器有种。
(2)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当___________时(填实验现象)点燃F处酒精
灯。
(3)气体流动方向是从左至右,装置导管接口连接顺序a—一k—i-f-g-.
(4)D装置存在明显缺陷,若不改进,导致的实验后果是.
H.制备乙苯
乙同学设计实验步骤如下:
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溟乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(5)本实验加热方式宜采用(填“酒精灯直接加热”或“水浴加热
(6)确认本实验A中已发生了反应的试剂可以是一。
A硝酸银溶液B石蕊试液
C品红溶液D氢氧化钠溶液
(7)提纯产品的操作步骤有:
①过滤;②用稀盐酸洗涤;③少量蒸憎水水洗④加入大量无水氯化钙;⑤用大量水洗;⑥蒸储并收集136.2C储分⑦分
液。
操作的先后顺序为⑤⑦—⑦—©(填其它代号)。
21、合成气(CO、出)是一种重要的化工原料气。合成气制取有多种方法,如煤的气化、天然气部分氧化等。回答下列
问题:
L合成气的制取
(1)煤的气化制取合成气。
已知:①H2O(g)=H2O(l)AH=-44kJ/mol;
②部分物质的燃烧热:
物质C(»)CO<g)H,(g)
燃烧热'<kj393.5283.0285.8
则反应C(s)+H2O(g);=^CO(g)+H2(g)的△"=—kJ/rnoL
(2)天然气部分氧化制取合成气。
如果用O2(g)、H2O(g),CCh(g)混合物氧化CHKg),欲使制得的合成气中CO和Eh的物质的量之比为1:2,则原混合
物中HWXg)与CO2(g)的物质的量之比为一。
n.利用合成气合成乙醇
在一定条件下,向容积为2L的恒容密闭容器中投入2molCO和4moiHz,发生反应:
2CO(g)+4H2(g)^=±CH3CH2OH(g)+H2O(g),
(1)写出该反应的平衡常数表达式
(2)下列情况能作为判断反应体系达到平衡的标志是_(填序号)。
A.压强不再变化B.平均摩尔质量不再变化C.密度不再变化
(3)反应起始压强记为“、平衡后记为P2,平衡时H2的转化率为(用含Pl、P2的代数式表示)
m.合成乙醇的条件选择
为探究合成气制取乙醇的适宜条件,某科研团队对不同温度、不同Rh质量分数的催化剂对co的吸附强度进行了研
究,实验数据如图。co的非离解吸附是指co尚未乙醇化,离解吸附是指co已经乙醇化。
不同Rh质H分数的催化剂对
co的啜附与温域的K系
(1)结合图像从低温区、高温区分析温度对CO吸附强度的影响_;以及催化剂对CO吸附强度的影响
(2)用Rh作催化剂,合成气制取乙醇的适宜温度是
参考答案
一、选择题(每题只有一个选项符合题意)
1、B
【解析】
A.向20mL0.01mobL-'的HNCh溶液中逐滴加入相同浓度的NaOH溶液,若恰好反应需要氢氧化钠溶液体积20mL,
C点是溶液呈中性,溶质为HNO2、NaNfh混合溶液,X<20,A项错误;
c2(H+)C2(H+)
B.由HNO2=H++NO21K=~~~―-~j贝!]4.6xl0Ta___\,得到c(H*)=2.14x10-3m。]/"
c(HNQ)c(HNO)O.Olmol/L
B项正确;
C.c点是溶液呈中性,溶质为HNCh、NaNCh混合溶液;氢氧化钠溶液体积为20mL时恰好反应,那么a到恰好完全
反应时,水的电离程度逐渐增大;d点从图中读不出是在恰好反应之前还是恰好反应之后,C项错误;
+
D.b点溶液为HNO2、NaNCh混合溶液,且浓度比为1:1,由NO2-+H2O=HNO2+OH\HNO2?iH+NO2,电离程度
大于水解程度,可知溶液呈酸性,微粒浓度大小为c(NO2-)>c(Na+)>c(HNO2),D项错误;
答案选B。
2、C
【解析】
本题主要考查化学平衡结合图像的运用。
A.使用催化剂化学反应速率加快;
B.平衡常数是温度的函数,温度不变,平衡常数不变;
C.由图像可知pH=4左右F/+完全沉淀,Cu"还未开始沉淀;
D.O.OOlmol/L的醋酸溶液PH>3。
【详解】
A.使用催化剂化学反应速率加快,所以正反应速率的虚线在实线的上方,故A错误;
B.平衡常数是温度的函数,温度不变,平衡常数不变,所以温度相同而压强不同时,两者的平衡常数相同,故B错
误;
C.由图像可知pH=4左右Fe3+完全沉淀,C/+还未开始沉淀,由于CuO+ZH^Cu"+lW反应发生,所以加入CuO可以调
节PH=4左右,此时Fe'*完全沉淀,过滤即可,故C项正确;
D.0.001mol/L的醋酸溶液PH>3,图像中起点PH=3,故D项错误;
答案选C。
3、C
【解析】
A、丝的主要成分为蚕丝,属于蛋白质是一种天然有机高分子化合物,酶会加速蛋白质的水解,破坏丝绸制品,故A
正确;
B、古代记事常常刻于金属、陶瓷、玉器之上,故B正确;
C、草木灰中的碳酸钾与贝壳灰中的氧化钙溶于水生成的氢氧化钙与碳酸钾反应生成了氢氧化钾,故C错误;
IK草木的主要成分是纤维素,故D正确;
答案C。
4、A
【解析】
A.a、c分子式是C9H12,结构不同,是同分异构体;而b分子式是C9H8,b与a、c的分子式不相同,因此不能与a、c
称为同分异构体,A错误;
B.a、b、c三种物质中与苯环连接的C原子上都有H原子,且b中含碳碳双键,因此均能被酸性高镒酸钾溶液氧化,
B正确;
C.苯分子是平面分子,a中三个甲基的C原子取代苯分子中H原子的位置与苯环的碳原子相连,所以一定在苯环的平
面内,C正确;
D.b分子内含有1个苯环和1个碳碳双键,所以Imolb最多能与4m0IH2发生反应,D正确;
故合理选项是A»
5、B
【解析】
在空气中,亚硫酸钠易被氧化成硫酸钠。证明亚硫酸钠样品部分变质,须检验样品中的亚硫酸根和硫酸根。
【详解】
A.样品溶液中加入稀硫酸生成刺激性气味的气体,可证明有亚硫酸根,但引入硫酸根会干扰硫酸根的检验。酸性溶液
中,硝酸钢溶液中硝酸根会将亚硫酸根氧化为硫酸根,A项错误;
B.样品溶液中加入过量稀盐酸,生成刺激性气味的气体,可检出亚硫酸根。再滴入氯化钢溶液有白色沉淀生成,证明
有硫酸根离子,B项正确;
C.样品溶液中加入稀硫酸,可检出亚硫酸根,但引入的硫酸根会干扰硫酸根检验,C项错误;
D.稀硝酸能将亚硫酸根氧化为硫酸根,干扰硫酸根检验,D项错误。
本题选B。
【点睛】
检验样品中同时存在亚硫酸根和硫酸根,所选试剂不能有引入硫酸根、不能将亚硫酸根氧化为硫酸根,故不能用稀硫
酸和稀硝酸。
6、C
【解析】
A.由图可知,a点表示SO2气体通入112mL即0.005mol时pH=7,溶液呈中性,说明气体与H2s溶液恰好完全
反应,可知饱和H2s溶液中溶质物质的量为O.Olmol,c(H2S)=0.1mol/L,a点之前为H2s过量,a点之后为SO2过量,
溶液均呈酸性,酸抑制水的电离,故a点水的电离程度最大,水的电离程度先增大后减小,故A错误;
+2
B.由图中起点可知O.lmol/LH2s溶液电离出的c(H+)=l(T4」mol/L,电离方程式为H2S=H++HS\HS#H+S5以第
1x10-4-1
一步为主,根据平衡常数表达式算出该温度下H2s的Ka户U—二「川0”2,数量级为10%故B错误;
0.1-10-41
C.当SO2气体通入336mL时,相当于溶液中的c(H2so3)=0.1mol/L,因为H2sO3酸性强于H2S,故此时溶液中对应
的pH应小于4.1,故曲线y代表继续通入Sth气体后溶液pH的变化,故C正确;
D.根据平衡常数表达式可知|1=与;,a点之后,随SO2气体的通入,c(H+)增大,当
c(H2so3)C(H2SO3)C(H)c(H)
通入的SO2气体达饱和时,c(H+)就不变了,Ri也是一个定值,I的值保持不变,故D错误;
c(H2so3)
答案选c。
7、A
【解析】
A、将25gCuSO#5H2O溶于100mL蒸馅水中所得溶液的体积不是0.1L,所以不能实现目的,A错误;
B、硝酸钾和氯化钠的溶解度受温度影响相差大,因此将混合物制成热的饱和溶液,冷却结晶,过滤即可除去KNO.,
中少量NaCl,B正确;
C、高铳酸钾具有强氧化性,能把双氧水氧化为氧气,而高锚酸钾被还原为铳离子,导致溶液紫色消失,所以能实现
目的,C正确;
D、NaCI和CaCL不反应,Na2cQ,和CaCL反应生成碳酸钙沉淀,所以可以检验是否含有Na2c则可以实现目的,
D正确;
答案选A。
【点晴】
该题的易错点是物质的分离与提纯,分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:
①分离提纯物是固体(从简单到复杂方法):加热(灼烧、升华、热分解),溶解,过滤(洗涤沉淀),蒸发,结晶(重结晶),
例如选项B;
②分离提纯物是液体(从简单到复杂方法):分液,萃取,蒸储;
③分离提纯物是胶体:盐析或渗析;
④分离提纯物是气体:洗气。
8、B
【解析】
A.醋酸易挥发,醋酸、碳酸均与苯酚钠反应生成苯酚,则不能比较碳酸、苯酚的酸性,选项A错误;
B.乙酸与丁醇加热发生酯化反应生成酯,长导管可冷凝回流,图中可制备乙酸丁酯,选项B正确;
C.苯的密度比水小,水在下层,应先分离下层液体,再从上口倒出上层液体,选项C错误;
D.蒸干时氯化钱受热分解,选项D错误;
答案选B。
【点睛】
本题考查化学实验方案的评价及实验装置综合应用,为高频考点,把握物质的性质、实验技能、实验装置的作用为解
答的关键,侧重分析与实验能力的考查,注意实验评价性分析,易错点为选项B:乙酸与丁醇加热发生酯化反应生成
酯,长导管可冷凝回流;选项D:蒸干时氯化铉受热分解,应利用冷却结晶法制备,否则得不到氯化镀晶体。
9,A
【解析】
A.乙烯具有较强的还原性,能与强氧化剂高铳酸钾反应,故可用高锌酸钾除掉乙烯,为了延长水果的保鲜期将水果
放入有浸泡过高钛酸钾溶液的硅土的密封容器中,故A正确;
B.汽油、柴油都是含多种烧类的混合物,只含有碳、氢两种元素,花生油是油脂,含有碳、氢、氧三种元素,故B
错误;
OOH
C.有机物H/写)中只有碳碳双键可与氢气加成,则Imol该有机物最多可与2mO1H2发生加成反应,故C错误;
D.分子式为GsHwCh的有机物不饱和度为8,一个苯分子的不饱和度为4,则其同分异构体中可能含有两个苯环结构,
故D错误;
【点睛】
右知帆才的知由碳的个数*2+2—氢的个数一卤素的个数+氮的个数,在加电.如阚.时如行时知徐才
有机物不饱和度=------------------------------------------------------(注:如果有机物有氧和硫,氧和硫不
2
影响不饱和度,不必代入上公式)。
10、D
【解析】
112MA分子比离子更易透过细胞膜而杀灭细菌,则H2MA浓度越大杀菌能力越大,H2MA与NaOH反应过程中H2MA
浓度逐渐减小、HMA-浓度先增大后减小、MA?-浓度增大,所以I表示H2MA、II表示HMA-、III表示MA*。
A.H2MA分子比离子更易透过细胞膜而杀灭细菌,则H2MA浓度越大杀菌能力越大,H2MA浓度:a>b,所以杀菌能
力a>b,A错误;
B.通过上述分析可知,HI表示MA?-物质的量的变化,B错误;
c(HM^}c(0H-\Kixio-'4
C.MA2水解常数Kh=二一片供一LU=5=5.88x10'%C错误;
c(MA2-)K.21.7X10-5
D.当V=30mL时,溶液中生成等物质的量浓度的NaHMA、Na2MA,根据图知溶液中c(HMA-)<c(MA"),说明HMA-
电离程度大于MA”水解程度,所以溶液呈酸性,D正确;
故合理选项是I).
11、C
【解析】
A.氯化铁溶液呈酸性,能使石蕊变红,所以红色石蕊试纸不变色,A不正确;
B.向盛有K252O7溶液的试管中滴加浓硫酸,平衡Cr2O72-+H2O=2CrO4*+2H+逆向移动,溶液的颜色加深,B不
正确:
C.向FeCb溶液中加入KI溶液,发生反应2F*+2r=2Fe2++L,再加入苯,充分振荡,静置,液体分为两层,上层
为紫红色的碘的苯溶液,下层为无色的水溶液,C正确;
D.向蔗糖在硫酸催化下水解液中加入新制氢氧化铜悬浊液并加热,硫酸与氢氧化铜作用生成硫酸铜,不能将葡萄糖
氧化,没有砖红色沉淀出现,D不正确;
故选C。
12、C
【解析】
A.过滤分离Ag2s时,用玻璃棒不断搅拌,容易损坏滤纸,A不正确;
B.蒸发皿不能用于灼烧,在空气中高温灼烧Ag2s会生成Sth,污染环境,同时生成的Ag会被氧化成AgzO,B不正
确;
C.KMnth与浓盐酸不需加热就能反应生成CL,C正确;
D.分液时,先放出水相,再从分液漏斗上口倒出有机相,D不正确;
故选C。
13、C
【解析】
图中阳极是水失电子,生成Ch和H+,电极反应式为:2H2O-4e-^=4H++O2T,选项A正确;被还原时,化合价
降低,还原产物可能为CO、HCHO、CH3OH、CHa等,选项B正确;装置中阳极材料是光电催化材料,阴极是惰性
电极Pt,二者不能互换,选项C错误;若太阳能燃料为甲醇,阴极反应物为CO2和H+,则电极反应式为:
+
CO2+6H+6e^^=CH3OH+H2O,选项D正确。
14、C
【解析】
A、铜表面生成的绿色固体为碱式碳酸铜,故A项正确;
B、N2O4逸出时,压强减小,有利于生成NCh,故B项正确;
C、FeSO4・7H2O在空气中久置时,Fe?+被氧化为Fe3+,反应方程式为20FeSO4・7H2()+5O2=4Fe4(OH)2(SO4)5+
2Fe2O3+136H2O,故C项错误;
D、SOz通人KMnCh溶液中,紫色MnO厂被还原为几乎无色的Mi?+,故D项正确。
故选C。
15、B
【解析】
如图,HEMA和NVP通过加聚反应生成高聚物A,聚合过程中引发剂的浓度为1.6含水率最高。
【详解】
A.NVP中碳碳双键的其中一个碳原子的另外两个键均是CH键,故不具有顺反异构,故A错误;
B.-OH是亲水基,高聚物A因含有-OH而具有良好的亲水性,故B正确;
C.HEMA和NVP通过加聚反应生成高聚物A,故C错误;
D.制备过程中引发剂浓度对含水率影响关系如图,聚合过程中引发剂的浓度为1.6含水率最高,并不是引发剂的浓度
越高越好,故D错误;
答案选B。
【点睛】
常见亲水基:羟基、瘦基等。含这些官能团较多的物质一般具有良好的亲水性。
16、C
【解析】
A、二者分子式相同而结构不同,所以二者是同分异构体,错误;
B、第一种物质含有苯环,8个C原子共面,第二种物质含有碳碳双键,7个C原子共面,错误;
C、第一种物质含有酚羟基,可与滨水发生取代反应,第二种物质含有碳碳双键,可与溟水发生加成反应,正确;
D、两种有机物H原子位置不同,可用核磁共振氢谱区分,错误;
答案选C。
二、非选择题(本题包括5小题)
()
Z\
T氐Tc
17、1加成反应战键2.氯乙酸浓硝酸、浓硫酸、加热
\/
CH,CH3
+CKH.,C(K)H上:y—+11()Lx1也
CH,CHSO
()
/\
CHJCHJOH—~►CH1CH()----------g(')----------------CICH(KH2CHJ
5\/HCI
CH3
【解析】
B和A具有相同的实验式,分子结构中含一个六元环,核磁共振氢谱显示只有一个峰;3个分子的甲醛分子HCHO断
()
裂碳氧双键中较活泼的键,彼此结合形成B::‘a,B与HCKCI
13cH20H反应产生C:CICH2OCH2CH3;间
(Hi
CH3
二甲苯与浓硝酸、浓硫酸混合加热发生取代反应产生E为O-NCh,在
-Fe>HC1存在条件下硝基被还原变为-NH2,
CH;
CHsCH>
产生F为:O—NH:,F与C1CH2coOH在POCb条件下发生取代反应产生G:,G与C发
CH,()
CH3
*'H,CHjCK'H-CH
生取代反应产生H:CZ\
CH,尸H,CI
()
【详解】
(1)3个分子的甲醛断裂碳氧双键中较活泼的键,彼此结合形成环状化合物B:,,,A-B的反应类型是加成反
'血
应;
(2)C结构简式为C1CH20cH2cH3;其中含氧官能团的名称是酸键;C1CH2COOH可看作是乙酸分子中甲基上的一个H
原子被C1原子取代产生的物质,名称是2-氯乙酸;
(3)D为间二甲苯,由于甲基使苯环上邻位和对位变得活泼,所以其与浓硝酸、浓硫酸混合加热发生取代反应产生E为
CHj
Q-NOz,则D-E所需的试剂和条件是浓硝酸、浓硫酸、加热;
CHs
(4)F与CICH2COOH在POCb条件下发生取代反应产生G和水,F-G的化学方程式是
CH3
(5)E为①-NO?,硝基化合物与C原子数相同的氨基酸是同分异构体,I是E的一种同分异构体,具有下列结构特
CHs
征:①苯环上只有一个取代基;②是某种天然高分子化合物水解的产物,则该芳香族化合物的一个侧链上含有1个
—COOH、1个一NH2,和1个I的结构简式是
(6)CH3CH2OH在Cu催化下加热下发生氧化反应产生CH,CHO,3个分子的乙醛发生加成反应产生
()()
/\Z\
CH3TH(H-CH,(Hj"('HCH—
CH
()(),()()与乙醇在HC1存在时反应产生,,故由乙醇制备
\/\/CICHCKH:(.Hi
CHCH
CHjCH,
()
/\
CHjYHCH-CH」
CHjIJCHJCH.OH|
I的合成路线为:CHJCHJOH-----------------CICHCK'HjCH!
5()()
CCHOCHzCHi\/HCI
CH
T
(H3
【点睛】
本题考查有机物推断与合成、限制条件同分异构体书写、有机物结构与性质等,掌握有机物官能团的结构与性质是解
题关键。要根据已知物质结构、反应条件进行推断,注意根据物质结构简式的变化理解化学键的断裂与形成,充分利
用题干信息分析推理,侧重考查学生的分析推断能力。
18、C14H12O3取代反应消去反应1:1:2:6
H3coH3C(DH3COH3COOH
<0XOOH+CH3OH金舞0^COOCH3+H2OQXHJB:O<HJWHY>OC为3
H3coH)CO
H3C0H3CO
HOCH2-^^-CHO
【解析】
根据F的分子式、白藜芦醇的结构,并结合信息②中第二步可知,F中苯环含有3个-OCH3,故F的结构简式为
H3CO一LX
D发生信息①中一系列反应生成E,反应过程中H3co-◎-CH。的醛基转化为羟基,E发
H3COCMH3CO
生消去反应生成F,因此E为^CH2<H-O0CHJ,逆推可知D为结合物质的分子式、反应条
H3COH3CO
H3C0H3C0H3C0
件、给予的信息,则C为0TH2。也B为^^-COOCH,,A为^>CO0Ho据此分析解答。
H3coH3COH)CO
【详解】
(1)白黎芦醇()的分子式为C14H12O3,故答案为C14H12O3;
(2)C-D是C中羟基被滨原子替代,属于取代反应,E-F是E分子内脱去1分子式形成碳碳双键,属于消去反应,故
答案为取代反应;消去反应;
HjCO
⑶化合物A的结构简式为:>C8H,其核磁共振谱中显示有4种不同化学环境的氢原子,其个数比为1:1:2:6,
H3co
故答案为1:1:2:6;
H3CO
(4)A为>COOH,与甲醇发生酯化反应生成双COOCHs),A-B反应的化学方程式为:
H«。H3CO
HCO
3H3CQ
:00H+CH30H黑豆C00CH3+即,故答案为
H3COH3C0
H3C0H3C0
O<,:00H+CH30H看罂=COOCH3+HjO;
H3C0
H3CO
HjCOH3CO
(5)由上述分析可知,D的结构简式为E的结构简式为2VHQ0C%,故答案为
H)COH3CO
H3COH3COOH
e>CH2B“WHY>8HJ;
H)COH3CO
(6)化合物CbhoQ^CHO的同分异构体符合下列条件:①能发生银镜反应,说明含有醛基或甲酸形成的酯基;②含
苯环且苯环上只有两种不同化学环境的氢原子,则结构简式可能为HOCH2^Q>>CHO、HO-^ACHZCHO、
CH3^Q^OJH»共3种;酚羟基和酯基都能够与碱反应'不与碱反应的同分异构体为H0CH2^^~CH°;故答
案为3;HOCWQXHO。
【点睛】
本题的难点是物质结构的推断。可以根据白黎芦醇的结构简式为起点,用逆推方法,确定各步反应的各物质的结构简
式和反应类型,推断过程中要充分利用题干信息。
19、CzHsOH+HBr>C2H5Br+H2O④②③检查其气密性随时控制反应的进行,不反应时上拉铁丝,
反应时放下铁丝降温,冷凝澳乙烷U形管底部产生无色的油状液体分液漏斗、烧杯。
【解析】
装置A中生成漠苯和澳化氢,B中乙醇和嗅化氢反应生成澳乙烷和水,C用来收集产品,据此解答。
【详解】
(DHBr和乙醇在加热条件下,发生取代反应生成目标产物澳乙烷和水,B中发生反应生成目标产物的化学方程式
为C2HsOH+HBr」!^fCzHsBr+HzO。故答案为:C2H5OH+HBr>C2H5Br+H2O;
(2)利用苯和液溟反应制得溟苯,同时生成的溟化氢与乙醇发生取代反应得到漠乙烷,则应先连接装置并检查所密性,
再添加药品,先加热A装置使苯和液澳先反应,再加热B装置制嗅乙烷,即实验的操作步骤为:①©②③,故答案
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。

评论
0/150
提交评论