



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1
2024届新高考化学热点冲刺复习化学平衡的移动化学平衡状态的特征?逆、等、动、定、变一定条件下的化学平衡条件改变反应速率改变且变化量不同平衡被破坏非平衡状态一段时间后新条件下的新化学平衡破坏旧平衡建立新平衡
化学平衡的移动复习回顾学生活动:
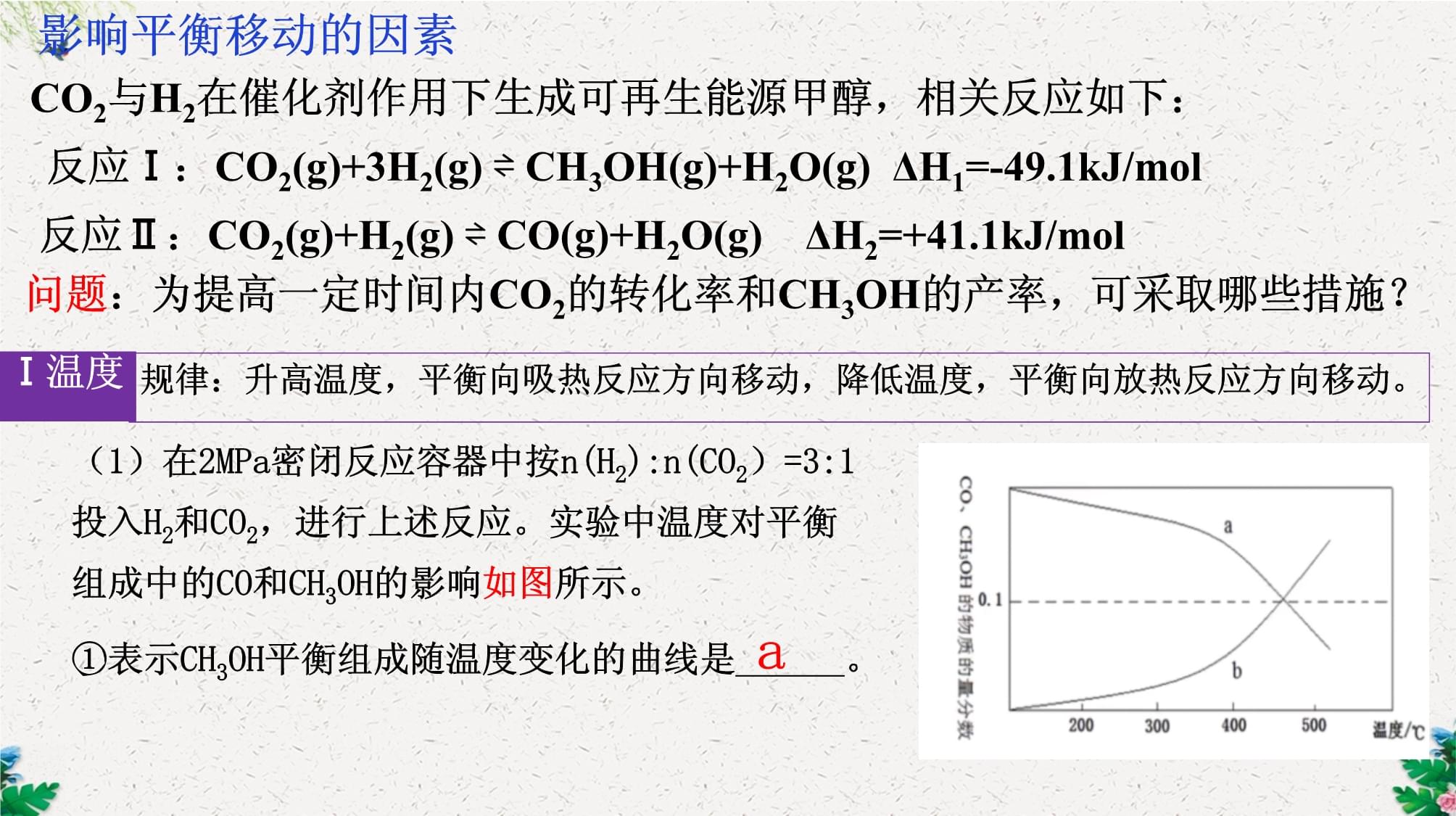
若空气中CO2浓度不断增大,对海洋的pH、珊瑚礁(主要成分是碳酸钙)的生存可能造成什么影响?海水酸化、珊瑚礁逐渐减少、海洋生态环境遭到破坏降低CO2浓度,维持地球大气CO2稳态平衡,迫在眉睫!我国力争于2030年前做到碳达峰,2060年前实现碳中和。提高燃料利用率开发新能源植树造林、碳捕获、封存技术CO2与H2在催化剂作用下生成可再生能源甲醇,相关反应如下:反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1kJ/mol反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ/mol问题:为提高一定时间内CO2的转化率和CH3OH的产率,可采取哪些措施?(1)在2MPa密闭反应容器中按n(H2):n(CO2)=3:1投入H2和CO2,进行上述反应。实验中温度对平衡组成中的CO和CH3OH的影响如图所示。①表示CH3OH平衡组成随温度变化的曲线是______。Ⅰ温度规律:升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热反应方向移动。a影响平衡移动的因素CO2与H2在催化剂作用下生成可再生能源甲醇,相关反应如下:反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1kJ/mol反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ/mol②同时测得,CO2的平衡转化率随温度的变化关系如图所示:请解释CO2的平衡转化率随温度的变化先下降后升高的原因_________________________。Ⅰ温度开始升温时以反应Ⅰ为主,反应放热,平衡逆移,CO2的平衡转化率下降,升高一定温度后,以反应Ⅱ为主,反应吸热,平衡正移CO2与H2在催化剂作用下生成可再生能源甲醇,相关反应如下:反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1kJ/mol反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ/molⅡ浓度
(2)
①实验得:恒压下,该反应在无分子筛膜时甲醇的平衡产率和有分子筛时甲醇的平衡产率随温度的变化如图所示,分子筛膜能选择性分离出H2O。P点甲醇产率高于T点的原因为
。
分子筛膜从反应体系中不断分离出H2O,c(H2O)减小,平衡正向移动,甲醇产率升高。规律:增大反应物浓度或减少生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动;CO2与H2在催化剂作用下生成可再生能源甲醇,相关反应如下:反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1kJ/mol反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ/molⅡ浓度
(2)②在T℃时,向体积为2L的恒容容器中充入物质的量之和为4mol的H2和CO2,发生反应I,达到平衡时CH3OH的体积分数与起始时n(H2)/n(CO2)的关系如图所示。当起始n(H2)/n(CO2)=5,反应达到平衡状态时CH3OH的体积分数可能对应图中
(填“D”、“E”或“F”)点。F
注:随着碳氢比的增大,H2的转化率逐渐减小,CO2的转化率逐渐增大。起始投料比=化学计量数之比,平衡时生成物含量最大CO2与H2在催化剂作用下生成可再生能源甲醇,相关反应如下:反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1kJ/mol反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ/molⅢ压强
(3)①在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下x(CH3OH)∽P、在P=5×105Pa下x(CH3OH)
∽t
如图所示,则图中对应等温过程的曲线是
。规律1:对于反应△V(g)=0,改变压强,平衡不移动;
对于反应△V(g)≠0,增大压强,平衡往气体分子总数减少的方向动;
减小压强,平衡往气体分子总数增大的方向动;
a线CO2与H2在催化剂作用下生成可再生能源甲醇,相关反应如下:反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1kJ/mol反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ/molⅢ压强(3)②压强的调控可以通过惰性气体来实现,请预测①在恒温恒容时,反应达到平衡后往容器中通入N2后CH3OH的产率①在恒温恒压时,反应达到平衡后往容器中通入N2后CH3OH的产率
恒温恒容恒温恒压规律2:恒温恒容充入惰性气体,各组分浓度不变,平衡不移动;
恒温恒压充入惰性气体,等同于减压,平衡往气体分子总数增大的方向移动;
CO2与H2在催化剂作用下生成可再生能源甲醇,相关反应如下:反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1kJ/mol反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ/molⅣ催化剂
工业生产中一般都是限定时间内的反应,因此催化剂对于反应物转化率和产物产率影响的研究依然意义重大。
(4)①对于反应I,不同温度对CO2的转化率及催化剂的催化效率影响如图所示,下列说法不正确的是A、其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1B、温度低于250℃时,随温度升高甲醇的平衡产率增大C、实际反应应尽可能在较低温度下进行,以提高CO2的平衡转化率规律:催化剂能同等程度地改变V正
V逆,
不影响平衡移动
ABCCO2与H2在催化剂作用下生成可再生能源甲醇,相关反应如下:反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1kJ/mol反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ/molⅣ催化剂(4)②在不同催化剂X、Y的催化下发生反应I。测得5min时,CO2转化率与温度的变化关系如图实线所示。①该反应选用的适宜催化剂为
(填“X”或“Y”)。②温度在T2之后,CO2转化率相同的原因是
。
T2温度后,不管使用X还是Y催化剂,反应速率都很快,在5min时都已达到平衡,且平衡不受催化剂影响,因此CO2转化率相同XCO2与H2在催化剂作用下生成可再生能源甲醇,相关反应如下:反应Ⅰ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1=-49.1kJ/mol反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.1kJ/mol综合提升注意:即考虑反应特点、物质特点、多重平衡的相互影响;
(5)
①在一定温度下,压缩容器体积增大压强,则反应中H2(g)的平衡转化率
(填“增大”、“减小”或“不变”)。工业生产中,通过此方法使容器压强增大以加快反应速率,却意外发现CO(g)的产率也显著提高,请你从平衡原理解释其原因可能是
。增大压强增大使水蒸气液化,反应Ⅱ平衡正向移动。②、写出一条能提高CO2转化率而降低CO生成率的措施
。
增大H2(g)的浓度、适当增大压强、适当降低温度、使用对反应Ⅰ有选择性的催化剂等如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向能够减弱这种改变的方问移动。
定性视角:勒夏特列平衡移动原理只针对于平衡移动,减弱但不消除。勒夏特列原理的应用1.对于一定条件下的可逆反应甲:A(g)+B(g)⇌C(g)
ΔH<0乙:A(s)+B(g)⇌C(g)
ΔH<0丙:A(g)+B(g)⇌2C(g)
ΔH>0达到化学平衡后,只改变一种条件,按要求回答下列问题:(1)升温,新平衡体系的温度均比原来____(填“高”或“低”)。混合气体的平均相对分子质量变化分别为甲_____(填“增大”“减小”或“不变”,下同);乙_____;丙______。(2)加压,使体系体积缩小为原来的1/2混合气体的平均相对分子质量变化分别为甲_____(填“增大”“减小”或“不变”,下同);乙_____;丙_____。高减小
减小不变增大不变不变2.对于以下三个反应,从反应开始进行到达到平衡后,保持温度、体积不变,按要求回答下列问题。(1)PCl5(g)⇌PCl3(g)+Cl2(g)再充入PCl5(g),平衡向________方向移动,达到平衡后,PCl5(g)的转化率_____,PCl5(g)的百分含量______。(2)2HI(g)⇌I2(g)+H2(g)再充入HI(g),平衡向_______方向移动,达到平衡后,HI的分解率______,HI的百分含量_____。(3)2NO2(g)⇌N2O4(g)再充入NO2(g),平衡向________方向移动,达到平衡后,NO2(g)的转化率______,NO2(g)的百分含量_____。正反应减小增大正反应不变不变正反应减小增大构建恒温恒容平衡思维模式新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。3.恒温、恒压下,在一个容积可变的密闭容器中发生反应:A(g)+B(g)⇌C(g),若开始时通入1molA和1molB,达到平衡时生成amolC。则下列说法错误的是A.若开始时通入3molA和3molB,达到平衡时,生成C的物质的量为3amolB.若开始时通入4molA、4molB和2molC,达到平衡时,B的物质的量一定大于
4molC.若开始时通入2molA、2molB和1molC,达到平衡时,再通入3molC,则再次达到平衡后,C的物质的量分数为D.若在原平衡体系中,再通入1molA和1molB,混合气体的平均相对分子质量不变B(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例,见图示)新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。1.(2022年广东卷)恒容密闭容器中,BaSO4(S)+4H2(g)⇌BaS(S)+4H2O(g)在不同温度下达平衡时,各组分的物质的量(n)如图所示。下
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 护理会诊的理由
- 如何缓解护理工作压力
- 吊车与升降设备维护协议
- 总裁给新人培训
- 《画里空间》教学课件-2024-2025学年湘美版(2024)初中美术七年级下册
- 幼儿园获奖公开课:大班健康《身体部位》课件
- 大众创业万众创新意义
- 常见传染病管理流程
- 彩云衣美术课件
- 小家电设计工作室创业计划
- 【电力服务收费项目及标准】 电力维护收费标准
- 软件工程导论(第六版)电子教案(第1-13章)
- 《式微》课件完整版
- 幼儿园中班数学:《比较6~10两数之间的关系》 课件
- 铝件镀银工艺课件
- 供应室技能考核操作标准
- 经典物理浮力计算题(含答案)
- 2021年中国海洋大学辅导员招聘试题及答案解析
- 生物地理中考总复习知识点(地生中考,要这样复习)
- 云南省大理白族自治州各县区乡镇行政村村庄村名居民村民委员会明细
- 2022年广西文化产业集团有限公司招聘笔试题库及答案解析

评论
0/150
提交评论