



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
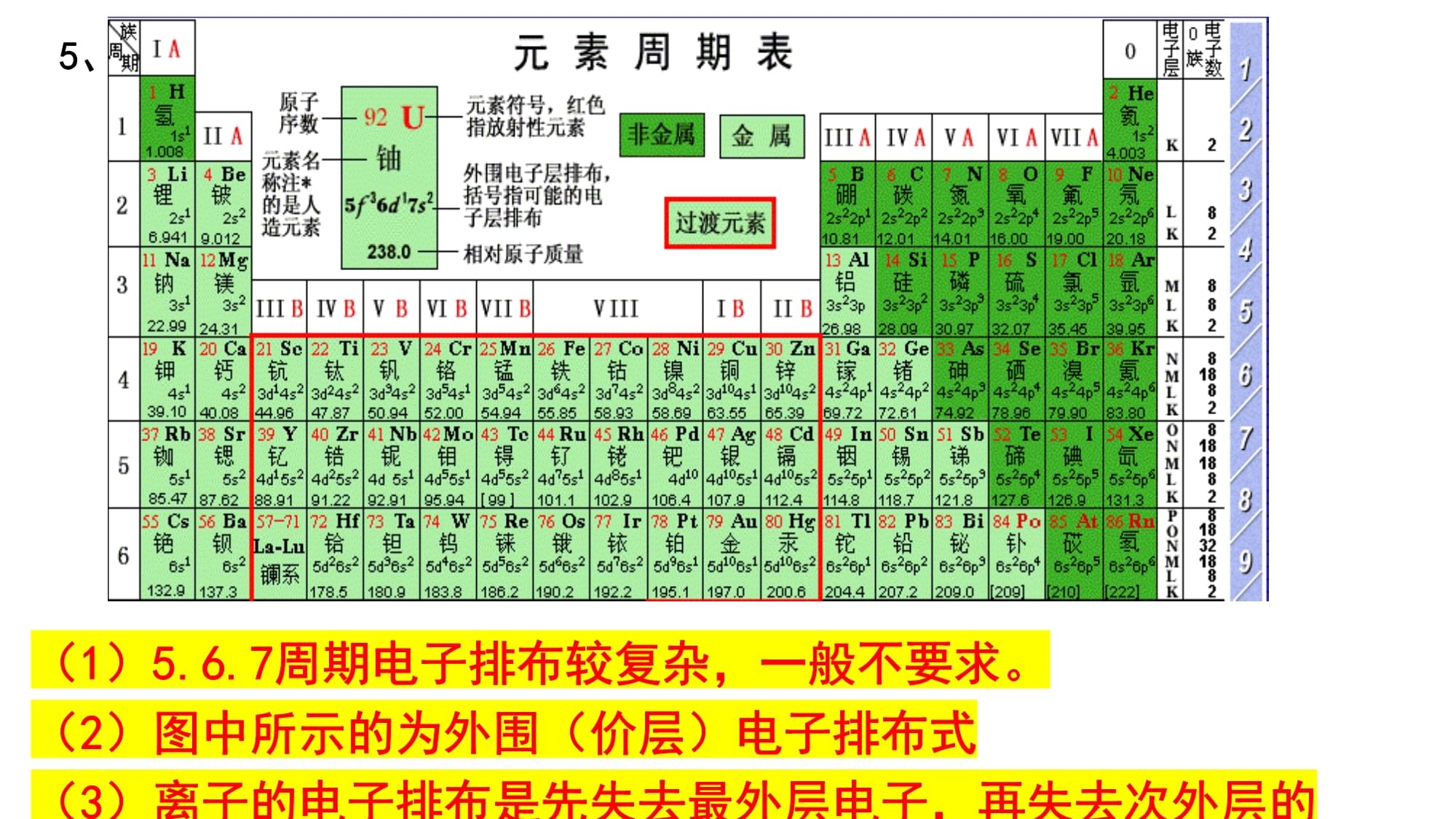
核外电子排布(物构)1、电子排布式
价电子的电子排布式2、轨道表示式(电子排布图)
外围电子的轨道表示式3、最高能层:4、最高能级:5、未成对电子数:6、运动状态不同的电子:7、空间运动状态不同的电子:8、位置(周期、族、区):9、磁量子数(1/2或-1/2)代数和:10、同族推导:3s54s1N层3d5个24种=轨道数15种第四周期VIB族d区3或-3Mo第五周期与Cr同族一、核外电子排布1、能层(电子层)——K、L、M、N2、能级(原子轨道)s轨道:球形1个伸展方向(轨道数)p轨道:哑铃形
3个伸展方向d轨道:花瓣形5个伸展方向f轨道:7个伸展方向3、各层轨道及数目K层:1s1个L层:2s2p4个M层:3s3p3d9个N层:4s4p4d4f16个n层:n2个易错点:A元素的M电子层排满,且最外层只有1个电子,则该元素是____易错点:铝原子的核外电子云的形状有____种,伸展方向共有_____个4、三大构造原理1-36号元素基态原子的电子排布式原子序数元素名称元素符号电子排布式KLMNO1氢H1s12氦He1s23锂Li1s22s14铍Be1s22s25硼B1s22s22p16碳C1s22s22p27氮N1s22s22p38氧O1s22s22p41-36号元素基态原子的电子排布式原子序数元素名称元素符号电子排布式KLMNO9氟F1s22s22p510氖Ne1s22s22p611钠Na1s22s22p6
3s112镁Mg1s22s22p63s213铝Al1s22s22p63s23p114硅Si1s22s22p63s23p215磷P1s22s22p6
3s23p316硫S1s22s22p63s23p4二、原子核外电子排布规律1-36号元素基态原子的电子排布式原子序数元素名称元素符号电子排布式KLMNO17氯Cl18氩Ar19钾K
20钙Ca
21钪Sc22钛Ti
4s1
4s2
4s2
3d11s22s22p63s23p51s22s22p6
3s23p61s22s22p63s23p61s22s22p63s23p61s22s22p63s23p61s22s22p63s23p63d24s2能级交错现象二、原子核外电子排布规律1-36号元素基态原子的电子排布式原子序数元素名称元素符号电子排布式KLMNO23钒V24铬Cr25锰Mn26铁Fe27钴Co28镍Ni29铜Cu30锌Zn1s22s22p63s23p63d34s21s22s22p63s23p63d44s2×3d54s11s22s22p63s23p63d54s21s22s22p63s23p63d64s21s22s22p63s23p63d74s21s22s22p63s23p63d84s21s22s22p63s23p63d94s2×3d104s11s22s22p63s23p63d104s2不符合构造原理构造原理是被理想化的二、原子核外电子排布规律5、1-36电子排布式和轨道表示式(1)5.6.7周期电子排布较复杂,一般不要求。(2)图中所示的为外围(价层)电子排布式(3)离子的电子排布是先失去最外层电子,再失去次外层的S区ds区d区p区f区6.电子跃迁与原子光谱
基态原子激发态原子吸收能量释放能量光(辐射)是电子跃迁释放能量的重要形式之一如:焰色、霓虹灯光、激光、荧光、LED灯光等原子吸收光谱原子发射光谱二、第一电离能1、比较大小同周期从左到右,第一电离能呈增大趋势同主族从上到下,第一电离能逐渐减小因为半径越小,核对电子的吸引力越大因为半径越大,核对电子的吸引力越大金属元素<H<非金属元素2、解释:①反常:Be>BN>PMg>AlP>S②I3(Mn)>I3(Fe)③I3(Mg)>>I2(Mg)N的价电子排布为2s22p3,2p轨道呈半满状态,结构稳定,不易失电子失去2个电子后Mn的价电子排布为3d5,3d轨道呈半满状态,结构稳定离子所带电荷数越多,对电子的吸引力越大,且第3个电子为次外层电子,较难失去二、第一电离能1.定义:气态原子失去一个电子生成+1价的气态阳离子所需的最低能量。I1越大,越难失去电子
(稀有气体I1最大)2、递变规律同周期从左到右,第一电离能呈增大趋势同主族从上到下,第一电离能逐渐减小因为半径越小,核对电子的吸引力越大因为半径越大,核对电子的吸引力越小更正:第一电离能:C<H<O请掌握第二周期的第一电离能顺序大方向:金属元素<H<非金属元素3、解释:①反常:Be>BN>PMg>AlP>S②I3(Mn)>I3(Fe)③I3(Mg)>>I2(Mg)N的价电子排布为2s22p3,2p轨道呈半满状态,结构稳定,不易失电子失去2个电子后Mn的价电子排布为3d5,3d轨道呈半满状态,结构稳定离子所带电荷数越多,对电子的吸引力越大,且第3个电子为次外层电子,较难失去4、第二周期C、N、O、F第三电离能5、不同状态下,再失去1个电子难易的比较Cu与Zn相比,第二电离能与第一电离能差值更大的是_______,原因是_________________________________________________________。6、电离能差值的比较Cu的第一电离能失去的是4s1电子,第二电离能失去的是3d10的电子,Zn的第一电离能失去的是4s2电子,第二电离能失去的是4s1的电子,3d10电子处于全充满状态,其与4s1电子能量差值更大我的理解:Cu失去的第1个电子是最外层电子,而失去的第2个电子是次外层电子,而Zn失去的2个电子都是最外层电子,故Cu第一电离能和第二电离能相差较大。三、围绕电负性的考查1、比较大小同周期从左到右,电负性逐渐增大同主族从上到下,电负性呈减小趋势因为半径越小,核对电子的吸引力越大因为半径越大,核对电子的吸引力越小金属元素<H<非金属元素①判断化合价:电负性大的为负价,电负性小的为正价②判断化学键类型:电负性差值大于1.7,一般为离子键,小于1.7为共价价③判断配位原子和配位能力:例1:CO形成配位键时配位原子是C而不是O,因为C的电负性较小,易提供孤电子对例2:NH3易形成配合物,而NF3不易形成配合物
例3:NH3配位能力比H2O强2、应用:三、电负性1、定义:衡量吸引电子的能力(以F=4.0为标准,其它与之对比)2、递变规律同周期从左到右,电负性逐渐增大同主族从上到下,电负性呈减小趋势因为半径越小,核对电子的吸引力越大因为半径越大,核对电子的吸引力越小真正:金属元素<Si<B<H<非金属
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 员工自己退休协议书
- 旧书捐赠协议书范文
- 异地合伙创业协议书
- 邮政离职保密协议书
- 转租中介保密协议书
- 有关车祸理赔协议书
- 就业意向协议书注意
- 矿山项目收购协议书
- 期房转让协议书公证
- 政府投资协议书模板
- 空调定期清洗消毒制度消毒
- 2024-2025学年下学期高二政治选必修2第三单元B卷
- 重庆市拔尖强基联盟2024-2025学年高三下学期3月联合考试历史试题(含答案)
- 果园种植管理合作合同范本
- 居室空间设计 课件 项目四 起居室空间设计
- 【历史】隋唐时期的科技与文化教学设计 2024-2025学年统编版七年级历史下册
- 劳务外包服务投标方案(技术标)
- 中国水泥回转窑行业发展监测及投资方向研究报告
- 初中英语牛津深圳版单词表(按单元顺序)七年级至九年级
- 枪支安全及使用指南
- 《肝衰竭诊治指南(2024版)》解读

评论
0/150
提交评论