



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1沉淀平衡2平衡移动T同离子效应(溶解度)盐效应(溶解度)BaSO4(s)Ba2+(aq)+SO42-(aq)多相平衡固相液相未溶解(s)溶解平衡平衡
规则
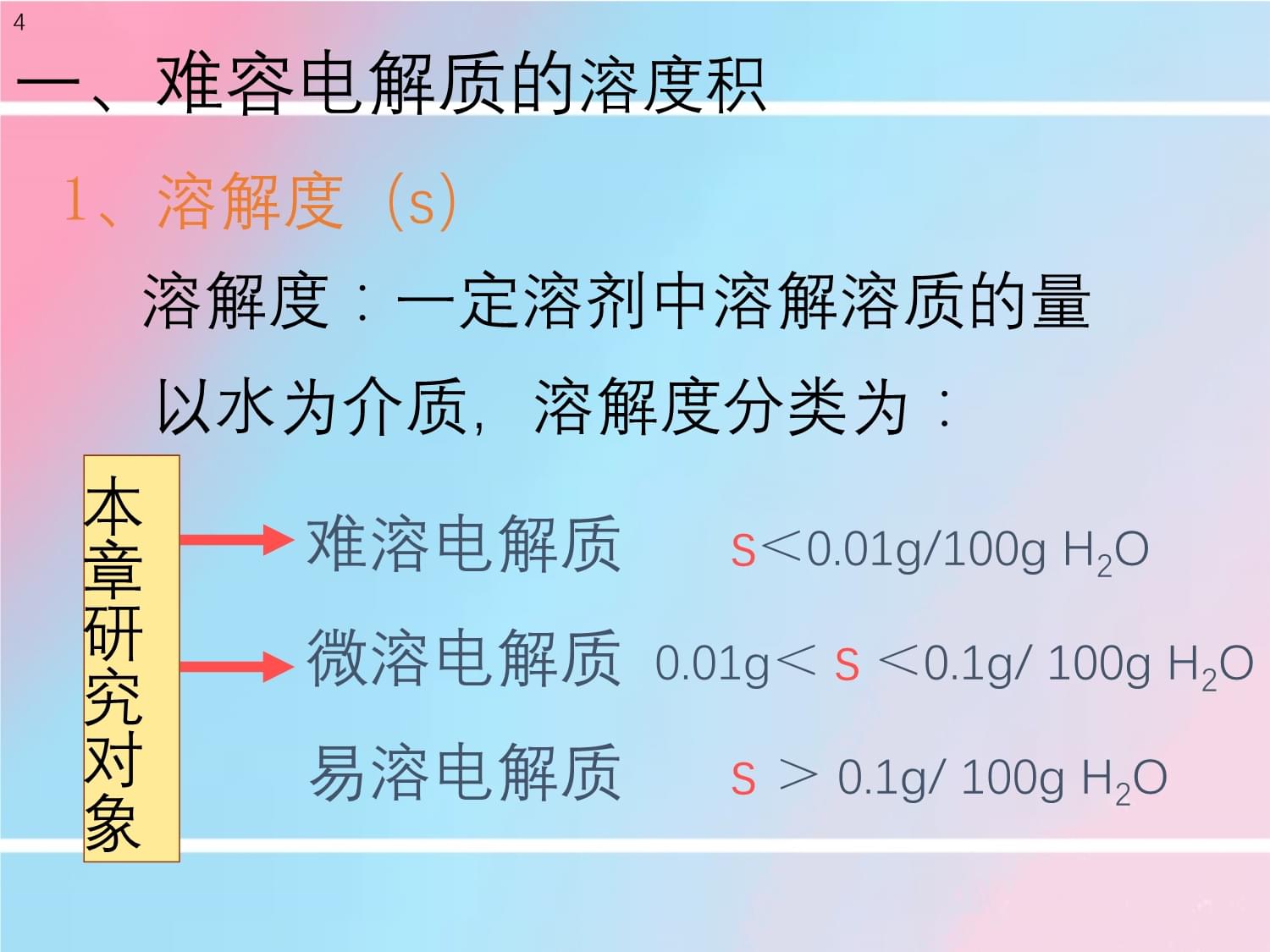
规则应用沉淀生成分步沉淀沉淀溶解概述:3一、溶度积和溶度积规则二、影响沉淀平衡的因素三、溶度积规则的应用沉淀平衡4难溶电解质
s<0.01g/100gH2O微溶电解质0.01g<s
<0.1g/100gH2O易溶电解质
s
>0.1g/100gH2O本章研究对象溶解度:一定溶剂中溶解溶质的量以水为介质,溶解度分类为:一、难容电解质的溶度积
1、溶解度(s)5BaSO4(s)Ba2++SO42-
溶解沉淀(未溶解固体)(溶液中的离子)溶度积常数——
难溶电解质饱和溶液中离子浓度(活度)的幂次方的乘积。[BaSO4]为常数,并入Kθ,得oo2、溶度积常数6AnBm(s)nAm+(aq)+mBn-(aq)=[Am+]n[Bn-]m(严格取a)注意:
2.浓度的指数为B(配平)3.浓度单位为mol.L-1
4.稀溶液ca微溶、难溶电解质5.同类型的难溶盐,,sAB型、AB2型、A2B型、AB3型等7设溶解度smol.L-1AnBm(s)nAm+(aq)+mBn-(aq)[Am+]=ns[Bn-]=ms=[Am+]n[Bn-]m=(ns)n(ms)m=nnmmsn+m3.和溶解度s换算AB型:
CaSO4(s),已知溶解度sCaSO4(s)Ca2+(aq)+SO42-(aq)[Ca2+]=s[SO42-]=s=[Ca2+][SO42-]=s.s=s28Fe(OH)3(s)Fe3+(aq)+3OH-(aq)[Fe3+]=s[OH-]=3sAB3型:
Fe(OH)3(s),=3.0010-38,求溶解度s不同类型难溶电解质的换算关系不同9例1:
AgI(s)Ag++I-
若已知:
s=9.11×10-9mol·L-1例2:
Ag2CrO4(s)2Ag++CrO42-
若已知:
=
1.12×10-12则:
=s2=(9.11×10-9)2=8.30×10-17mol2·L-2o则:
=s(2s)2=1.12×10-12s=6.50×10-5mol·L-1o10
smol·L-1AgCl1.77×10-101.34×10-5AgBr
4.95×10-157.00×10-7Ag2CrO41.12×10-126.50×10-5结论:同类型,由比较溶解度大小。不同类型,不能由比较溶解度大小,计算s后,由s大小判断。溶解度大小:
Ag2CrO4>AgCl>AgBr11设瞬时浓度积[Ca2+][SO42-]=QQ>
过饱和,平衡向左移动,沉淀生成=
饱和,动态平衡
<
未饱和,沉淀溶解4.规则CaSO4(S)Ca2+(aq)+SO42-(aq)12二、影响沉淀平衡的因素1、同离子效应s
在沉淀平衡体系中,若加入含有体系中共同离子的易溶强电解质,使难溶电解质溶解度降低的效应,称同离子效应。13AgCl(s)Ag++Cl-加入NaClNa++Cl-规律:平衡左移,AgCl(s)的溶解度降低。
应用:利用同离子效应,即增加沉淀剂用量,使被测组分沉淀完全。
14例:已知=3.40×10-11,MrCaF2=78.1g/mol1)试计算在0.250L水中能溶解多少克CaF2?
2)若在0.250L,0.10mol·L-1Ca(NO3)2溶液中,
则又能溶解多少CaF2克?∴=[Ca2+][F-]2=x(2x)2=4x3
3.40×10-11=4x3
x=2.00×10-4mol·L-1平衡时:x2xCaF2的克数=2.0×10-4×0.250×78.1=3.90×10-3g解:1)设水中溶解CaF2的溶解度为xmol•L-1CaF2(s)Ca2++2F-15
(2)设在Ca(NO3)2中CaF2
的溶解度为ymol·L-1Ca(NO3)2Ca2++
2NO3-CaF2(s)Ca2++2F-
∴=(0.10+y)·(2y)2=3.40×10-11∴y=9.20×10-6mol·L-1在0.250LCa(NO3)2中溶解CaF2的量为:9.20×10-6×0.250
×
78.1=1.80×10-4(g)平衡时:(0.10+y)
2y16
水中Ca(NO3)2中溶解量
3.90×10-3
1.80×10-4比较:结论:由于同离子效应,使CaF2溶解度降低。
0.10mol·L-117I,
i,a=c,平衡右移,s2.盐效应sAl(NO3)3Ag2SO4(=1.58×10-5)Ag2SO4(s)2Ag++SO42-Al(NO3)3Al3++3NO3-规律:盐效应使难溶物的溶解度略微增大181)考虑盐效应
加入溶液中不存在的强电解质
2)同离子效应与盐效应有时会同时存在如:在PbSO4中加入不同浓度Na2SO4时所产生的现象Na2SO400.0010.010.020.040.100.200.50(mol•L-1)PbSO41.520.240.150.140.130.160.230.23(mol•L-1)溶解度×10-4同离子效应使溶解度下降
盐效应使溶解度上升
最小注意:193、酸效应
AnBm(s)nAm++mBn-+H++OH-+OH-+H+规律:对弱酸盐,增加酸度,可增加溶解度204、配合效应
例:
AgClAg++Cl-+NH3规律:加入配合剂,使难溶物的溶解度增大[Ag(NH3)2]+211)对无配合反应的强酸盐沉淀主要考虑:同离子效应和盐效应如:BaSO43)对有配合反应,尤其能生成稳定配合物
主要考虑:配合效应2)对弱酸盐或难溶酸盐沉淀
主要考虑:酸效应如:CuS结论:22三、溶度积规则的应用1.沉淀生成,沉淀完全的条件例2:在H2S的饱和溶液中含有Fe2+,若1升中含11gFe2+,试问在多少pH值下才不生成FeS沉淀?(H2S的饱和溶液的浓度为0.1mol•L-1)H2S分析:教材P192例623例3:70ml0.001mol•L-1MgCl2溶液,加入10ml0.1mol•L-1HCl和20ml0.1mol•L-1NH3.H2O,问:(1)能否产生Mg(OH)2?(2)若不能产生沉淀,则若要产生Mg(OH)2,开始加入的
NH3.H2O浓度至少为多少?,24计算[OH-]:缓冲液HCl+NH3.H2O
(NH4+
NH3余
)[OH-](1)分析:例3:70ml0.001mol•L-1MgCl2溶液,加入10ml0.1mol•L-1HCl和20ml0.1mol•L-1NH3.H2O,问:(1)能否产生Mg(OH)2?由已知条件求混合液中[Mg2+],当[Mg2+][OH-]2,则产生沉淀,首先计算[Mg2+],[OH-]25解:(1)混合后[NH4+]生成=100.1/100=0.01mol•L-1[NH3]余=(20-10)0.1/100=0.01mol•L-1[Mg2+]=0.00170/100=7.0010-4mol•L-1[Mg2+][OH-]2=7.0010-4(1.810-5)2=2.310-13<不产生沉淀NH3+H+NH4+NH3+H2ONH4++
OH-
例3:70ml0.001mol•L-1MgCl2溶液,加入10ml0.1mol•L-1HCl和20ml0.1mol•L-1NH3.H2O,问:(1)能否产生Mg(OH)2?26(2)分析:溶液为
NH4+
NH3缓冲液,由[OH-]可知[NH4+]
,
NH3+H2ONH4++
OH-,过量NH3水解产生的NH3与HCl中和生成的+(2)若要产生Mg(OH)2,开始加入的NH3.H2O浓度至少为多少?当[Mg2+][OH-]2,产生沉淀,[Mg2+]为定值,计算所需[OH-];([NH3]初即要产生Mg(OH)2,开始至少需加入的
NH3.H2O的浓度)[NH3]初=[NH3]平+[NH3]中和量+[NH3]水解量然后求[NH3]平例3:70ml0.001mol•L-1MgCl2溶液,加入10ml0.1mol•L-1HCl和
20ml0.1mol•L-1NH3.H2O,问:27解:(2)[Mg2+][OH-]2=平衡/mol•L-1
x
0.01+8.9510-58.9510-5[NH3]初=0.0497+
0.01
+8.9510-50.0597mol•L-1[NH3]平=x=0.0497mol•L-1NH3
+H2ONH4+
+OH-平衡存在中和消耗水解产生28Mn+沉淀完全的条件:
[Mn+]≤10-5mol•L-1总结:要使沉淀完全:
1)利用同离子效应,加入过量沉淀剂。
2)将沉淀物转化成更小的物质。o29原则:同类型越小的物质越易先沉淀分步沉淀的顺序取决于:
沉淀物溶度积大小被沉淀离子的浓度混合离子+沉淀剂组分离子先后沉淀应用:选择性沉淀,物质的分离、除杂
2.沉淀的顺序:(分步沉淀)30例:I-和Cl-的浓度均为0.01mol•L-1的溶液中,逐滴加入AgNO31)问何种离子先沉淀?
2)欲改变沉淀次序,应采用何法?
o解:先根据值定性判断,查表得:∴初步判断AgI先沉淀∵<oooo31再由计算证实:使AgI
所需使AgCl
所需随AgNO3滴入,先出现淡黄色AgI
,当继续至溶液中[Ag+]=1.77×10-8mol·L-1时,会出现白色AgCl
。32当出现AgCl
时,溶液中还有无I-?残留的I-离子比例为=o可认为基本已无I-33要改变次序使AgCl先沉淀,只有增加[Cl-]若[I-]=0.01mol·L-1,则[Cl-]=2.08×106mol·L-1
结论:1)同类型,浓度相同的混合物中,加入沉淀剂,则小的先沉淀。
2)不同浓度物质,Q先达到先沉淀。oo34o关键:降低溶液中离子浓度,使Q<沉淀溶解化学方法中常用:
a)酸碱溶解法氢氧化物OH-H2O
碳酸盐CO32-+H3O+
H2CO3CO2
硫化物S2-
H2S+H2O3、沉淀的溶解方法:1)通过化学反应降低离子浓度或束缚离子
2)改变温度35
b)配合溶解法
又如:AgCl(s)Ag++Cl-+NH3[Ag(NH3)2]+关键:加入配合剂,与溶液中离子形成配合物36对特小的难溶物,常需将几种方法结合
HgS(s)Hg2++S2-
例如PbSPb2++SCuSCu2++S+HNO3如:HgS+HCl+HNO3
[HgCl4]2-+S+NO+H2OCl-
HNO3
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2026福建同安第一中学附属学校校园招聘备考题库附答案
- 2026福建省遴选公务员403人参考题库附答案
- 2026福建福州市司法局行政复议辅助人员招聘3人参考题库附答案
- 2026贵州贵阳市某国有企业招聘2人考试备考题库附答案
- 2026青海海西州格尔木市公安局招聘警务辅助人员46人参考题库附答案
- 中共台州市路桥区委全面深化改革委员会办公室关于公开选聘工作人员1人备考题库附答案
- 常州市武进区前黄实验学校招聘考试备考题库附答案
- 河南省科学院碳基复合材料研究院科研辅助人员招聘备考题库附答案
- 纪检监察基础知识
- 纪检监察培训课件汇编
- 中西医结合诊治妊娠胚物残留专家共识(2024年版)
- 2026年托里国电投发电有限责任公司招聘备考题库及1套完整答案详解
- 2025-2026学年北京市海淀区初二(上期)期末物理试卷(含答案)
- 2025-2026年鲁教版八年级英语上册期末真题试卷(+答案)
- (正式版)DB51∕T 2732-2025 《用材林培育技术规程 杉木》
- 八年级下册 第六单元写作 负责任地表达 教学课件
- 美容院2025年度工作总结与2026年发展规划
- 26年三上语文期末密押卷含答题卡
- 2026届云南省昆明市西山区民中数学高一上期末考试模拟试题含解析
- 2025-2030乌干达基于咖啡的种植行业市场现状供需分析及投资评估规划分析研究报告
- DZ∕T 0148-2014 水文水井地质钻探规程(正式版)

评论
0/150
提交评论