



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
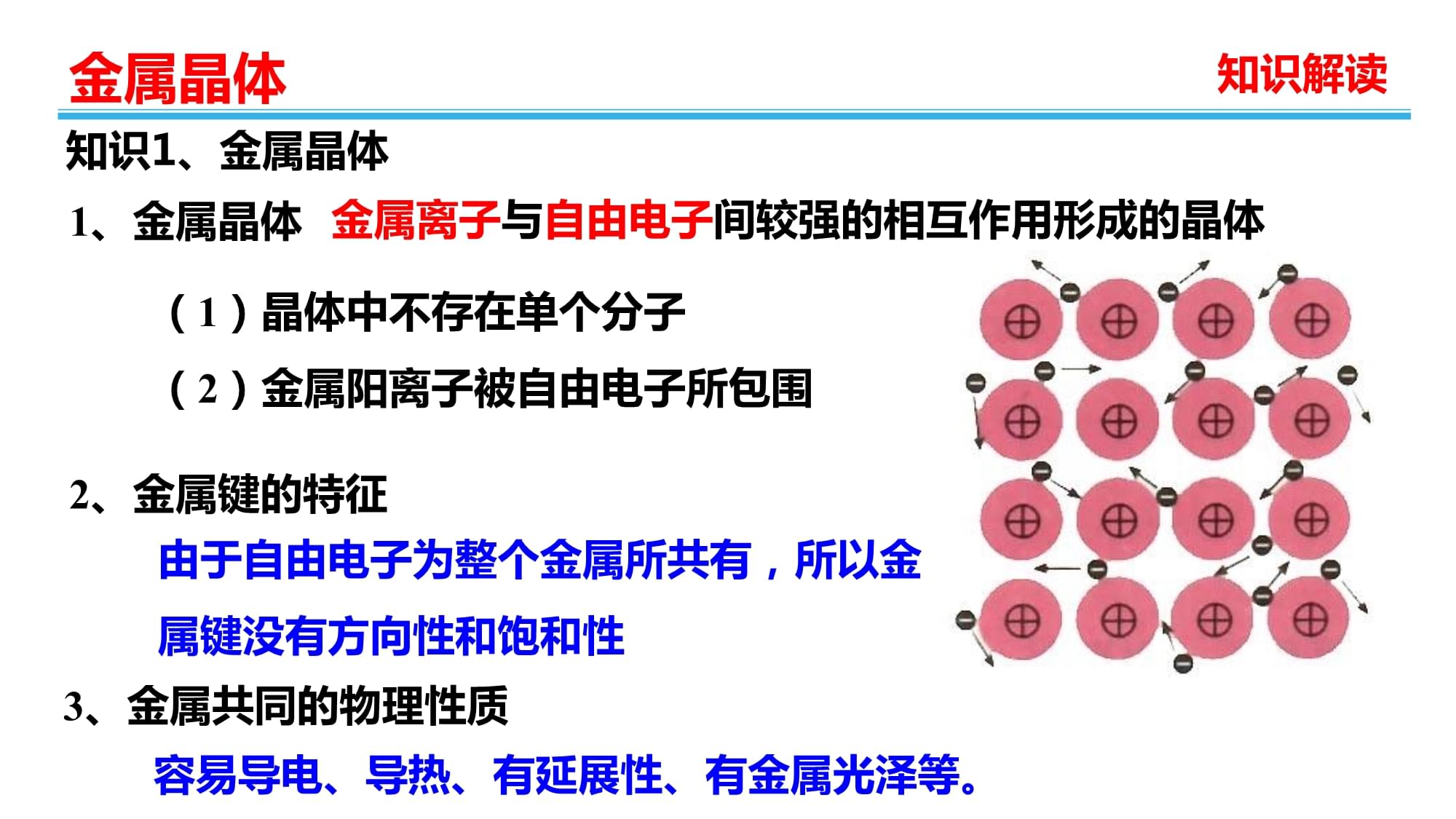
1、 组织建设化学 选修 33.2 金属晶体与离子晶体 组织建设化学 选修 33.2.1金 属 晶 体图片导学Ti金属样品图片导学1、金属晶体知识1、金属晶体知识解读金属离子与自由电子间较强的相互作用形成的晶体(1)晶体中不存在单个分子(2)金属阳离子被自由电子所包围 2、金属键的特征由于自由电子为整个金属所共有,所以金属键没有方向性和饱和性3、金属共同的物理性质容易导电、导热、有延展性、有金属光泽等。4、金属晶体的结构与金属性质的内在联系导电性导热性延展性自由电子在外加电场作用下定向移动自由电子与金属离子碰撞传递热量晶体中各原子层相对滑动仍保持相互作用自由电子+金属离子金属原子错位+知识解读知识
2、1、金属晶体知识拓展金属晶体结构具有金属光泽和颜色原因因自由电子可吸收所有频率的光,很快释放出去,绝大多数金属具有光泽。某些金属因易吸收某些频率光而呈特殊颜色。当金属呈粉末状时,金属晶体晶面取向杂乱、晶体外形排列不规则,吸收可见光后辐射不出去,所以成黑色。知识1、金属晶体熔点最低的金属是-汞 -38.87熔点最高的金属是-钨 3410密度最小的金属是-锂 0.53g/cm3密度最大的金属是-锇 22.57g/cm3硬度最小的金属是-铯 0.2硬度最大的金属是-铬 9.0最活泼的金属是-铯最稳定的金属是-金延性最好的金属是-铂铂丝直径: mm展性最好的金属是-金金箔厚: mm知识拓展金属之最知识
3、2、金属晶体的原子堆积模型金属原子在二维空间(平面)上有二种排列方式配位数= 4配位数= 6(a)非密置层 (b)密置层图片导学问题导入金属晶体可看成原子在三维空间中堆积而成,那么非密置层在三维空间里堆积有几种方式?比较不同方式堆积时金属晶体的配位数、原子空间利用率、晶胞的区别。问题导学知识2、金属晶体的原子堆积模型晶胞的形状?含几个原子?1、简单立方堆积 Po 652%每个晶胞含原子数:1配位数:在晶体中,与每个微粒紧密相邻的微粒个数空间利用率:晶体空间被微粒占满的体积百分数,用来表示紧密堆积的程度知识解读知识2、金属晶体的原子堆积模型2、体心立方堆积-钾型( IA,VB,VIB)非密置层的
4、另一种堆积是将上层金属原子填入下层的金属原子形成的凹穴中知识解读知识2、金属晶体的原子堆积模型配位数:8空间占有率:68%每个晶胞含原子数:2体心立方晶胞空间利用率计算 中心有1个原子, 8个顶点各1个原子每个原子被8个 晶胞共享每个晶胞含有原子数: 1 + 8 1/8 = 2知识探究知识2、金属晶体的原子堆积模型2、体心立方堆积-钾型原子半径为r 、晶胞边长为a ,勾股定理2a 2 + a 2 = (4r) 2空间利用率 = 晶胞含有原子的体积 / 晶胞体积 100% 第二层对第一层来讲最紧密的堆积方式是将球对准1,3,5 位。(或对准 2,4,6 位,其情形是一样的 )123456AB,关
5、键是第三层,对第一二层来说,第三层可有两种最紧密堆积方式密置层的堆积方式有哪些?问题探究知识2、金属晶体的原子堆积模型问题探究问题探究知识2、金属晶体的原子堆积模型123456 下图是此种六方紧密堆积的前视图第一种是将第三层的球对准第一层的球。每两层形成一个周期,即 AB AB 方式,形成六方紧密堆积3、六方密堆积镁型配位数 ( 同层 ,上下层各 )12 63问题探究知识2、金属晶体的原子堆积模型3、六方密堆积镁型空间占有率:每个晶胞含原子数:74%2(Be Mg B B B )问题探究知识2、金属晶体的原子堆积模型123456 下图是面心立方最密堆积前视图第二种是第三层的球对准第一层的2、4
6、、6位置每三层形成一个周期,即 ABC ABC 方式,形成面心立方最密堆积4、面心立方最密堆积铜型配位数 ( 同层 ,上下层各 )12 63问题探究知识2、金属晶体的原子堆积模型4、面心立方最密堆积铜型BCA空间占有率:每个晶胞含原子数:74%4(B Pb Pd Pt )求面心立方晶胞的空间利用率.晶胞边长为a,原子半径为r.由勾股定理: a 2 + a 2 = (4r)2 a = 2.83 r每个面心立方晶胞含原子数目: 8 1/8 + 6 = 4 = (4 4/3 r 3) / a 3 = (4 4/3 r 3) / (2.83 r ) 3 100 % = 74 %知识拓展知识2、金属晶体
7、的原子堆积模型常见金属晶体的堆积模型当堂感悟知识3、石墨是层状结构的混合型晶体 知识拓展同层内碳原子共价键结合, 层层间范德华力石墨的熔点很高,化学性质稳定金属键金属晶体的结构特征金属晶体的原子堆积模型金属晶体金属晶体当堂感悟金属晶体熔点比较课时小结当堂巩固1.金属晶体堆积密度大,原子配位数高,能充分利用空间的原因( )A金属原子的价电子数少 B金属晶体中有“自由电子”C金属原子的原子半径大 D金属键没有饱和性和方向性2.关于钾型晶体(如图)的结构的叙述中正确的是( )A是密置层的一种堆积方式 B晶胞是六棱柱C每个晶胞内含2个原子 D每个晶胞内含6个原子金属键没有方向性,没有饱和性使原子吸引尽
8、可能多的其他原子分布于周围,并以密堆积的方式降低体系的能量D非密堆积方式8个顶点1个体心原子数:81/8+1=2体心立方C当堂巩固3下列关于金属晶体的叙述正确的是()A常温下,金属单质都以金属晶体形式存在B金属晶体的熔点都很高,硬度都很大C钙的熔点、沸点高于钾D温度越高,金属的导电性越好Hg常温是液体Ca的金属键强于K减弱C金属熔点差别大:汞熔点 (-38.9 )铁 (1535 ) 组织建设化学 选修 33.2.2离 子 晶 体离子晶体食盐图片导学视频导学氯化钠干冰金刚石熔点()801-56.23550为什么氯化钠的性质与干冰、金刚石的不同?思考讨论知识1、离子晶体1、定义:由阳离子和阴离子通
9、过离子键结合而成的晶体。2、成键粒子:阴、阳离子3、相互作用力:离子键4、常见的离子晶体:强碱、活泼金属氧化物、大部分的盐类。问题解读5、晶胞类型:(1)氯化钠型晶胞Na+和Cl-的位置:均位于顶角,并交错排列钠离子:体心 棱中点氯离子:面心 顶点,或反之。每个晶胞含钠离子、氯离子的个数:与Na+等距离且最近的Na+ 有:12个知识解读知识1、离子晶体Na+:Cl-:-Cl- Na+ NaCl的晶体结构配位数与Na+等距离且最近的Cl 有:6个知识解读知识1、离子晶体(2)氯化铯型晶胞铯离子和氯离子的位置:Cs+:体心 Cl-:顶点;或反之。每个晶胞含Cs+、Cl-个数:1与Cs+等距离且最近
10、的Cs+、Cl-Cs+:6个;Cl-:8个(配位数)知识解读5、晶胞类型:知识1、离子晶体-Cs+-Cl-知识解读CsCl晶体知识1、离子晶体5、晶胞类型:(3)CaF2型晶胞一个CaF2晶胞中4个Ca2+和8个FCa2+的配位数:8F-的配位数:4知识解读知识1、离子晶体5、晶胞类型:(4)ZnS型晶胞1个ZnS晶胞4个阳离子4个阴离子阳离子配位数:4 阴离子配位数:4知识解读知识1、离子晶体5、晶胞类型:6、决定离子晶体结构因素离子键的纯粹因素 7、离子晶体的特点:几何因素正负离子的半径比电荷因素正负离子的电荷比键性因素知识解读知识1、离子晶体无单个分子;无分子式。熔沸点较高,硬度较大,难
11、挥发难压缩。一般易溶于水,难溶有机溶剂。固态不导电,水溶液或熔融状态下导电。数据导学填空下表并思考:离子晶体阴离子配位数阳离子配位数NaClCsCl6688什么因素决定了离子晶体中离子的配位数?配位数468半径比0.20.40.40.70.71.0空间构型ZnSNaClCsCl思考交流根据下表数据分析影响离子晶体中离子配位数的因素。知识2、晶格能一定程度上可以用来衡量离子键的强弱1、定义:拆开1mol 离子晶体,形成完全气态阴阳离子所吸收的能量。氟化物晶格能/kJmol-1NaF923MgF22957AlF35492问题解读知识2、晶格能符号 U2、晶格能的大小的影响因素离子半径、所带电荷所带
12、电荷越多,离子半径越小,离子间的距离越小,晶格能越大问题解读知识2、晶格能晶格能随离子间距的减小而增大,因此随着阳离子或阴离子半径的减小,晶格能增大;晶格能愈大,晶体的熔点就愈高。晶格能 q1. q2 /r晶格能与阴、阳离子所带电荷的乘积成正比;与阴、阳离子间的距离成反比 。 晶格能的大小还与离子晶体的结构型式有关。带异性电荷的离子之间存在相互吸引,带同性电荷的离子之间却存在相互排斥作用。问题解读知识2、晶格能3、晶格能的作用:岩浆晶出规则与晶格能矿物晶格能KJ/mol晶出次序ZnS771.41先PbS670.0后橄榄石4400最先晶体析出次序与晶格能形成的晶体越稳定熔点越高硬度越大离子键越强
13、晶格能越大构成微粒阴(阳)离子 几何因素 电荷因素 键性因素2.决定离子晶体结构的因素正负离子半径比离子键的纯粹程度 3.晶格能概念晶格能作用影响晶格能大小的因素课时小结当堂感悟1.离子晶体结构特点微粒间作用力离子键正负离子电荷比当堂感悟离子晶体的结构模型晶体结构模型配位数Cl、Na都 6Cl和Cs都 8F 4Ca2 8晶胞中微粒数Na、Cl都 4Cs、Cl都 1Ca2 4F 8阴阳离子个数比111121化学式NaClCsClCaF21、如图是氯化铯晶体的晶胞,已知晶体中两个最近的Cs离子核间距离为a cm,氯化铯相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )晶体密度 C当堂巩固晶胞内属于晶胞顶点8个晶胞共用每个晶胞有1个Cs- 1个Cl-1mol氯化铯 V= NA a3 cm32.已知XYZ三种元素组成化合物是离子晶体其晶胞如图,XYZ分别处于立方体顶点、棱边中点、立方体体心。下面关于该化合物说法正确的是()A该晶体的化学式为ZXY3B该晶体的熔点一定比金属晶体
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 家具公司原材料保管优化制度(规则)
- 打非治违年终工作总结4
- 某服装公司薪酬福利发放制度
- 我国跨境人民币结算:发展态势、风险洞察与防范策略
- 我国证券市场关联交易法律规制的实践审视与完善路径
- 政府严格规范招投标制度
- 实验室环境规范考核制度
- 班主任日常管理制度档案
- 人大档案工作制度研究室
- 小吃一条街规范化管理制度
- 初中地理八年级《中国的气候特征及其影响》教学设计
- 广州大学《电磁场与电磁波》2023-2024学年第二学期期末试卷
- 中国家居照明行业健康光环境与智能控制研究报告
- 主动防护网系统验收方案
- 医学人文关怀培训课件
- 基于BIM的ZN花园14号住宅楼工程清单与招标控制价编制
- 压缩机操作工岗位操作技能评估
- 2025年小学三年级语文单元测试模拟卷(含答案)
- 河北省石家庄第二中学2025-2026学年高一上数学期末联考试题含解析
- 【必会】自考《管理学原理》13683备考题库宝典-2025核心题版
- 土方施工环保措施方案

评论
0/150
提交评论