



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、Chap.12 电化学分析法电化学分析法Electrochemical Methods12.1概述概述一、一、 什么是电化学分析?运用电化学的根什么是电化学分析?运用电化学的根本原理和实验技术,根据物质电化学性本原理和实验技术,根据物质电化学性质来测定物质组成及含量的分析方法称质来测定物质组成及含量的分析方法称为电化学分析或电分析化学。为电化学分析或电分析化学。二、电化学分析法的特点二、电化学分析法的特点1灵敏度、准确度高,选择性好;能进灵敏度、准确度高,选择性好;能进展组成、形状、价态和相态分析。展组成、形状、价态和相态分析。 2电化学仪器安装较为简单,操作方便电化学仪器安装较为简单,操作方
2、便 直接得到电信号,易传送,尤其适宜于直接得到电信号,易传送,尤其适宜于消费自动控制和在线分析消费自动控制和在线分析3运用广泛运用广泛 传统电化学分析:无机离子的分析;传统电化学分析:无机离子的分析; 测定有机化合物也日益广泛;测定有机化合物也日益广泛; 有机电化学分析;药物分析;有机电化学分析;药物分析; 三、分类三、分类 1.1电导分析法电导分析法 2电位分析法电位分析法 3伏安分析法伏安分析法 4极谱分析法极谱分析法 5库仑分析法库仑分析法 2电位滴定法电位滴定法 1电导滴定电导滴定2电位滴定电位滴定3电流滴定电流滴定 3电解分析法电解分析法 12.2 电化学分析根底电化学分析根底一一
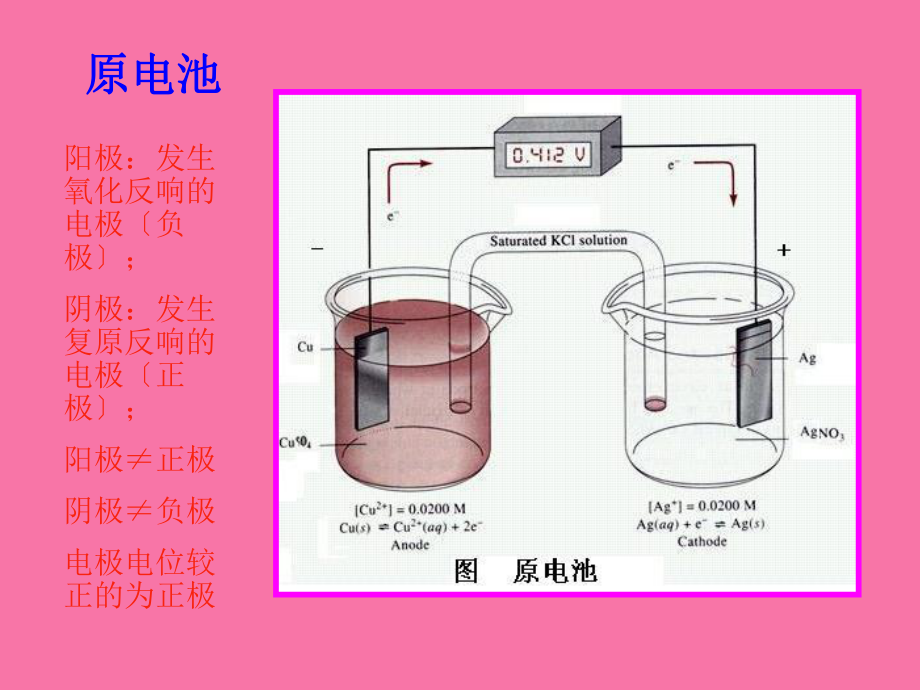
3、化学电池化学电池 chemical cell1原电池原电池 化学能化学能电能电能 2电解池电解池 电能电能化学能化学能3电导池电导池 电解质溶液的导电特性电解质溶液的导电特性 原电池原电池阳极:发生氧化反响的电极负极;阴极:发生复原反响的电极正极;阳极正极阴极负极电极电位较正的为正极正极 Cu2+ + 2e = Cu (复原反响) 负极 Zn - 2e = Zn2+(氧化反响) 电池反响为Zn + Cu2+ = Zn2+ + Cu 电池符号:Zn2+ Zn; Cu2+ Cu电解电池电解电池阳极:发生氧化反响的电极正极;阴极:发生复原反响的电极负极;阳极=正极阴极=负极二、电池电动势二、电池电动
4、势 1电极和溶液的相界面电位差电极和溶液的相界面电位差 2电极和导线的相界面电位差电极和导线的相界面电位差 3液体与液体的相界面电位差液体与液体的相界面电位差 液体接界电位产生的缘由:各种离子具液体接界电位产生的缘由:各种离子具有不同的迁移速率而引起。有不同的迁移速率而引起。 E=+ - - 三、电极电位三、电极电位 electrochemical potentials 1规范电极电位规范电极电位 0(H+/H2)=0V 在任何温度下规范氢电极的电极电势都为在任何温度下规范氢电极的电极电势都为0 2.电极电位方程式 nernst equation 对于恣意一个电极反响 aOx + ne = b
5、Red = 0 +0.059/n lgOxa/Redb 3条件电极电位四、电解和极化四、电解和极化1分解电压和反电压分解电压和反电压2超电位超电位超电位产生的缘由:超电位产生的缘由:1电化学极化电化学极化2浓差极化浓差极化3极化景象极化景象普通阳极极化时,其电极电位更正;阴极普通阳极极化时,其电极电位更正;阴极极化时,电极电位更负。极化时,电极电位更负。 12.3电极分类电极分类 classification of electrodes一、按电极反响机理分类一、按电极反响机理分类 1金属基电极金属基电极 1金属金属-金属离子电极,一个相界面金属离子电极,一个相界面 例如:例如:Ag-AgNO3
6、电极电极(银电极银电极),Zn-ZnSO4电极电极(锌电极锌电极)等等第一类电极的电位仅与金属离子的活度有第一类电极的电位仅与金属离子的活度有关。关。 2金属金属-金属难溶盐电极,二个相界面金属难溶盐电极,二个相界面,常用作参比电极常用作参比电极 如甘汞电极电极反响:Hg2Cl2 + 2e- = 2Hg + 2 Cl-半电池符号:Hg,Hg2Cl2固KCl 2 2、膜电极、膜电极 特点: 仅对溶液中特定离子有选择性呼应离子选择性电极。 膜电极的关键:是一个称为选择膜的敏感元件。 敏感元件:单晶、混晶、液膜、高分子功能膜及生物膜等构成。 膜内外被测离子活度的不同而产生电位差。二、按电极用途分类二
7、、按电极用途分类 1.指示电极和任务电极指示电极和任务电极 2.参比电极和辅助电极参比电极和辅助电极 Chap.13电位分析法电位分析法Potentiometry 原理:原电池原理:原电池 当测定时,参比电极的电极电位坚持不当测定时,参比电极的电极电位坚持不变,电池电动势随指示电极的电极电位变,电池电动势随指示电极的电极电位而变,而指示电极的电极电位随溶液中而变,而指示电极的电极电位随溶液中待测离子活度而变。待测离子活度而变。分类分类: 直接电位法直接电位法 电位滴定法电位滴定法 13.1离子选择性电极离子选择性电极 selective electrode 离子选择性电极离子选择性电极( (又
8、称膜电极又称膜电极) )。 19761976年年IUPACIUPAC基于膜的特征,引荐将其分为以下几类:基于膜的特征,引荐将其分为以下几类: 原电极原电极primary electrodesprimary electrodes 晶体膜电极晶体膜电极crystalline membrane electrodescrystalline membrane electrodes 均相膜电极均相膜电极homogeneous membrane electrodeshomogeneous membrane electrodes 非均相膜电极非均相膜电极(heterogeneous membrane elec
9、trodes)(heterogeneous membrane electrodes) 非晶体膜电极非晶体膜电极crystalline membrane electrodescrystalline membrane electrodes 刚性基质电极刚性基质电极rigid matrix electrodesrigid matrix electrodes 流动载体电极流动载体电极(electrodes with a mobile carrier)(electrodes with a mobile carrier) 敏化电极敏化电极sensitized electrodessensitized el
10、ectrodes 气敏电极气敏电极gas sensing electrodesgas sensing electrodes 酶电极酶电极enzyme electrodesenzyme electrodes1均相膜电极均相膜电极构造:氟电极构造:氟电极敏感膜:氟化镧单晶敏感膜:氟化镧单晶,有有EuF2 的的LaF3单晶切片;单晶切片;内参比电极:内参比电极:Ag-AgCl电极管内。电极管内。内参比溶液:内参比溶液:0.1mol/L的的NaCl和和0.10mol/L的的NaF原理原理: LaF3的晶格中有空穴,在晶格上的的晶格中有空穴,在晶格上的F-可以移可以移入晶格临近的空穴而导电。对于一定的晶
11、体膜,入晶格临近的空穴而导电。对于一定的晶体膜,离子的大小、外形和电荷决议其能否可以进入晶离子的大小、外形和电荷决议其能否可以进入晶体膜内,故膜电极普通都具有较高的离子选择性。体膜内,故膜电极普通都具有较高的离子选择性。 当氟电极插入到当氟电极插入到F-溶液中时,溶液中时,F-在晶体膜外表进在晶体膜外表进展交换。展交换。 E膜膜 = K - 0.059 lgaF- = K + 0.059 pF 具有较高的选择性,需求在具有较高的选择性,需求在pH57之间运用之间运用2非均相膜电极非均相膜电极敏感膜由各种电活性物质与惰性基质如橡胶、聚乙敏感膜由各种电活性物质与惰性基质如橡胶、聚乙烯、聚丙稀、石蜡
12、等混合制成的。烯、聚丙稀、石蜡等混合制成的。一、晶体膜电极一、晶体膜电极 (crystalline membrance electrodes) 二、非晶体膜电极二、非晶体膜电极1.玻璃膜电极玻璃膜电极1构造构造2玻璃膜电位的构成玻璃膜电位的构成 玻璃电极运用前,必需在水溶液中浸泡,生成三层构造,即中间的干玻璃层和两边的水化硅胶层 水化硅胶层厚度:0.0110 m。在水化层,玻璃上的Na+与溶液中H+发生离子交换而产生相界电位。 水化层外表可视作阳离子交换剂。溶液中H+经水化层分散至干玻璃层,干玻璃层的阳离子向外分散以补偿溶出的离子,离子的相对挪动产生分散电位。 两者之和构成膜电位。讨论讨论(1
13、)膜电位与试样溶液中的膜电位与试样溶液中的pH成线性关系。成线性关系。(2)电极电位应是内参比电极电位和玻璃膜电位之和;电极电位应是内参比电极电位和玻璃膜电位之和;(3)不对称电位不对称电位E膜膜(4) 高选择性高选择性 :膜电位的产生不是电子的得失。其它:膜电位的产生不是电子的得失。其它离子不能进入晶格产生交换。当溶液中离子不能进入晶格产生交换。当溶液中Na+浓度比浓度比H+浓度高浓度高1015倍时,两者才产生一样的电位;倍时,两者才产生一样的电位;(5)酸差:测定溶液酸度太大酸差:测定溶液酸度太大pH12产生误差,主要是产生误差,主要是Na+参与相界面上的交换所致;参与相界面上的交换所致;
14、(7) 优点:是不受溶液中氧化剂、复原剂、颜色及沉优点:是不受溶液中氧化剂、复原剂、颜色及沉淀的影响,不易中毒;淀的影响,不易中毒;(8) 缺陷:是电极内阻很高,电阻随温度变化。缺陷:是电极内阻很高,电阻随温度变化。 2、流动载体膜电极液膜电极、流动载体膜电极液膜电极(electrodes with a mobile carrier) 1带正电荷的流动载体带正电荷的流动载体 钙电极:内参比溶液为含钙电极:内参比溶液为含 Ca2+水溶液。内外管之间装的是水溶液。内外管之间装的是0.1mol/L二癸基磷二癸基磷酸钙酸钙(液体离子交换剂液体离子交换剂)的苯基磷酸二辛酯溶液。其极易分散进入微孔膜,但不
15、溶的苯基磷酸二辛酯溶液。其极易分散进入微孔膜,但不溶于水,故不能进入试液溶液。于水,故不能进入试液溶液。2带负电荷的流动载体带负电荷的流动载体 硝酸根离子电极硝酸根离子电极3中性载体中性载体 钾电极钾电极三、敏化电极三、敏化电极 (sensitized electrodes) 1气敏电极气敏电极(gas sensing) 基于界面化学反响的敏化电极基于界面化学反响的敏化电极 试样中待测组分气体分散经过透气膜,试样中待测组分气体分散经过透气膜,进入离子选择电极的敏感膜与透气膜之进入离子选择电极的敏感膜与透气膜之间的极薄液层内,使液层内离子选择电间的极薄液层内,使液层内离子选择电极敏感的离子活度变
16、化,那么离子选择极敏感的离子活度变化,那么离子选择电极膜电位改动,故电池电动势也发生电极膜电位改动,故电池电动势也发生变化。变化。2酶电极酶电极 (enzyme electrodes) 基于界面酶催化化学反响的敏化电极; 酶特性:酶是具有特殊生物活性的催化剂,对反响的选择性强,催化效率高,可使反响在常温、常压下进展; 可被现有离子选择性电极检测的常见的酶催化产物: CO2,NH3,NH4+,CN-,F-,S2-,I-,NO2- 酶催化反响: CO(NH2 )2 + H2O 2NH3 + CO2 氨电极检测尿酶葡萄糖氧化酶葡萄糖 + O2 + H2O 葡萄糖酸 + H2 O2 氧电极检测13.2
17、离子选择性电极的主要性离子选择性电极的主要性能参数能参数 一、呼应斜率与检测限一、呼应斜率与检测限 1呼应斜率呼应斜率2.检测下限检测下限 3检测上限检测上限 二、电极的选择性系数二、电极的选择性系数 例:某硝酸根电极对硫酸根的选择系数:例:某硝酸根电极对硫酸根的选择系数:K NO-3,SO42- = 4.110-5,用此电极在用此电极在1.0 mol/L硫酸盐介质中测定硝酸根硫酸盐介质中测定硝酸根,假设要假设要求丈量误差不大于求丈量误差不大于5%,试计算可以测定的试计算可以测定的硝酸根的最低活度为多少硝酸根的最低活度为多少?解:解: NO- ,SO2-aSO42-zi/zj /aNO3- 5
18、% aNO3- 4.110-51.0 1/2/5 aNO3- 8.210-4mol/L。 测定的硝酸根离子的活度应大于测定的硝酸根离子的活度应大于8.210-4mol/L。三、呼应时间、稳定性和重现性三、呼应时间、稳定性和重现性1呼应时间呼应时间2稳定性:电极的稳定程度,用漂移来衡稳定性:电极的稳定程度,用漂移来衡量量3重现性:重现性: 13.3离子选择性电极分析的仪器离子选择性电极分析的仪器 一、电池电动势的丈量原理一、电池电动势的丈量原理二、丈量仪器二、丈量仪器1对丈量仪器的要求对丈量仪器的要求1输入阻抗输入阻抗2丈量精度和量程丈量精度和量程 3定位定位 4温度和电极斜率补偿温度和电极斜率
19、补偿 2 2pHpH计计指示电极:指示电极:pHpH玻璃膜电极玻璃膜电极参比电极:饱和甘汞电极参比电极:饱和甘汞电极Ag, AgCl | HCl | 玻璃膜玻璃膜 | 试液溶液试液溶液 KCl(饱和饱和 | Hg2Cl2固,固, Hg 玻璃玻璃 液接液接 甘汞甘汞电池电动势为:电池电动势为:常数常数K包括:包括: 外参比电极电位外参比电极电位 内参比电极电位内参比电极电位 不对称电位不对称电位 液接电位液接电位LHEaFRTKEEEEEEEEEE lg303. 2)(AgCl/Ag/HgClHgAgCl/Ag/HgClHg2222液液接接膜膜液液接接玻玻璃璃甘甘汞汞pH059. 0 :C25p
20、H303. 2 KEFRTKE3离子计 将离子选择性电极指示电极和参比电极插入试液可以组成测定各种离子活度的电池,电池电动势为:离子选择性电极作正极时,离子选择性电极作正极时, 对阳离子呼应的电极,取正号;对阳离子呼应的电极,取正号; 对对 阴离子呼应的电极,取负号。阴离子呼应的电极,取负号。ianFRTKElg303. 2 13.4影响电位测定准确性的要素影响电位测定准确性的要素 1.丈量温度2.呼应时间3. 溶液特性 4. 电位丈量误差 5.干扰离子6被测离子的浓度普通10-110-6 mol/L7迟滞效应13.5电位分析及离子选择性电极电位分析及离子选择性电极分析的方法及运用分析的方法及
21、运用 一、直接电位法一、直接电位法1直接比较法直接比较法2规范曲线法规范曲线法 用测定离子的纯物质配制一系列不同用测定离子的纯物质配制一系列不同浓度的规范溶液,并用总离子强度调理缓浓度的规范溶液,并用总离子强度调理缓冲溶液冲溶液Totle Ionic Strength Adjustment Buffer简称简称TISAB坚持溶液的离子强度相坚持溶液的离子强度相对稳定,分别测定各溶液的电位值,并绘对稳定,分别测定各溶液的电位值,并绘制制: E - lg ci 关系曲线。关系曲线。 留意:离子活度系数坚持不变时,膜电位才与留意:离子活度系数坚持不变时,膜电位才与log cilog ci呈呈线性关系
22、。线性关系。Elg ci总离子强度调理缓冲溶液总离子强度调理缓冲溶液Totle Ionic Strength Adjustment Buffer简称简称TISAB TISAB的作用:的作用:坚持较大且相对稳定的离子强度,使活度系数坚持较大且相对稳定的离子强度,使活度系数恒定;恒定;维持溶液在适宜的维持溶液在适宜的pH范围内,满足离子电极的范围内,满足离子电极的要求;要求;掩蔽干扰离子。掩蔽干扰离子。 测测F-过程所运用的过程所运用的TISAB典型组成:典型组成:1mol/L的的NaCl,使溶液坚持较大稳定的离子强度;,使溶液坚持较大稳定的离子强度;0.25mol/L的的HAc和和0.75mol
23、/L的的NaAc, 使溶液使溶液pH在在5左右;左右;0.001mol/L的柠檬酸钠的柠檬酸钠, 掩蔽掩蔽Fe3+、Al3+等干扰离子。等干扰离子。3规范参与法规范参与法 设某一试液体积为V0,其待测离子的浓度为cx,测定的任务电池电动势为E1,那么:式中:式中:i为游离态待测离子占总浓度的分数;为游离态待测离子占总浓度的分数;i是活度系数;是活度系数; cx 是待测离子的总浓度。是待测离子的总浓度。 往试液中准确参与一小体积往试液中准确参与一小体积Vs(大约为大约为V0的的1/100)的用待的用待测离子的纯物质配制的规范溶液测离子的纯物质配制的规范溶液, 浓度为浓度为Cs(约为约为cx的的100倍倍)。由于。由于V0Vs,可以为溶液体积根本不变。,可以为溶液体积根本不
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 中国脱毒红薯木薯种植项目创业计划书
- 中国计算机咨询项目创业计划书
- 中国境外通信设备项目创业计划书
- 中国动脉压迫止血器项目创业计划书
- 中国电子商务采购项目创业计划书
- 中国端游项目创业计划书
- 毕业生个人简历表
- 毕业审计实习报告八篇
- 乐清保安考试题纲及答案
- 鸡肉品质提升-洞察阐释
- 2025年一级注册计量师考试题库大全及答案
- 全球电力行业的技术创新与展望
- 第四章-饲料分类
- 预防艾梅乙母婴传播知识
- 洁净室及相关受控环境 运维服务 征求意见稿
- 总监述职报告
- 儿童意外伤害预防及家庭安全教育推广研究报告
- 会计研究方法论 第4版 课件 第9章 非结构化数据分析方法
- 中药草本洗发水DIY体验企业制定与实施新质生产力战略研究报告
- 两相交错并联Boost变换器的设计及仿真分析
- 医患沟通技巧课件

评论
0/150
提交评论