



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
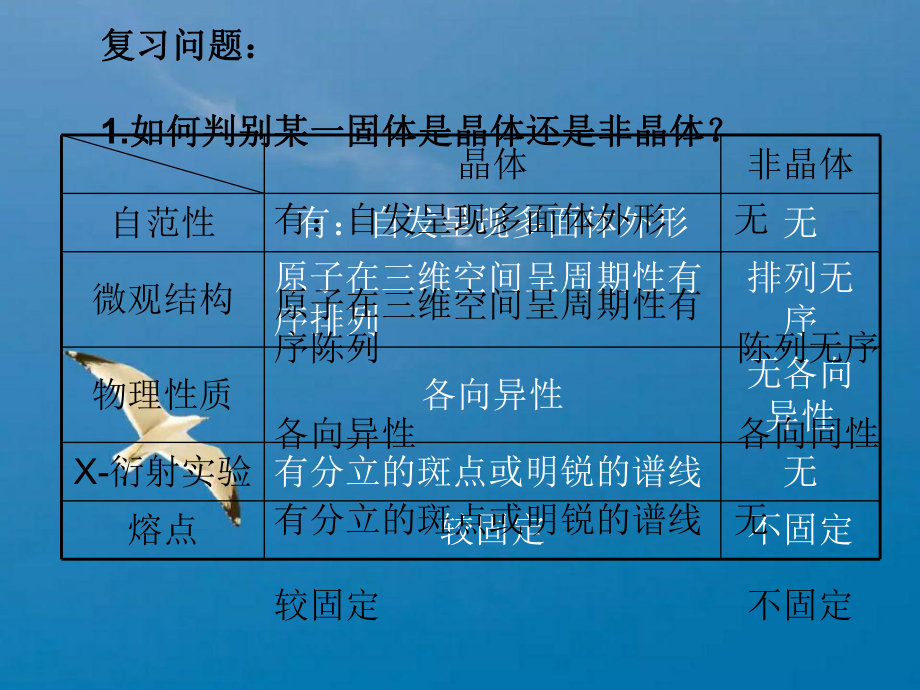
1、认识晶体认识晶体 第一节第一节 晶体的常识晶体的常识 1、从认识一般固体出发,重点了解晶体的基本特征、类型以及不同类型晶体的一般物理性质。2、晶体形成的途径及特性。3、晶体与非晶体的区别。4、晶胞的概念。5、晶胞中原子个数的计算。复习问题:复习问题:1.如何判别某一固体是晶体还是非晶体?如何判别某一固体是晶体还是非晶体?晶体非晶体自范性有:自发呈现多面体外形无微观结构原子在三维空间呈周期性有序排列排列无序物理性质各向异性无各向异性X-衍射实验 有分立的斑点或明锐的谱线无熔点较固定不固定有:自发呈现多面体外形无原子在三维空间呈周期性有序陈列 陈列无序各向异性 各向同性有分立的斑点或明锐的谱线无较
2、固定 不固定1(1).1(1).晶体和非晶体最大的区别是晶体和非晶体最大的区别是A.A.能否有规那么的几何外形能否有规那么的几何外形B.B.能否有较高的硬度能否有较高的硬度C.C.物质内部的微粒能否有序地规那么陈列物质内部的微粒能否有序地规那么陈列D.D.能否有固定的熔沸点能否有固定的熔沸点1(2).1(2).以下有关晶体和非晶体的说法中正确的选项是以下有关晶体和非晶体的说法中正确的选项是A.A.具有规那么几何外形的固体均为晶体具有规那么几何外形的固体均为晶体B.B.晶体具有自范性晶体具有自范性, ,非晶体没有自范性非晶体没有自范性C.C.晶体研碎后即变成非晶体晶体研碎后即变成非晶体D.D.将
3、玻璃加工成规那么的固体即变成晶体将玻璃加工成规那么的固体即变成晶体离子晶体原子晶体分子晶体金属晶体存在微粒构晶作用离子键共价键范德华力金属键熔沸点高很高低高或低硬度硬而脆质地硬硬度小延展性导电性熔化时能够导电,导电性差,水溶液能够导电电和热的良导体,实例1.金属氧化物2.强碱3.大部分盐金刚石、二氧化硅、金刚砂(SiC)晶体硅1.非金属氧化 物、单质、氢化物2.酸3.绝大多数有机物所有的金属及合金 阴阳离子 原子 分子 自在电子 金属离子1.金刚石、2.二氧化硅、3.金刚砂(SiC)4.晶体硅1.非金属氧化物、单质、氢化物2.酸3.绝大多数有机一切的金 属及合金1.金属氧化物2.强碱3.大部分
4、盐熔化时可以导电 导电性差 水溶液可以导电 电和热 的良导体硬而脆 质地硬 硬度小 延展性高 很高 低 高或低 离子键 共价键 范德华力 金属键二、各种晶体类型的比较二、各种晶体类型的比较【问题】总结各类晶体的分类根据【问题】总结各类晶体的分类根据2 2、根本概念辨析、根本概念辨析以下各组物质的晶体中,化学键类型一样,以下各组物质的晶体中,化学键类型一样,晶体类型也一样的是晶体类型也一样的是 ( ) ( )A ASO2 SO2 和和 SiO2 SiO2 B BCO2 CO2 和和 H2O H2O C CNaCl NaCl 和和 HCl HCl D DCCl4 CCl4 和和 KCl KCl以下
5、各组物质气化或熔化时,所抑制的微粒以下各组物质气化或熔化时,所抑制的微粒间的作用力,属同种类型的是间的作用力,属同种类型的是 ( ) ( )A A碘和干冰的升华碘和干冰的升华B B二氧化硅和生石灰的熔化二氧化硅和生石灰的熔化C C氯化钠和铁的熔化氯化钠和铁的熔化 D D水和四氯化碳的蒸发水和四氯化碳的蒸发 三、判别晶胞中的粒子数三、判别晶胞中的粒子数3(1) .某离子晶体的构造部分如图,某离子晶体的构造部分如图,X位位于立方体的顶点,于立方体的顶点,Y位于立方体的中心,那么该位于立方体的中心,那么该晶晶体的化学式是体的化学式是X : Y = 1/84 : 1= 1/2 : 1XYXY2= 1
6、: 23(2)现有甲、乙两种晶体的晶胞:甲中现有甲、乙两种晶体的晶胞:甲中x处处于体心,乙中于体心,乙中a处于体心可推知:甲晶体中处于体心可推知:甲晶体中x与与y的个数比是,乙中的个数比是,乙中a与与b的个数比是的个数比是 。甲甲乙乙3(3)以下图为高温超导领域中的一种化合物以下图为高温超导领域中的一种化合物钙钛钙钛矿氧化物晶体构造中具有代表性的最小反复单元。矿氧化物晶体构造中具有代表性的最小反复单元。1在该物质的晶体中,每个钛离子周围与它最接在该物质的晶体中,每个钛离子周围与它最接近且间隔相等的钛离子共有近且间隔相等的钛离子共有_个。个。2该晶体构造中,氧、钛、钙的离子个数比是该晶体构造中,
7、氧、钛、钙的离子个数比是_。63:1:13(4). 现有甲、乙、丙、丁四种晶体,离子陈列现有甲、乙、丙、丁四种晶体,离子陈列方式如下图,根据离子晶体的晶胞晶体中最方式如下图,根据离子晶体的晶胞晶体中最小反复单位求阴、阳离子个数比的方法,其小反复单位求阴、阳离子个数比的方法,其中化学式不正确的选项是中化学式不正确的选项是 A金属晶体金属晶体 严密堆严密堆积积A1堆积A3堆积A2堆积晶晶体体晶体基本概念和结构( (晶胞及其类型、配位数、空隙、粒子数计算、碓砌方式等) )晶体类型和性质( (4 4种晶体类型、结构和性质特点、晶格能、X X- -射线衍射等) )堆积类型面心立方最密堆积(A1)六方最密
8、堆积(A3)体心立方密堆积(A2)简单立方堆积金刚石型堆积(A4)最密堆积空间利用率的计算空间利用率的计算 空间利用率:指构成晶体的原子、离子或分子在空间利用率:指构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。整个晶体空间中所占有的体积百分比。 球体积球体积 空间利用率空间利用率= 100% 晶胞体积晶胞体积氢键具有方向性氢键具有方向性1 mol冰中含几摩尔冰中含几摩尔氢键?氢键? 只需范德华力,无分子间氢键,可构成分子密堆积;只需范德华力,无分子间氢键,可构成分子密堆积;有分子间氢键,不能构成分子密堆积如有分子间氢键,不能构成分子密堆积如HF,NH3,H2O内容体系内容体系第
9、一节简单引见晶体的常识,区别晶体与非晶体,认识第一节简单引见晶体的常识,区别晶体与非晶体,认识什么是晶胞:什么是晶胞:第二节第二节“分子晶体和原子晶体分别引见了分子晶体和分子晶体和原子晶体分别引见了分子晶体和原子晶体的构造特征及晶体特性,在陈说分子晶体的原子晶体的构造特征及晶体特性,在陈说分子晶体的构造特征时,以干冰为例,引见了假设分子晶体中分构造特征时,以干冰为例,引见了假设分子晶体中分子问作用力只是范德华力时,分子晶体具有分子密堆子问作用力只是范德华力时,分子晶体具有分子密堆积特征;同时,教科书以冰为例,引见了冰晶体里由积特征;同时,教科书以冰为例,引见了冰晶体里由于存在氢键而使冰晶体的构
10、造具有其特殊性。于存在氢键而使冰晶体的构造具有其特殊性。在第三节在第三节“金属晶体中,首先从金属晶体中,首先从“电子气实际引见了电子气实际引见了金属键及金属晶体的特性,然后以图文并茂的方式描金属键及金属晶体的特性,然后以图文并茂的方式描画了金属晶体的四种根本堆积方式。画了金属晶体的四种根本堆积方式。在第四节在第四节“离子晶体中,由于学生已学过离子键的概离子晶体中,由于学生已学过离子键的概念,教科书直接给出了念,教科书直接给出了NaCl和和CsCl两种典型离子晶两种典型离子晶体的晶胞,然后经过体的晶胞,然后经过“科学探求讨论了科学探求讨论了NaCl和和CsCl两种晶体的构造;教科书还经过例子重点
11、讨论了影响两种晶体的构造;教科书还经过例子重点讨论了影响离子晶体构造的几何要素和电荷要素,而对键性要素离子晶体构造的几何要素和电荷要素,而对键性要素不作要求。不作要求。晶格能是反映离子晶体中离子键强弱的重要数据,教科晶格能是反映离子晶体中离子键强弱的重要数据,教科书经过表格方式列举了某些离子晶体的晶格能,以及书经过表格方式列举了某些离子晶体的晶格能,以及晶格能的大小与离子晶体的性质的关系。晶格能的大小与离子晶体的性质的关系。 晶格能晶格能 晶格能晶格能(U)(U)是指将是指将1 1摩离子摩离子晶体里的正负离子抑制晶体中的静晶体里的正负离子抑制晶体中的静电引力完全气化而远离所需求吸收电引力完全气
12、化而远离所需求吸收的能量数符为的能量数符为+ +。例如:。例如:N a C l ( s ) N a + ( g ) + C lN a C l ( s ) N a + ( g ) + C l ( g ) ( g ) U=786kJmolU=786kJmol1 1晶格能越大,阐明离子晶体中的离子晶格能越大,阐明离子晶体中的离子键越稳定。普通而言,晶格能越高,键越稳定。普通而言,晶格能越高,离子晶体的熔点越高、硬度越大。晶离子晶体的熔点越高、硬度越大。晶格能大小还影响着离子晶体在水中的格能大小还影响着离子晶体在水中的溶解度、溶解热等性质。溶解度、溶解热等性质。 LiF LiF L i C l L i
13、 B r L i C l L i B r LiI(g/100mLH2O)LiI(g/100mLH2O) 0.27 64 0.27 64 145 165145 165注:无机盐的溶解是水合离子的生成过程:注:无机盐的溶解是水合离子的生成过程: MX(s)M+(g)+X-(g) M+(aq)+X-(aq)离子晶体在水中的溶解度与溶解热不但与晶体中离子离子晶体在水中的溶解度与溶解热不但与晶体中离子抑制晶格能进入水中吸收的能量有关,还与进入水中抑制晶格能进入水中吸收的能量有关,还与进入水中的离子发生水化放出的能量水化热有关。的离子发生水化放出的能量水化热有关。本章教材位置本章教材位置本单元知识是在原子
14、构造和元素周期律本单元知识是在原子构造和元素周期律以及化学键等知识的根底上引见的,以及化学键等知识的根底上引见的,是原子构造和化学键知识的延伸和提是原子构造和化学键知识的延伸和提高;高;本单元知识围绕晶体作了详尽的引见,本单元知识围绕晶体作了详尽的引见,晶体与玻璃体的不同,分子晶体、原晶体与玻璃体的不同,分子晶体、原子晶体、金属晶体、离子晶体,从构子晶体、金属晶体、离子晶体,从构成晶体的微粒、晶胞、微粒间的作用成晶体的微粒、晶胞、微粒间的作用力,熔沸点比较等物理性质做了比较,力,熔沸点比较等物理性质做了比较,结合许多彩图及详尽的事例,对四大结合许多彩图及详尽的事例,对四大晶体做了论述;晶体做了
15、论述;同时,本单元结合数学立体几何知识,同时,本单元结合数学立体几何知识,充分认识和发掘典型晶胞的构造,去充分认识和发掘典型晶胞的构造,去笼统、直观地认识四种晶体笼统、直观地认识四种晶体. “本章比较全面而系统地引见了晶体构造本章比较全面而系统地引见了晶体构造和性质,作为本书的结尾章,与前两和性质,作为本书的结尾章,与前两章一同构成章一同构成“原子构造与性质、分子构原子构造与性质、分子构造与性质、晶体构造与性质三位一造与性质、晶体构造与性质三位一体的体的“物质构造与性质模块的根本内物质构造与性质模块的根本内容。容。三难点三难点1、晶体构造模型。、晶体构造模型。2、金属晶体的原子堆积模型、金属晶
16、体的原子堆积模型四方法指点四方法指点1、注重新旧知识之间的内在联络、注重新旧知识之间的内在联络本章内容跟前面所学的化学键有亲密的联络。留意运用离子键、共价键、本章内容跟前面所学的化学键有亲密的联络。留意运用离子键、共价键、金属键、范德华力和氢键的有关知识来分析解释四种晶体的构造和性质。金属键、范德华力和氢键的有关知识来分析解释四种晶体的构造和性质。2、留意概念之间的联络和区别、留意概念之间的联络和区别运用对比的方法,分析四种晶体的概念及性质,相互比较深化了解所学运用对比的方法,分析四种晶体的概念及性质,相互比较深化了解所学的知识。留意知识的系统化和网络化。的知识。留意知识的系统化和网络化。3、
17、对于晶体的类型,重点讲透四种晶体的概念、相互作用及重要物理性、对于晶体的类型,重点讲透四种晶体的概念、相互作用及重要物理性质,运用化学键的知识解释晶体的有关物理性质,运用晶体的性质来判质,运用化学键的知识解释晶体的有关物理性质,运用晶体的性质来判别晶体类型,根据晶体类型来判别晶体的熔沸点等。别晶体类型,根据晶体类型来判别晶体的熔沸点等。4、留意学科之间的内在联络,利用数学的几何知识分析处理有关晶体构、留意学科之间的内在联络,利用数学的几何知识分析处理有关晶体构造知识。造知识。 新概念新概念 1自范性自范性 周期性有序排列周期性有序排列 X X射线衍射射线衍射 各向异各向异性性 晶胞晶胞 并置并
18、置2分子密堆积分子密堆积 方向性方向性 (共价键)(共价键)sp3sp3杂化轨道杂化轨道 (金刚石)(金刚石) 摩氏硬度摩氏硬度3电子气理论电子气理论 热导率热导率 密置层密置层 非密置层非密置层 堆积方堆积方式式 原子堆积模型原子堆积模型 空间利用率空间利用率 最密堆积最密堆积 配位配位数数 K K型型 MgMg型型 CuCu型型4几何因素几何因素 电荷因素电荷因素 键性因素(比作要求)键性因素(比作要求) 晶晶格能格能 岩浆晶出规则岩浆晶出规则 第一节第一节 晶体的常识晶体的常识 1、从认识一般固体出发,重点了解晶体的基本特征、类型以及不同类型晶体的一般物理性质。2、晶体形成的途径及特性。
19、3、晶体与非晶体的区别。4、晶胞的概念。5、晶胞中原子个数的计算。第二节第二节 分子晶体分子晶体与原子晶体与原子晶体1、理解范德华力、键的实质2、了解范德华力与氢键关系3、了解范德华力、氢键与化学键的关系4、运用所学知识解释物质熔沸点变化的原因5、会运用所学知识判断晶体类型6、会区分范德华力、化学键与氢键7、知道分子晶体和原子晶体的特点8、了解常见的分子晶体和原子晶体第三节第三节 金属晶体金属晶体1、掌握金属键的概念。2、能初步用金属键理论来解释金属的特性。3、了解电子气理论并能用电子气理论解释金属通性。4、掌握金属原子堆积的4种基本模式。5、初步认识金属晶体结构与性质的关系。第四节 离子晶体
20、1、理解离子晶体的结构模型及其性质的一般特点。2、了解离子晶体中正负离子的电荷比和配位数的关系。 3、了解决定离子晶体结构的重要因素。4、理解离子晶体的晶格能与性质的关系。离子键、共价键和金属键的比较离子键、共价键和金属键的比较化学键类型离子键共价键金属键概念阴、阳离子间通过静电作用所形成的化学键原子间通过共用电子对所形成的化学键金属阳离子与自由电子通过相互作用而形成的化学键成键微粒阴阳离子原子金属阳离子和自由电子成键性质静电作用共用电子对电性作用形成条件活泼金属与活泼的非金属元素非金属与非金属元素金属内部实例NaCl、MgOHCl、H2SO4Fe、Mg化学键分子间作用力概念相邻的原子间强烈的
21、相互作用叫化学键把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力作用范围分子或晶体内分子之间作用力强弱较强与化学键相比弱得多影响的性质主要影响化学性质主要影响物理性质(如熔沸点)化学键与分子间作用力的比较化学键与分子间作用力的比较物质溶沸点的比较物质溶沸点的比较1不同类晶体:普通情况下,原子晶体不同类晶体:普通情况下,原子晶体离子晶体离子晶体分子晶体分子晶体2同种类型晶体:构成晶体质点间的作用大,那么同种类型晶体:构成晶体质点间的作用大,那么熔沸点高,反之那么小。熔沸点高,反之那么小。离子晶体:离子所带的电荷数越高,离子半径越小,离子晶体:离子所带的电荷数越高,离子半径越小,那么其熔沸
22、点就越高。那么其熔沸点就越高。分子晶体:对于同类分子晶体,式量越大,那么熔沸分子晶体:对于同类分子晶体,式量越大,那么熔沸点越高。点越高。原子晶体:键长越小、键能越大,那么熔沸点越高。原子晶体:键长越小、键能越大,那么熔沸点越高。3常温常压下形状常温常压下形状熔点:固态物质熔点:固态物质液态物质液态物质沸点:液态物质沸点:液态物质气态物质气态物质 谢谢 谢!谢!练习题一练习题一 标题:研讨离子晶体,常调查以一个离子标题:研讨离子晶体,常调查以一个离子为中心时,其周围不同间隔的离子对它的为中心时,其周围不同间隔的离子对它的吸引或排斥的静电作用力。设氯化钠晶体吸引或排斥的静电作用力。设氯化钠晶体中
23、钠离子跟离它最近的氯离子之间的间隔中钠离子跟离它最近的氯离子之间的间隔为为d,以钠离子为中心,那么:,以钠离子为中心,那么: 1第二层离子有第二层离子有 12 个,离中心离子的个,离中心离子的间隔为间隔为 ,它们是,它们是 钠钠 离子。离子。d2 2知在晶体中知在晶体中Na+离子的半径为离子的半径为116pm,CI-离离子的半径为子的半径为167pm,它们在晶体中是严密接触,它们在晶体中是严密接触的。求离子占据整个晶体空间的百分数。的。求离子占据整个晶体空间的百分数。 33纳米资料的外表原子占总原于数的比例极大,纳米资料的外表原子占总原于数的比例极大,这是它的许多特殊性质的缘由,假设某氯化钠这
24、是它的许多特殊性质的缘由,假设某氯化钠纳米颗粒的大小和外形恰等于氯化钠晶胞的大纳米颗粒的大小和外形恰等于氯化钠晶胞的大小和外形,求这种纳米颗粒的外表原子占总原小和外形,求这种纳米颗粒的外表原子占总原子数的百分比。子数的百分比。 44假设某氯化钠颗粒外形为立方体,边长为氯假设某氯化钠颗粒外形为立方体,边长为氯化钠晶胞边长的化钠晶胞边长的1010倍,试估算外表原子占总原倍,试估算外表原子占总原子数的百分比。子数的百分比。解答解答1 12, ,钠离子2 V晶胞=2(116pm+167pm)3=181 106pm3 V离子=4 (4/3)(116pm)3+ 4 (4/3)(167pm)3 =10410
25、6 pm3 V离子/ V晶胞=57.5%d23 26/27=96%4 10倍晶胞的纳米颗粒的离子总数:213=9261 9倍晶胞的纳米颗粒的离子总数:193=6859 10倍晶胞的纳米颗粒的外表离子数: 6959-9261=2402 外表原子数所占比例:2402/9261=26%练习题二练习题二鲁教版鲁教版p96 ,10NiO晶体的构外型式与晶体的构外型式与NaCl晶体的构外型式晶体的构外型式完全一样,完全一样,Ni2与最临近的与最临近的O2的核间距的核间距为为a10-10m。试计算。试计算NiO晶体的密度。晶体的密度。知知NiO的摩尔质量为的摩尔质量为74.7g.mol-1此题涉及了此题涉及了中晶体构造的中晶体构造的如下内容:如下内容:晶胞、晶胞类型、晶胞中粒子数的计算、晶胞、晶胞类型、晶胞中粒子数的计算、配位数、堆积方式、密度计算。配位数、堆积方式、密度计算。经过这个标题可以建立晶体构造的晶胞构经过这个标题可以建
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- apg工艺生产管理制度
- 酿造车间生产管理制度
- 生产技术方面制度
- 安全生产法电工管理制度
- 班组安全生产制度范本
- 代加工生产规章制度
- 生产计划管理规章制度
- 生产服务管理制度范本
- 2026山东泰安市属事业单位初级综合类岗位招聘参考考试试题附答案解析
- 2026甘肃白银市平川区容通水务有限公司招聘9人参考考试题库附答案解析
- 清真生产过程管控制度
- 2026年浅二度烧伤处理
- 北京通州产业服务有限公司招聘考试备考题库及答案解析
- 河北省NT名校联合体2025-2026学年高三上学期1月月考英语(含答案)
- 2025-2026学年沪科版八年级数学上册期末测试卷(含答案)
- 途虎养车安全培训课件
- 卫生管理研究论文
- 2025-2026学年人教版(新教材)小学数学二年级下册(全册)教学设计(附教材目录P161)
- 委托市场调研合同范本
- 畜牧安全培训资料课件
- 2025年度党支部书记述职报告

评论
0/150
提交评论