



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
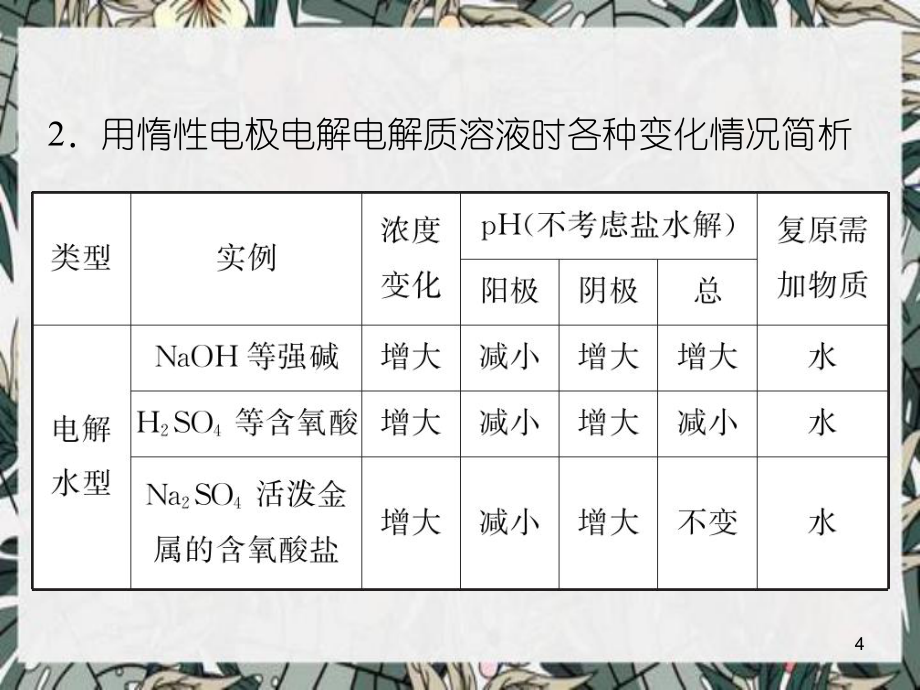
1、高考化学一轮总复习第高考化学一轮总复习第9章章第第30讲电解池课件新人教版讲电解池课件新人教版2考点考点1 电解原理电解原理 1用惰性电极电解时,电解对象、电解产物与离子放电顺序的关系阴离子放电顺序:S2-I-Br-Cl-OH-含氧酸F-阳离子放电顺序:Ag+Fe3+Cu2+H+Fe2+Zn2+H+(水)Al3+Mg2+Na+电解质溶液电解规律与区、区与H+:电解电解质型与区:放氢生碱型与区:放氧生酸型与区、区与H+:电解水型3.2用惰性电极电解电解质溶液时各种变化情况简析4续表5续表63.电极方程式、电解方程式的书写书写电解反应的一般步骤是:以写出用石墨做电极电解CuSO4溶液的电极反应式及
2、总的电解方程式为例。第一步:明确溶液中存在哪些离子溶液中的阳离子:Cu2+、H+,阴离子:OH-、 。第二步:判断阴阳两极附近离子种类及离子放电顺序阴极:Cu2+H+阳极:OH- 第三步:写电极反应式和总的电解方程式阴极:2Cu2+4e-=2Cu阳极:4OH-4e-=2H2O+O2或2H2O-4e-=O2+4H+24SO24SO7使得失电子数相等,两极反应式相加得总方程式:2Cu2+2H2O 2Cu+O2+4H+(离子方程式)或2CuSO4+2H2O 2Cu+O2+2H2SO4。电解电解注意:上述例子中的电极若换成铜棒,阳极电极反应式为:Cu-2e-=Cu2+,阴极电极反应式不变。电极反应式的
3、书写要以实际放电的离子表示,但电解方程式的书写中,弱电解质要以分子式的形式书写。如本例中的阳极反应式可写为OH-,但是电解总反应方程式则必须写为H2O。8例例1 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。研读下图,下列判断不正确的是()AK闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+B当电路中转移0.2 mol 电子时,中消耗的H2SO4为0.2 mol4H+ CK闭合时,中 向c电极迁移DK闭合一段时间后,可单独作为原电池,d电极为正极24SOC24SO9 【解析】 本题考查电化学(原电池、电解池)的相关知识,K闭合时为原电池,为电解池,中
4、发生充电反应,d电极为阳极发生氧化反应,其反应式为PbSO4+2H2O-2e-=PbO2+4H+SO所以A正确。在上述总反应式中,得失电子总数为2e-,当电路中转移0.2 mol电子时,可以计算出中消耗的硫酸的量为0.2 mol,所以B对。K闭合一段时间,也就是充电一段时间后可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,所以D也正确。K闭合时d是阳极,阴离子向阳极移动,所以C错。10考点考点2 电解计算电解计算1简单装置中各电极产物间的计算在一个装置中进行电解时,各电极产物不同,但阴阳极得失电子数相等。根据此标准可对各电极产物、溶液中的产物,以及反应
5、消耗的物质进行计算。2复杂装置中(指多个装置串联连接)各电极产物的判断在串联电解装置中,各电极电子转移数相等。据此,可计算各电极产物,溶液中的c(H+)、c(OH-)的变化。113电解的计算特点有关电解的计算通常是求电解后某产物的质量、气体的体积、某元素的化合价以及溶液的pH、物质的量浓度等。解答此类题的方法有两种:一是根据电解方程式或电极反应式,应用阴、阳两极得失电子守恒进行有关计算。二是用惰性电极进行电解的过程,若电解质的阴、阳离子不同时在两极上放电,则阳离子放电的同时必有H+生成,n(H+)=n(阳离子)电荷数。也可利用物质的量关系(电子得失守恒)进行计算,如,H2Cl21/2O2Cu2
6、Ag2H+2OH-。应用原电池、电解池进行有关化学计算,也常见于高考题中,抓住两电极上通过的电子数目相等,是解答这类题的关键。12 例例2 在500 g CuSO4溶液中插入两根电极。一极为铁,一极为含杂质锌均匀的粗铜,通电一段时间后,切断电源,立即将电极取出,这时铁极上析出7.04 g铜,电解液增重0.02 g。求粗铜中锌的质量分数。 【解析】 解本题的关键有两点:一是正确写出电极反应式。根据活性材料作阴极不参加反应,作阳极时被氧化,可知粗铜为阳极,铁为阴极;二是根据“电解时,通过各串联电极的电子的物质的量相等”建立关系式。13 设参加反应的Cu和Zn的物质的量分别为x mol和y mol。
7、生成的Cu的物质的量140.02mol65g/mol0.02mol65/ mol0.09mol64/ molggZn%=100%=18.4%【答案】 18.4%15 用惰情电极电解电解质溶液时,若使电解后的溶液恢复原状态,应遵循“缺什么加什么,缺多少加多少”原则。一般加入阴极产物与阳极产物的化合物。如电解CuSO4溶液,因从溶液中减少的是Cu和O2,且为2 1,相当于减少了CuO,所以恢复应加CuO。加1 mol Cu(OH)2则多加1 mol H2O,反过来,如果需要加Cu(OH)2才能恢复,说明CuSO4电解质电解完后还电解了水,且CuO和H2O为1 1。 16171.(2011上海卷上海
8、卷)用电解法提取氯化铜废液中的铜,方案正确的是( )A用铜片连接电源的正极,另一电极用铂片B用碳棒连接电源的正极,另一电极用铜片C用氢氧化钠溶液吸收阴极产物D用带火星的木条检验阳极产物 【解析】 用电解法提取氯化铜废液中的铜时,铜必须作阴极,阳极是铜或惰性电极,阴极的反应式为:Cu2+2e- =Cu。B182.(2011全国卷全国卷)用石墨做电极电解CuSO4溶液。通电一段时间后,欲使用电解液恢复到起始状态,应向溶液中加入适量的( ) ACuSO4 BH2O CCuO DCuSO4 5H2OC 【解析】 用石墨做电极电解CuSO4溶液的电解方程式是2CuSO4+2H2O 2H2SO4+2Cu+
9、O2,根据缺什么补什么的,选项C正确。电解193.(2011山东卷山东卷)以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )A未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程B因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系C电镀时保持电流恒定,升高温度不改变电解反应速率D镀锌层破损后对铁制品失去保护作用C20 【解析】 电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极,用含有镀层金属离子的溶液作电镀液。因此在铁制品上镀锌时,铁作阴极,锌作阳极,由于锌比铁活泼,因此未通电前可以构成原电池,但此时锌作负极失去电子,铁作正极,而电镀时锌仍然失电子
10、,所以选项A不正确;在氧化还原反应中必需满足得失电子守恒,因此电镀时通过的电量与锌的析出量有确定关系而与能量变化无关,B不正确;由于电镀时保持电流恒定,因此导线中通过的电子速率是不变的,所以升高温度不能改变电解反应速率,C正确;镀锌层破损后,由于锌比铁活泼,所以即使发生电化学腐蚀也是锌失去电子而保护了铁,即选项D也不正确。214.右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( )A逸出气体的体积a电极的小于b电极的B一电极逸出无味气体,另一电极逸出刺激性气味气体Ca电极附近呈红色,b电极附近出现蓝色Da电极附近呈蓝色,b电
11、极附近出现红色D22 【解析】 电解稀Na2SO4水溶液,其本质是电解水。 b极为阳极:4OH-4e-=2H2O+O2 a极为阴极:4H+4e-=2H2 a极逸出气体为氢气,b极逸出气体为氧气,二者都是无色无味的气体,且a极氢气的体积是b极氧气的体积的2倍,则A、B均错误;a极氢离子得电子,所以a极附近氢氧根离子浓度增大,遇石蕊试液变蓝;b极氢氧根离子放电,致使b极附近氢离子浓度增大,遇石蕊试液变红色,则C错,D正确。235.(2012福建卷)将如图所示实验装置的K闭合,下列判断正确的是( )A24256. 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )A.甲、乙两烧杯中溶液的pH均升高B.当b极增重5.4 g时,d极产生的气体为2.24 L(标准状况)C.当电解一段时间后,将甲、乙两溶液混合,一定会生成沉淀D.乙烧杯中c的电极反应式为2Cl-2e-=Cl2D267.下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:(1)M电极的材料是_,电极名称是_,N的电极反应式为_,加入乙醇的铂电极的电极反应式为_。铁阴极4OH-4e-=2H
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 人力资源管理的年度计划
- 中国劳动合同范例
- 共同购置房产合同标准文本
- 跨文化交流教学工作计划
- ul标准铜牌间距11.7mm
- 企业团租合同标准文本
- 中交材料采购合同标准文本
- 幼儿园小班建设的全面规划计划
- 做商务合同标准文本
- wenhua培训合同范本
- 合作合同模板
- 2025年医保知识考试题库及答案(医保异地就医结算政策调整与历年试题)
- 山东省潍坊市2025届高三下学期一模模拟检测(一)化学试题(含答案)
- 2025高职单招考试(语文)试题(附答案)
- 2025年国网甘肃省电力公司高校毕业生招聘139人(第二批)笔试参考题库附带答案详解
- 流动资金自动测算表(内自带计算公式)
- 人教版六年级道德与法治下册课件 第二单元 爱护地球 共同责任 4 地球——我们的家园
- (完整word版)宿舍建筑平面图
- 《理工英语1》课程导学PPT课件
- 供应商现场审核评分表(详细)
- 第三章政府绩效计划-ppt

评论
0/150
提交评论