



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
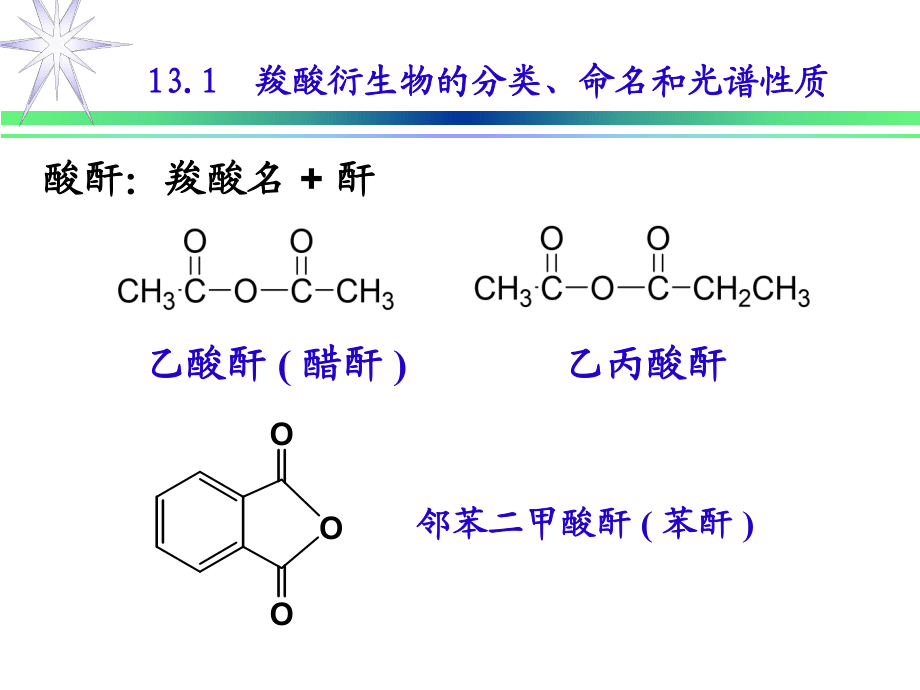
1、有机化学有机化学第十三章第十三章 羧酸衍生物羧酸衍生物 (carboxylic acids derivatives)13.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质 RCOOCRORCOORRCOX酸酐酸酐酯酯酰胺酰胺酰卤酰卤RCONRR一、分类和命名一、分类和命名1. 1. 分类分类CH3COCl酰卤:酰卤:酰基名酰基名+卤素名卤素名 COClCHCH2丙烯酰氯乙酰氯乙酰氯 对甲基苯甲酰氯对甲基苯甲酰氯 2. 2. 命名命名13.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质酸酐:羧酸名酸酐:羧酸名 + 酐酐 OOO乙酸酐乙酸酐
2、 ( 醋酐醋酐 ) 乙丙酸酐乙丙酸酐 邻苯二甲酸酐邻苯二甲酸酐 ( 苯酐苯酐 ) 13.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质HCOOC2H5酯:羧酸名酯:羧酸名 +(醇)烃基名(醇)烃基名 + 酯酯 CH3COOCHCH2COOCH3CCH2CH3有机玻璃单体甲酸乙甲酸乙 酯酯 乙酸乙烯乙酸乙烯 酯酯 -甲基丙烯酸甲酯甲基丙烯酸甲酯 13.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质HCONCH3CH3酰胺:酰胺:酰基酰基+胺胺 (DMF)非质子性极性溶剂ONHO邻苯二甲酰亚胺N, N-二甲基甲酰胺二甲基甲酰胺 N-甲基环
3、戊基甲酰胺甲基环戊基甲酰胺 13.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质1. IR 醛、酮、羧酸、酰卤、酸酐、酯和酰胺都醛、酮、羧酸、酰卤、酸酐、酯和酰胺都含有羰基。在含有羰基。在 IR 中显示出强的羰基特征峰。中显示出强的羰基特征峰。由于所连接基团的影响,羧酸衍生物中羰基吸由于所连接基团的影响,羧酸衍生物中羰基吸收峰的位置有所不同,大致范围如下:收峰的位置有所不同,大致范围如下:二、光谱性质二、光谱性质13.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质COClR1800 cm-1COROCRO18001850 cm-117
4、401790 cm-1ORCRO1750 cm-113.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质R(H)CRO(参照物)(参照物) 16901750cm-1+C I I ; 1690 cm-1(p- 共轭共轭)CONRRR13.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质 除了除了 特殊峰的位置可以用来区别羧酸衍生特殊峰的位置可以用来区别羧酸衍生物以外,还有一些辅助信息。如:酸酐应出现两组物以外,还有一些辅助信息。如:酸酐应出现两组C=O伸缩振动吸收峰,相隔伸缩振动吸收峰,相隔 60 cm-1左右。还有左右。还有CO:1045
5、 1300 cm-1。酯没有。酯没有OH,即此与羧酸区别;在,即此与羧酸区别;在 1050 1300 cm-1 有有CO 伸缩振动,即此与酮区别。酰胺伸缩振动,即此与酮区别。酰胺有有 NH 伸缩振动:伸缩振动: 30503550 cm-1 。 当这四类化合物的羰基与不饱和体系共轭时,吸收当这四类化合物的羰基与不饱和体系共轭时,吸收波数均降低。波数均降低。CO13.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质2. 1HNMRCH3CHHOH,B A C :3.34;那么,那么,CH2CORH:2.22.4CH2COOCH2CH3HABCCH3CO 2 3 ppm
6、OCH2- 4 4.5 ppm 13.113.1 羧酸衍生物的分类、命名和光谱性质羧酸衍生物的分类、命名和光谱性质一、物理性质一、物理性质 1、酰氯、酰氯有刺激性气味;有刺激性气味; b. 遇水强烈水解;遇水强烈水解; c. 沸点比相应的羧酸低。沸点比相应的羧酸低。 2. 酸酐酸酐 沸点比相应的羧酸高。沸点比相应的羧酸高。13.2 酰卤和酸酐酰卤和酸酐 二、化学性质二、化学性质 1. 水解反应水解反应 a. 活性:酰氯活性:酰氯 酸酐酸酐 b. 历程历程 (见下一页见下一页) c. 反应一般均要无水操作反应一般均要无水操作 13.2 酰卤和酸酐酰卤和酸酐历程:历程:COClCOOHHRR+OH
7、HCOHHROClClH+COOHR13.2 酰卤和酸酐酰卤和酸酐2. 醇解醇解3. 氨解氨解 13.2 酰卤和酸酐酰卤和酸酐4. 与格氏试剂的反应与格氏试剂的反应a. 酰氯和格氏试剂反应可以得到酮或三级醇b. 该反应如果控制格氏试剂的量可以停留在酮的阶段 13.2 酰卤和酸酐酰卤和酸酐13.2 酰卤和酸酐酰卤和酸酐思考题:思考题:完成下列反应完成下列反应一、酯的物理性质一、酯的物理性质 1. 沸点比相应的醇低;沸点比相应的醇低;2. 在水中的溶解度较小;在水中的溶解度较小;3. 有芳香气味。有芳香气味。 13.3 羧酸酯羧酸酯 二、酯的化学性质二、酯的化学性质1. 酯的水解、醇解和氨解酯的水
8、解、醇解和氨解 水解水解:a. 水解有酸性水解和碱性水解水解有酸性水解和碱性水解b. 碱性水解又称为皂化反应碱性水解又称为皂化反应c. 逆反应称为酯化反应逆反应称为酯化反应13.3 羧酸酯羧酸酯醇解:醇解:a. 酯的醇解反应又称酯交换反应酯的醇解反应又称酯交换反应;b. 一般用高沸点的醇来置换低沸点的醇一般用高沸点的醇来置换低沸点的醇; c. 实例实例: 13.3 羧酸酯羧酸酯对苯二甲酸二甲酯对苯二甲酸二甲酯 对苯二甲酸二乙二醇酯对苯二甲酸二乙二醇酯 氨解:氨解:13.3 羧酸酯羧酸酯羟肟酸的显色反应:羟肟酸的显色反应:定性鉴定酯定性鉴定酯。(酰卤、酸酐也呈正反应)(酰卤、酸酐也呈正反应)RC
9、OC2H5 + NH2OH HClORCNHOH + C2H5OHO.红色络合物酰胲铁书上p41(结构有误)13.3 羧酸酯羧酸酯2. 酯与格氏试剂的反应酯与格氏试剂的反应 a. 该反应该反应不可能停留在酮阶段不可能停留在酮阶段,因为酮的,因为酮的活性大于酯;活性大于酯; b. 应用:合成三级醇应用:合成三级醇13.3 羧酸酯羧酸酯实例:实例:13.3 羧酸酯羧酸酯3.还原还原 酯的还原比羧酸容易发生。酯的还原比羧酸容易发生。a. 催化加氢:催化加氢: 250,20 33 Mpa 下,用下,用 CuO-Cr2O3 作作催化剂,转化率高。双键同时被还原。催化剂,转化率高。双键同时被还原。RCOO
10、R + H2 RCH2OH + ROHCuO-Cr2O313.3 羧酸酯羧酸酯b. 负氢还原剂:负氢还原剂: LiAlH4的使用大大改进了实验条件,产量的使用大大改进了实验条件,产量也提高了,且对双键无影响。也提高了,且对双键无影响。 注意:不能用注意:不能用 NaBH4 还原酯还原酯LiAlH4COOC2H5CH2OHTHF13.3 羧酸酯羧酸酯c. 金属钠和醇(质子溶剂):金属钠和醇(质子溶剂):酯酯 醇醇 金属和供质子溶剂的还原体系,双键也金属和供质子溶剂的还原体系,双键也不受影响,以单分子还原方式进行。不受影响,以单分子还原方式进行。COOC2H5NaC2H5OHC11H23C11H2
11、3CH2OH13.3 羧酸酯羧酸酯历程:历程:13.3 羧酸酯羧酸酯 分析:首先金属给出电子,形成自由基负离子分析:首先金属给出电子,形成自由基负离子() ,再从钠得到一个电子生成双负离子,再从钠得到一个电子生成双负离子(),然,然后与醇反应生成后与醇反应生成(),()消除醇钠成为醛。再重消除醇钠成为醛。再重复复(1) (2) (3)步得醇钠,经酸化得醇。这种还原反应步得醇钠,经酸化得醇。这种还原反应从酯到醇,那么必定从酯到醇,那么必定酯是天然产物或价廉产品,而酯是天然产物或价廉产品,而醇是很稀贵的醇是很稀贵的。13.3 羧酸酯羧酸酯d. 金属和非质子溶剂:金属和非质子溶剂: 酯酯 酮醇(酮醇
12、(-羟基酮)羟基酮)COOC2H5Na苯/二甲苯C3H7COCHC3H7OHC3H713.3 羧酸酯羧酸酯COOC2H5NaC3H7COOC2H5C3H7酸化COOC2H5C3H7COC2H5C3H7OCC3H7CC3H7OOCC3H7CC3H7OOCC3H7CC3H7OOHH13.3 羧酸酯羧酸酯这是用二元酯合成大环化合物的好方法。这是用二元酯合成大环化合物的好方法。 Na1,4加成二甲苯HAc麝香酮(六神丸的主要成分)(CH2)13COOC2H5COOC2H5(CH2)13CCHOHO(CH3)2CuLi, 不饱和酮(CH2)12CCHCHO(CH2)12CCHCH2OCH313.3 羧酸
13、酯羧酸酯4.酯缩合酯缩合 我们在介绍酮时,知道我们在介绍酮时,知道 酯的酯的-H也被酯基活化,但比酮中也被酯基活化,但比酮中-H的活性略差。的活性略差。酯也可以发生缩合,叫酯也可以发生缩合,叫克莱森缩合克莱森缩合(Claisen)。)。CH3CCH2OH (pKa=20),13.3 羧酸酯羧酸酯通式:通式:实例:实例:乙酰乙酸乙酯乙酰乙酸乙酯13.3 羧酸酯羧酸酯历程历程 : :EtONaNaHOAcCH3CpKa=24OOEtCH2COOEtCH3COOEt亲核加成CH2COOEtCCH3OOEtNa消除CH2COOEtCH3COpKa=11CHCOOEtCH3CONa+CH3CCH2COO
14、EtO乙酰乙酸乙酯(羰基酯)13.3 羧酸酯羧酸酯 如果如果-C 上只有一个氢原子,由于烃基的供电子上只有一个氢原子,由于烃基的供电子诱导效应,酸性减弱,形成碳负离子就比较困难,需诱导效应,酸性减弱,形成碳负离子就比较困难,需要用比乙醇钠更强的碱,如要用比乙醇钠更强的碱,如NaH、PhLi、Ph3CNa(三苯甲基钠)等。例:(三苯甲基钠)等。例:NaHHOAcCHCOOEtCH3CH3CHCOCCH3CH3CH3CH3COOEt13.3 羧酸酯羧酸酯交叉交叉(混合混合)的克莱森酯缩合:的克莱森酯缩合: 如果将两个不同的酯发生酯缩合,一般将有四如果将两个不同的酯发生酯缩合,一般将有四种产物,反应
15、无实际意义。所以要用到交种产物,反应无实际意义。所以要用到交叉叉酯缩合,酯缩合,必定是一个必定是一个有有-H 的酯的酯和另一个和另一个无无 -H 的酯的酯。13.3 羧酸酯羧酸酯无无 -H 的酯有:的酯有:HCOOEtPhCOOEtCOOEtCOOEtCOOEtOEt甲酸酯甲酸酯碳酸酯碳酸酯草酸酯草酸酯苯甲酸酯苯甲酸酯13.3 羧酸酯羧酸酯例:例:13.3 羧酸酯羧酸酯13.3 羧酸酯羧酸酯 由于酮的由于酮的 -H 活性比酯的活性比酯的 -H 活性高,所以酮活性高,所以酮与酯缩合得到与酯缩合得到 -羰基酮羰基酮 。例:例:PhCCH3 + PhCOOOEtPhCCH2OCOPh二酮酮酯缩合:酮
16、酯缩合:13.3 羧酸酯羧酸酯应用应用:合成:合成1,3-二羰基化合物的方法二羰基化合物的方法 例题例题:写出下列反应的历程:写出下列反应的历程 13.3 羧酸酯羧酸酯狄克曼酯缩合反应狄克曼酯缩合反应 定义定义:分子内的克莱森酯缩合反应:分子内的克莱森酯缩合反应 比较:比较:13.3 羧酸酯羧酸酯 这种分子内酯缩合,仅限于合成稳定的五元、六这种分子内酯缩合,仅限于合成稳定的五元、六元环,称为元环,称为狄克曼狄克曼(Dieclemann)反应反应。 酯缩合是可逆过程。酯缩合是可逆过程。例:解释例:解释EtOOCOOEtOCOOEt13.3 羧酸酯羧酸酯EtOC2H5OHNaOEtOCOOEtOC
17、OOEtOEtOCOOEtOEtOCOOEtOEtOCOOEtOEtOCOOEtOEtOCOOEt解答解答13.3 羧酸酯羧酸酯13.3 羧酸酯羧酸酯思考题:思考题:酮酸酯可以进行分子内环化(酮酸酯可以进行分子内环化(Dieckman反反应),写出下列反应的产物(请考虑产物分子环的应),写出下列反应的产物(请考虑产物分子环的大小):大小):三、个别化合物三、个别化合物 在此仅介绍不常见的原酸酯。在此仅介绍不常见的原酸酯。酸可以看作是三元醇脱水而成:酸可以看作是三元醇脱水而成:H2OCROHOHOHRCOHO三元醇因而得名三元醇因而得名原酸原酸,但实际并不存在。,但实际并不存在。13.3 羧酸酯
18、羧酸酯而而 则相当稳定,称为原酸酯。它用于缩酮则相当稳定,称为原酸酯。它用于缩酮的制备,可以得到很好的结果,即保护羰基。的制备,可以得到很好的结果,即保护羰基。例:例:CROROROR原甲酸三乙酯CCH3OEtOEtCH3CO + HC(OEt)3CH3CH3 + HCOOEt13.3 羧酸酯羧酸酯一、油脂一、油脂 习惯上,把室温下呈习惯上,把室温下呈固态固态的叫的叫脂脂,呈,呈液态液态的叫的叫油油。油脂是高级脂肪酸甘油酯的通称。油脂是高级脂肪酸甘油酯的通称。 软脂酸软脂酸 CH3(CH2)14COOH 硬脂酸硬脂酸 CH3(CH2)16COOH 油酸油酸 CH3(CH2)7CH=CH(CH2
19、)7COOH高级脂肪酸:高级脂肪酸: 13.4 油脂和合成洗涤剂油脂和合成洗涤剂性质:性质:1. 水解水解 油脂在碱性条件下水解成高级脂肪酸钠的油脂在碱性条件下水解成高级脂肪酸钠的过程称为皂化反应。过程称为皂化反应。 13.4 油脂和合成洗涤剂油脂和合成洗涤剂2. 加成反应加成反应 a. 加氢加氢 b. 加碘:加碘:100 g 油脂所能吸收的碘的克数称为油脂所能吸收的碘的克数称为碘值碘值。 特征:碘值越大,油脂的不饱和度越高。特征:碘值越大,油脂的不饱和度越高。 13.4 油脂和合成洗涤剂油脂和合成洗涤剂二、肥皂和合成洗涤剂二、肥皂和合成洗涤剂 油脂经皂化得高级脂肪酸钠(或钾)盐,即为肥油脂经
20、皂化得高级脂肪酸钠(或钾)盐,即为肥皂得主要成分。高级脂肪酸分子中得憎水部分(烃皂得主要成分。高级脂肪酸分子中得憎水部分(烃基)进入油污内,亲水部分(羰基)伸在油滴外得基)进入油污内,亲水部分(羰基)伸在油滴外得水中,形成稳定的乳浊液。揉、搓等外力促使油污水中,形成稳定的乳浊液。揉、搓等外力促使油污与附着物分离,随水漂洗而去。但肥皂的需求量越与附着物分离,随水漂洗而去。但肥皂的需求量越来越大,又不适用于硬水和酸性水质,所以合成洗来越大,又不适用于硬水和酸性水质,所以合成洗涤剂就应运而生了。涤剂就应运而生了。13.4 油脂和合成洗涤剂油脂和合成洗涤剂一般一般肥皂肥皂含有含有70%高级脂肪酸钠高级
21、脂肪酸钠30%水分水分少量松香酸钠(增加泡沫)少量松香酸钠(增加泡沫) 油脂油脂在在碱性碱性条件下条件下水解水解(皂化皂化)所产生的)所产生的高级脂肪酸高级脂肪酸盐盐称为称为肥皂肥皂(可以为(可以为钠、钾肥皂钠、钾肥皂)1. 肥皂肥皂2. 肥皂的去污原理肥皂的去污原理高级脂肪酸高级脂肪酸分子结构分分子结构分两部分两部分非极性长链烃基非极性长链烃基 不溶于水叫不溶于水叫疏水基疏水基羧基羧基 溶于水叫溶于水叫亲水基团亲水基团或或憎水基团憎水基团13.4 油脂和合成洗涤剂油脂和合成洗涤剂CO Na-+O=亲水基亲水基疏水基疏水基(非极性)(非极性)(极性)(极性)C-O O=C-O O=水水 当肥皂
22、在水表面时,是亲水基进入当肥皂在水表面时,是亲水基进入水中,憎水基排除在水表面外,这样脂水中,憎水基排除在水表面外,这样脂肪酸钠削弱了水表面上水分子与水分子肪酸钠削弱了水表面上水分子与水分子之间的引力,降低了水的表面张力。之间的引力,降低了水的表面张力。 在水中,脂肪酸钠憎水烃基依靠在水中,脂肪酸钠憎水烃基依靠相互间的范德华引力聚集在一起,而相互间的范德华引力聚集在一起,而亲水基团则包在外面与水相连形成一亲水基团则包在外面与水相连形成一粒一粒很小的胶束,分散在水中。如粒一粒很小的胶束,分散在水中。如果遇到油污,肥皂的憎水部分就进入果遇到油污,肥皂的憎水部分就进入油滴内,而亲水部分就伸在油滴外面
23、油滴内,而亲水部分就伸在油滴外面的水中形成稳定的乳油液。的水中形成稳定的乳油液。油油C-O O=C-O O=CC=OOOO-3. 合成洗涤剂合成洗涤剂通过通过合成的方法合成的方法合成了一系列与合成了一系列与肥皂肥皂分子相似结构的分子相似结构的洗涤剂洗涤剂。合成洗涤剂合成洗涤剂种类很多,按种类很多,按分子结构分子结构特点特点可分为可分为三种类型三种类型:与与阴离子型阴离子型洗涤剂洗涤剂相反,溶于相反,溶于水水时,其时,其有效部分有效部分是是阳离子阳离子。 阳离子型洗涤剂阳离子型洗涤剂 阴离子型洗涤剂阴离子型洗涤剂目前用的最多的一种,目前用的最多的一种,肥皂肥皂就属这一类就属这一类 RCOO-合成
24、洗涤剂合成洗涤剂如:如:烷基硫酸酯的钠盐:烷基硫酸酯的钠盐: R-SO3 Na-+ 十二烷基苯磺酸钠:十二烷基苯磺酸钠:-SO3 NaC12H25-+ 它们多数为它们多数为季铵盐季铵盐,也有一些含,也有一些含 S 或或 P 的化合物。的化合物。 它们都是具有它们都是具有杀灭细菌杀灭细菌和和霉菌霉菌的能力,主要用于外科的能力,主要用于外科手术手术时时皮肤皮肤及及器械器械消毒消毒。 非离子型洗涤剂非离子型洗涤剂 这类型这类型洗涤剂洗涤剂在在水水溶液中溶液中不离解不离解,是,是中性分子中性分子,起活性,起活性作用的是整个分子,其作用的是整个分子,其亲水部分亲水部分是含有是含有羟基羟基及多个及多个醚键
25、醚键。 这类化合物是这类化合物是粘稠液体粘稠液体,与,与水极易混溶水极易混溶,洗涤效果很好,洗涤效果很好,是目前家用是目前家用液体洗涤剂液体洗涤剂的的主要成分主要成分。(P50)-(OCH2CH2)n-OHC8H17-n = 612亲水部分亲水部分憎水部分憎水部分如:如:-+-CH2-N-C12H25 BrCH3CH3溴化十二烷基苄基铵(也叫新洁灭)溴化十二烷基苄基铵(也叫新洁灭)乙酰乙酸乙酯乙酰乙酸乙酯丙二酸二乙酯丙二酸二乙酯13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用一、乙酰乙酸乙酯一、乙酰乙酸乙酯1. 互变异构现象互变异构现
26、象 人们在研究乙酰乙酸乙酯时,发现它除了人们在研究乙酰乙酸乙酯时,发现它除了有羰基的典型反应外,还有一些特别的性质,有羰基的典型反应外,还有一些特别的性质,如:如:(1)可与)可与Na反应,产生反应,产生H2;(;(活泼活泼H)(2)可使)可使Br2/CCl4褪色;(有褪色;(有C=C不饱和键)不饱和键)(3)可与)可与FeCl3反应呈紫色。(有烯醇式)反应呈紫色。(有烯醇式)13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用所以,证明有酮式和烯醇式的互变。所以,证明有酮式和烯醇式的互变。 在低温(在低温(78)时,可以得到单一存在形式
27、的)时,可以得到单一存在形式的结晶形化合物(酮式),但温度稍高,由于互变异结晶形化合物(酮式),但温度稍高,由于互变异构速度加快,就得不到纯的酮式或烯醇式了。构速度加快,就得不到纯的酮式或烯醇式了。CH3CCH2COC2H5OO室温CH3COHCHCOC2H5O13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用 互变异构现象互变异构现象:是指两种异构体之间发生一种可逆异:是指两种异构体之间发生一种可逆异构化作用,通常伴有氢原子及双键位置的转移。构化作用,通常伴有氢原子及双键位置的转移。 例如,乙酰丙酮,由于氢原子的转移,存在着酮例如,乙
28、酰丙酮,由于氢原子的转移,存在着酮式和烯醇式的互变:式和烯醇式的互变: 酮式酮式 烯醇式烯醇式OH3CHOCH3HOOHH3CCH313.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯、乙酰丙酮能形成稳定烯醇式的原因:乙酰乙酸乙酯、乙酰丙酮能形成稳定烯醇式的原因: 1) 由于两个羰基的存在,使得亚甲基上的氢原子由于两个羰基的存在,使得亚甲基上的氢原子特别活泼;特别活泼; 2) 形成的烯醇式可以通过分子内氢键,形成一个形成的烯醇式可以通过分子内氢键,形成一个比较稳定的六元闭环体系,使体系能量降低。比较稳定的六元闭环体系,使体系能
29、量降低。13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用名称结构烯醇式含量 (%)丙酮2.4 10 - 4环己酮2.0 10 - 2乙酰乙酸乙酯7.5苯甲酰乙酸乙酯21乙酰丙酮80苯甲酰丙酮99PhCOCH2COCH3CH3COCH2COCH3结构对烯醇式含量的影响结构对烯醇式含量的影响PhCOCH2CO2C2H5CH3COCH2CO2C2H5OCH3COCH3结论:结论: 1) 一元酮的烯醇含量很低。一元酮的烯醇含量很低。 2) 1,3-二羰基化合物的烯醇含量比较高,而且二羰基化合物的烯醇含量比较高,而且 1,3-二酮的烯醇含量二酮
30、的烯醇含量要高于要高于-酮酯;苯环的存在可以增加烯醇式的含量酮酯;苯环的存在可以增加烯醇式的含量(由于苯环的共轭作用稳定由于苯环的共轭作用稳定烯醇式烯醇式)。 3) 在酮式和烯醇式中,有时可能烯醇式含量高在酮式和烯醇式中,有时可能烯醇式含量高 (以烯醇式为主以烯醇式为主)。 思考题:思考题:1. 下列化合物哪一个可以和下列化合物哪一个可以和 FeCl3 显色?显色? ( ) OOABOOCO2C2H5OCOOHCO2C2H5OH13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用C13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上
31、的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用2. 将下列化合物按照烯醇式含量由高到低的顺序排将下列化合物按照烯醇式含量由高到低的顺序排列:列: A D B C E2. 乙酰乙酸乙酯的制备乙酰乙酸乙酯的制备 乙酰乙酸乙酯在实验室一般采用乙酸乙酯的乙酰乙酸乙酯在实验室一般采用乙酸乙酯的Claisen缩合反应来制备:缩合反应来制备:13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用3. 乙酰乙酸乙酯中活泼亚甲基的取代反应乙酰乙酸乙酯中活泼亚甲基的取代反应13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸
32、二乙酯在有机合成上的应用4. 乙酰乙酸乙酯的酮式和酸式分解反应乙酰乙酸乙酯的酮式和酸式分解反应a. 酮式分解过程酮式分解过程 13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用b. 酸式分解过程酸式分解过程 13.5 13.5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用5、乙酰乙酸乙酯在有机合成上的应用、乙酰乙酸乙酯在有机合成上的应用 a. 合成取代丙酮合成取代丙酮例例1. 从从 C2 有机试剂合成有机试剂合成分析:分析: CH3COCHR2R1CH3COCH2CH2CH3合成:合成: 规律
33、:规律:当需要上两个不同烷基时,一般先上体积当需要上两个不同烷基时,一般先上体积大的,再上体积小的。大的,再上体积小的。 例例2. 合成合成: CH3COCHCH2CH2CH2CH3CH CH3CH3合成:合成:CH3CCH2COOEtO1) EtONa2)CH3CHCH3CH2BrCH3CCHCOOEtOCH2CH(CH3)21) EtONa2) CH3CH2CH2BrCH3CCCOOEtOCH2CH(CH3)2CH2CH2CH3NaOH, H2OH3O+- CO2CH3CCHOCH2CH(CH3)2CH2CH2CH3 b. 合成取代乙酸合成取代乙酸 例例3. 合成合成 分析:分析: CHR
34、1R2COOHCH3CH2CHCH3COOH合成:合成: c. 合成合成 1,4-二酮二酮 若用若用 -卤代酮代替卤代烃,反应后经酮式分解反应可卤代酮代替卤代烃,反应后经酮式分解反应可以制得以制得 1,4-二酮。二酮。 例例4. 合成合成 分析:分析: CH3CCH2OCH2CROCH3CCH2OCH2CPhOCH3CCH2OCH2CPhOCH3CCHOCH2CPhOCOOEtCH3COCH2COOEtPhCOCH2Br+ 合成:合成: d. 合成合成 1,3-二酮二酮 若用酰氯代替卤代烃,反应后经酮式分解,可若用酰氯代替卤代烃,反应后经酮式分解,可以制得以制得 1,3-二酮:二酮: 例例4.
35、 合成合成 分析:分析:CH3CCH2OCROCH3CCH2OCOPhCH3CCH2OCCH3CCHOCCOOEtCH3COCH2COOEtPhCOCl+PhOPhO 合成:合成: e. 合成环状结构的酮合成环状结构的酮 例例5. 如何合成环丙基甲基酮:如何合成环丙基甲基酮: 分析:分析: CH3CCHOCH3CO合成:合成:1. 制备制备 丙二酸二乙酯丙二酸二乙酯通常由通常由氯乙酸氯乙酸合成合成Cl-CH2-COOH + NaCN NC-CH2COONa C2H5OHH2SO4CH2COOC2H5COOC2H5二、丙二酸二乙酯的应用二、丙二酸二乙酯的应用2. 应用应用 与与乙酰乙酸乙酯乙酰乙
36、酸乙酯类似,类似,丙二酸酯丙二酸酯分子中分子中亚甲基亚甲基上上氢氢是是活泼活泼的,可与的,可与醇钠醇钠反应,生成反应,生成丙二酸酯丙二酸酯的的钠盐钠盐。它可以作为它可以作为亲核试剂亲核试剂与与卤代烷卤代烷、二卤代烷二卤代烷、酰卤酰卤、卤卤代酸酯代酸酯等反应而导入等反应而导入烷基等基团烷基等基团,再经过,再经过水解脱羧水解脱羧,得到相应的得到相应的一元羧酸一元羧酸、二元羧酸二元羧酸等化合物。等化合物。合成一元羧酸合成一元羧酸R-CH(COOC2H5)2CH2(COOC2H5)2C2H5ONa-CH(COOC2H5)2 Na+R-X-CO2R-CH2COOH H+ OH / H2O-R-CHCOO
37、HCOOHR-C(COOC2H5)2 Na-+C2H5ONaR/-XR-C(COOC2H5)2R/ H+ OH / H2O-R-CCOOHCOOHR/-CO2R-CH-COOHR/合成二元羧酸合成二元羧酸CH2(COOC2H5)2C2H5ONaCH(COOC2H5)2 Na-+X(CH2)n-COOC2H5CH(COOC2H5)2(CH2)n-COOC2H5 H+ OH / H2O-CH(CH2)n-COOHCOOHCOOH-CO2CH2-COOH(CH2)n-COOH 当当2mol 丙二酸二乙酯丙二酸二乙酯用用2mol 醇钠醇钠处理,可以得到双处理,可以得到双钠盐,再与钠盐,再与1mol 双
38、卤代烷双卤代烷反应可制备反应可制备二元羧酸二元羧酸。2 CH2(COOC2H5)22C2H5ONa2 CH(COOC2H5)2 Na-+Br-CH2-CH2-Br(C2H5OOC)2CH-CH2-CH2-CH(COOC2H5)2 H+ OH / H2O-CO2HOOC-CH2-CH2-CH2-CH2-COOH 合成脂环羧酸合成脂环羧酸 CH2(COOC2H5)2C2H5ONa CH(COOC2H5)2 Na-+Br-CH2CH2CH2-BrCH(COOC2H5)2CH2CH2CH2-BrC2H5ONaC(COOC2H5)2CH2CH2CH2-Br-+NaC(COOC2H5)2CH2CH2CH2
39、 H+ OH / H2O-CCH2CH2CH2COOHCOOH-CO2CH-COOHCH2CH2CH2 一、制备一、制备(1)羧酸的铵盐加热失水;)羧酸的铵盐加热失水;(2)酰卤、酸酐、酯的氨解;)酰卤、酸酐、酯的氨解;主要方法主要方法(3)腈控制水解。)腈控制水解。13.6 酰胺酰胺二、物理性质二、物理性质 1. 液体的酰胺是良好的有机溶剂液体的酰胺是良好的有机溶剂, 例如:例如: DMF2. 沸点比相应的羧酸还要高,如酰胺中的氢被沸点比相应的羧酸还要高,如酰胺中的氢被取代取代, 沸点会逐渐降低。沸点会逐渐降低。 三、化学性质三、化学性质当生成酰亚胺后,具有弱酸性,可与强碱的水溶液生成盐。当
40、生成酰亚胺后,具有弱酸性,可与强碱的水溶液生成盐。1、酰、酰 胺的酸碱性胺的酸碱性 因因p-共轭,显弱酸性和弱碱性。共轭,显弱酸性和弱碱性。NH OO+ Br2 + NaOH0oCN OOBr + NaBr + H2ONH + NaOHOON-Na+ + H2OOO 酰胺是氨的衍生物,氨是碱性物质。酰胺由于酰胺是氨的衍生物,氨是碱性物质。酰胺由于 N 上未共用电子对与上未共用电子对与 C=O 形成形成 p 共轭,而使共轭,而使 N 上电子云密度降低,因而减弱了接受质子的能力,上电子云密度降低,因而减弱了接受质子的能力,即碱性很弱。同时与即碱性很弱。同时与 N 连接的氢原子也变得稍为活连接的氢原
41、子也变得稍为活泼。酰胺基本上可以认为是中性化合物。泼。酰胺基本上可以认为是中性化合物。2.水解水解 酰胺水解时,酸、碱催化。而且,酰胺水解时,酸、碱催化。而且, 电子沿电子沿OCN 键离域,羰基亲电性明显减弱,亲核试剂的进攻键离域,羰基亲电性明显减弱,亲核试剂的进攻是四种衍生物中最难的。是四种衍生物中最难的。NH2不是好的离去基团,不是好的离去基团,H2O又是惰性试剂,所以也增加了水解的难度。又是惰性试剂,所以也增加了水解的难度。 酰酰胺水解时需要酸或碱催化和比较长时间的加热回流。胺水解时需要酸或碱催化和比较长时间的加热回流。3、脱水反应、脱水反应RCONH2+P2O5RCN+3HPO3RCO
42、NH2RCNRCOOHRCOONH4NH3HCl-H2O-H2O+H2O+H2O4、还原、还原不容易还原,酰胺和腈还原成胺不容易还原,酰胺和腈还原成胺CN(CH3)2OLiAlH4 H2OCH2N(CH3)2CH2CNLiAlH4 H2OCH2CH2NH25.霍夫曼霍夫曼(Hofmann)降解反应降解反应 无取代酰胺无取代酰胺RCONH2与次氯酸钠或次溴与次氯酸钠或次溴酸的碱溶液作用时,脱去羰基生成胺。酸的碱溶液作用时,脱去羰基生成胺。RCNH2ONaOH + Br2RNH2(CH3)3CCH2CONH2Br2NaOH(CH3)3CCH2NH2机理:机理:思考题:思考题:1. 完成反应:完成反
43、应:2. 写出下列反应机理:写出下列反应机理: 第七节第七节 羧酸衍生物的水解、氨羧酸衍生物的水解、氨解和醇解历程解和醇解历程 羧酸衍生物包括酰卤、酸酐、酯和酰胺。羧酸衍生物包括酰卤、酸酐、酯和酰胺。其中,酯的水解研究得最多。以酯得水解为其中,酯的水解研究得最多。以酯得水解为例,有酸催化或碱催化历程;有酰氧和烷氧例,有酸催化或碱催化历程;有酰氧和烷氧断裂之分;有单分子和双分子反应的形式。断裂之分;有单分子和双分子反应的形式。所以酯的水解共有所以酯的水解共有8种历程。最重要和常见的种历程。最重要和常见的是是3种,种, BAc2 ,AAc2,AAL1。 一、一、BAc2历程历程(碱催化下酰氧断裂双
44、分子反应)(碱催化下酰氧断裂双分子反应) 经许多实验证明,经许多实验证明, RCOOROH-,而且,而且是酰氧断裂。但是从理论上说,酰氧断裂可能按是酰氧断裂。但是从理论上说,酰氧断裂可能按 SN2历程经过渡态完成;也可能按加成消除。为历程经过渡态完成;也可能按加成消除。为了判断这一反应的过程,用同位素跟踪的方法进行了判断这一反应的过程,用同位素跟踪的方法进行试验,结果证实:试验,结果证实:先加成后消除先加成后消除。 BAc2历程应表述为:历程应表述为: BAC2历程(碱催化,酰氧键断裂,双分子历程)历程(碱催化,酰氧键断裂,双分子历程)RCORO+ OH-RCORO-OHRCOHO+ -ORR
45、COO- + ROH 应该注意到:反应的最后一步是应该注意到:反应的最后一步是不可逆不可逆 的的,因为生成的,因为生成的 RCOO 有较强的有较强的 p- 共轭共轭效应,是较烷氧基离子要弱得多的碱,不可效应,是较烷氧基离子要弱得多的碱,不可能攫取醇中的氢质子,从而使整个反应变为能攫取醇中的氢质子,从而使整个反应变为不可逆。碱性水解可进行到底,得羧酸盐。不可逆。碱性水解可进行到底,得羧酸盐。 在比较酯碱性水解的速率时,在比较酯碱性水解的速率时, 酯酯中中R、R越小,水解越容易;越小,水解越容易; 位阻小位阻小 容易容易形成加成产物一个四面体。形成加成产物一个四面体。 羰基电正性越大,越容易发生亲
46、核反应。羰基电正性越大,越容易发生亲核反应。 例如例如:下列酯在碱性作用下水解速度最快的是:下列酯在碱性作用下水解速度最快的是 二、二、 AAc2历程历程 (酸催化酰氧断裂双分子历程)(酸催化酰氧断裂双分子历程)这是酸催化酯化反应得逆过程。这是酸催化酯化反应得逆过程。三、三、 AAL1历程历程(酸催化,烷氧断裂,单分子历程)(酸催化,烷氧断裂,单分子历程) 第三丁酯容易生成碳正离子,所以按第三丁酯容易生成碳正离子,所以按AAL1历程进行水解。历程进行水解。四、羧酸衍生物水解、氨解、醇解四、羧酸衍生物水解、氨解、醇解 从反应结果看,羰基碳相连接的基团被取代,从反应结果看,羰基碳相连接的基团被取代
47、,实际上是一个实际上是一个加成消除过程加成消除过程。 羧酸衍生物的水解反应活性:羧酸衍生物的水解反应活性: 碳酸可看作羟基甲酸,若一个碳酸可看作羟基甲酸,若一个OH被被Cl、OR、NH2所取代,则分别得到碳酰氯、碳酸酯、所取代,则分别得到碳酰氯、碳酸酯、碳酰胺。碳酰胺。 COClCl H2N CONH2 H2NCSNH2 H2NCNHNH2 碳酰氯碳酰氯(光气光气) 碳酰胺碳酰胺(脲脲) 硫代碳酰胺硫代碳酰胺(硫脲硫脲) 亚氨基脲亚氨基脲(胍胍) 13.8 碳酸衍生物碳酸衍生物 一一. . 碳酰氯(光气)碳酰氯(光气)CO+Cl2200oCCClOClOCClCl+H2OCO2+HClOCCl
48、Cl+2HCl2NH3OCNH2NH2+水解水解氨解氨解HCl+COCl2+C2H5OHClCOC2H5OCOCl2+2C2H5OHC2H5OCOC2H5O醇解反应醇解反应 固体光气固体光气,又名,又名三光气三光气,化学名称叫二,化学名称叫二(三氯甲三氯甲基基)碳酸酯,英文名称为碳酸酯,英文名称为Bis(trichloromethyl) carbonate,简称,简称BTC。固体光气分子式为。固体光气分子式为C3Cl6O3,分子量分子量296.75。 固体光气为白色结晶固体,有类似固体光气为白色结晶固体,有类似光气的气味,熔点光气的气味,熔点78-81,沸点,沸点203-206(部分分部分分解
49、解);不溶于水,易溶于氯苯、甲苯、二氯甲烷、氯;不溶于水,易溶于氯苯、甲苯、二氯甲烷、氯仿等有机溶剂。结构式:仿等有机溶剂。结构式: 固体光气在制药行业用量最大,可用于合成解固体光气在制药行业用量最大,可用于合成解热镇痛药屈恶昔康,抗忧郁剂和镇痛药卡马西平,热镇痛药屈恶昔康,抗忧郁剂和镇痛药卡马西平,抗癫痫药酰胺咪嗪,抗生素头孢哌酮,氧哌嗪青霉抗癫痫药酰胺咪嗪,抗生素头孢哌酮,氧哌嗪青霉素以及新降压药喹唑啉酮等;其次用在农药和颜料素以及新降压药喹唑啉酮等;其次用在农药和颜料、感光材料,如合成高效除草剂恶草剂恶草酮、永、感光材料,如合成高效除草剂恶草剂恶草酮、永固黄固黄HLR等。等。 二、碳酸的
50、酰胺二、碳酸的酰胺1、尿素、尿素制法制法NH3CO2+NH3OCOHNH2OCONH4NH2OCNH2NH2-H2O化学性质化学性质(1)水解)水解 酸或碱的影响下,加热发生水解,尿素酶存在下水解酸或碱的影响下,加热发生水解,尿素酶存在下水解H2NCNH2 + H2NOCONH2H2NCONHCONH2 + NH3缩二脲H2NCONH2 + H2OH+ or OH-尿素酶NH3 + CO2NH3 + CO2(2)放氮反应)放氮反应OCNH2NH2+3NaOBrCO2+N2+2H2O+3NaBr与霍夫曼反应相似与霍夫曼反应相似;OCNH2NH2+CO2+2N2+3H2O2HONO(3)双缩脲反应
51、双缩脲反应一、合成的目的和要求一、合成的目的和要求 所谓所谓有机合成有机合成就是从就是从简单易得简单易得的的原料原料,通过,通过一步一步或或多步多步化学反应化学反应制备出比较复杂的制备出比较复杂的目标分子目标分子的过程。它也的过程。它也包括将包括将复杂的物质复杂的物质变为变为简单物质简单物质的过程。的过程。1. 合成的目的合成的目的2. 合成的要求:合成的要求: 通过一定的反应,使原来分子中某一个或几个化学通过一定的反应,使原来分子中某一个或几个化学键断裂,同时形成一个或几个新的化学键,从而使分子键断裂,同时形成一个或几个新的化学键,从而使分子发生转变或将几个小分子连接起来。发生转变或将几个小
52、分子连接起来。 合成的步骤越少越好;合成的步骤越少越好; 每步的产率越高越好;每步的产率越高越好; 原料越便宜越好。原料越便宜越好。13.9 有机合成路线有机合成路线 化学反应化学反应是是合成合成的的基础基础,合成路线合成路线本来就是由一些本来就是由一些具具体的反应体的反应,按照一定的,按照一定的逻辑思维逻辑思维组合起来的。组合起来的。 合成目标化合物分子的骨架合成目标化合物分子的骨架 引入所需的官能团引入所需的官能团 解决好目标化合物的立体化学方面的要求解决好目标化合物的立体化学方面的要求合成一个有机化合物要考虑的合成一个有机化合物要考虑的核心问题核心问题不外是不外是三个方面三个方面: 碳胳
53、的形成和变化碳胳的形成和变化 增长碳链或增加支链增长碳链或增加支链 碳链的减短碳链的减短 碳环的合成碳环的合成 官能团的引入官能团的引入 官能团的相互转化官能团的相互转化二、有机合成的基本反应二、有机合成的基本反应 在在有机合成有机合成中,往往要考虑到中,往往要考虑到某些官能团某些官能团也会受到也会受到反应试反应试剂剂或或条件条件的影响而的影响而产生副反应产生副反应,甚至影响整个合成过程。因此,甚至影响整个合成过程。因此在合成时必须采取对某些在合成时必须采取对某些受影响的基团受影响的基团暂时暂时转换转换为另外的为另外的稳定稳定的结构的结构,而进行,而进行保护措施保护措施,待反应完毕再使,待反应
54、完毕再使基团复原基团复原。 在选择保护基时要符合下列要求在选择保护基时要符合下列要求: 在温和条件下易与被保护基团反应。在温和条件下易与被保护基团反应。 保护基必须在保护阶段的各种条件下是稳定的。保护基必须在保护阶段的各种条件下是稳定的。 保护基易于在温和条件下除去。保护基易于在温和条件下除去。三、官能团的保护三、官能团的保护 当我们为一个当我们为一个目标化合物目标化合物设计了设计了几条可几条可能能的的合成路线合成路线时,可以根据时,可以根据几条原则几条原则来来评估评估各条路线各条路线的的优劣优劣,从而,从而选择最佳路线选择最佳路线。1. 有机合成路线的选择原则有机合成路线的选择原则:四、选择
55、合成路线的步骤和方法四、选择合成路线的步骤和方法选择路选择路 线原则线原则结构上要求结构上要求碳架的形成碳架的形成官能团的引入官能团的引入经济上要求经济上要求 原料易得,便宜原料易得,便宜 产物易分离,收率高,副产物易分离,收率高,副 步骤要求简单步骤要求简单 反应经典,可发生,条件反应经典,可发生,条件温和,对环境污染小温和,对环境污染小反应少反应少反应反应步骤少步骤少,收率要高收率要高是选择是选择合成路线合成路线的的重要因素重要因素。如化学反应:如化学反应:AABABCABCDBCD 假如反应假如反应每步产率每步产率90%,则,则3步后总产率步后总产率为为(0.9)3 100 = 73%
56、假如反应假如反应每步产率每步产率70%,则,则3步后总产率步后总产率为为(0.7)3 100 = 34%平衡法:平衡法:A AB ABCBCD DE DEFEFABCDEF90%90%90%90%90%其中只有其中只有3步连续,步连续,总产率总产率为(为(0.9)3 100 = 73%A AB ABC ABCD ABCDE ABCDEFBCDEF如用如用5步反应,步反应,每步产率每步产率90%,直线法:直线法:则则5步后总产率步后总产率为(为(0.9)5 100 = 59% 原料易得原料易得是指合成要用些是指合成要用些基本的原料基本的原料。常用。常用“三烯一炔三烯一炔”(乙乙、丙丙、丁烯丁烯及
57、及乙炔乙炔),),“三苯一三苯一萘萘”(苯苯、甲苯甲苯、二甲苯二甲苯及及萘萘)及小于)及小于C4原子的原子的醇醇类类和和甲醛甲醛、乙醛乙醛、草酸草酸、卤苯卤苯、环己烷环己烷、丙二酸二丙二酸二乙酯乙酯等。等。 实验方法切实可行实验方法切实可行,包括,包括实验室方法实验室方法或或工业方法工业方法,因为并非所有的反应都有合成意义。另外,尽量使用因为并非所有的反应都有合成意义。另外,尽量使用经典的反应经典的反应,若,若不平常的反应不平常的反应过多,过多,失败的机会失败的机会也会也会多,且多,且关键的反应关键的反应越早出现越好,即决定整个合成越早出现越好,即决定整个合成成成败的反应败的反应应应尽早出现尽
58、早出现。如果。如果关键反应关键反应在整个合成路线在整个合成路线的后面,一旦失败,就前功尽弃。的后面,一旦失败,就前功尽弃。例如:由例如:由 CH3CH2OH CH3CH2CH2CH2OH 合成合成 首先分析产物的首先分析产物的结构要求结构要求,包括包括碳架碳架、官能团官能团及其及其 位置立体化学位置立体化学要求等。要求等。 利用利用倒推倒推(逆向合成逆向合成)法思考法思考。 从产物的从产物的结构结构回忆所有可能的回忆所有可能的合成方法合成方法,确定初步,确定初步 合成的方案。合成的方案。2. 解合成题的基本方法解合成题的基本方法 有机合成有机合成设计就是在合成一个化合物之前,设计就是在合成一个
59、化合物之前,研研究究、设计设计最佳的合成路线最佳的合成路线,它是,它是有机合成有机合成成败的关成败的关键,目前有机合成路线设计多采用键,目前有机合成路线设计多采用逆向合成法逆向合成法。 其特点是其特点是先剖析先剖析目标分子的结构目标分子的结构,从目标分,从目标分子开始,子开始,逆推至中间物逆推至中间物,逐步,逐步倒推到原料倒推到原料,并要考,并要考虑如何从简便的虑如何从简便的原料开始原料开始(经过哪些反应)合成出(经过哪些反应)合成出目标分子目标分子。 从头从头完成反应式完成反应式,重要的条件重要的条件要要注明注明,如反应,如反应的的温度温度、压力压力、催化剂催化剂、溶剂溶剂等。等。 对对目标
60、分子目标分子A,可能的,可能的中间物中间物(B、C、D、E)或或起始原料起始原料(F、GO、P)。)。A 目标分子(目标分子(T.M.)B C D E F GH IJ K LM N O P“合成树合成树”3. 目标分子拆开的一般方法目标分子拆开的一般方法: 在进行在进行有机合成有机合成时,一般用时,一般用割切法割切法,如何,如何割切割切则有则有多种多种方法,但其中有方法,但其中有一部分割切一部分割切是是没有意义没有意义的,的,要找到要找到最佳最佳的的割切方法割切方法,可根据如下,可根据如下原则原则割切:割切: 最大程度简最大程度简化化ba从从a 处分割:处分割:C CH3CH3OHaC CH3
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024年CPMM考前应对技巧全解试题及答案
- HZHY-AI200-B载板技术规格说明书
- 2024年国际物流的政策环境分析试题及答案
- 植物的水分吸收机制试题及答案
- 企业疫情防控培训课件
- 2024年采购管理师重要概念试题及答案
- 浙教版 2021-2022学年度八年级数学上册模拟测试卷
- 伤寒防控课件
- 2025天津现代职业技术学院辅导员考试题库
- 2025山东财经大学燕山学院辅导员考试题库
- 国家义务教育质量监测八年级美术样卷
- 2025年广东省广州市海珠区官洲街雇员招聘5人历年自考难、易点模拟试卷(共500题附带答案详解)
- 滑坡地质灾害治理工程资源需求与保障措施
- 2020智能变电站调试规范
- 中央戏剧学院招聘考试真题2024
- 专题07力、运动和-5年(2020-2024)中考1年模拟物理真题分类汇编(天津专用)(带答案解析)
- (一模)淄博市及滨州市2024-2025学年度高三模拟考试语文试卷(含答案)
- 2025年云南省中考语文试题解读及复习备考指导(深度课件)
- 陕西省安康市2024-2025学年高三下学期第二次质量考试(二模)地理试题(含答案)
- 2025年宁波城市职业技术学院单招职业技能测试题库新版
- 人工智能基础 课件 10.3 制作数字人

评论
0/150
提交评论