



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
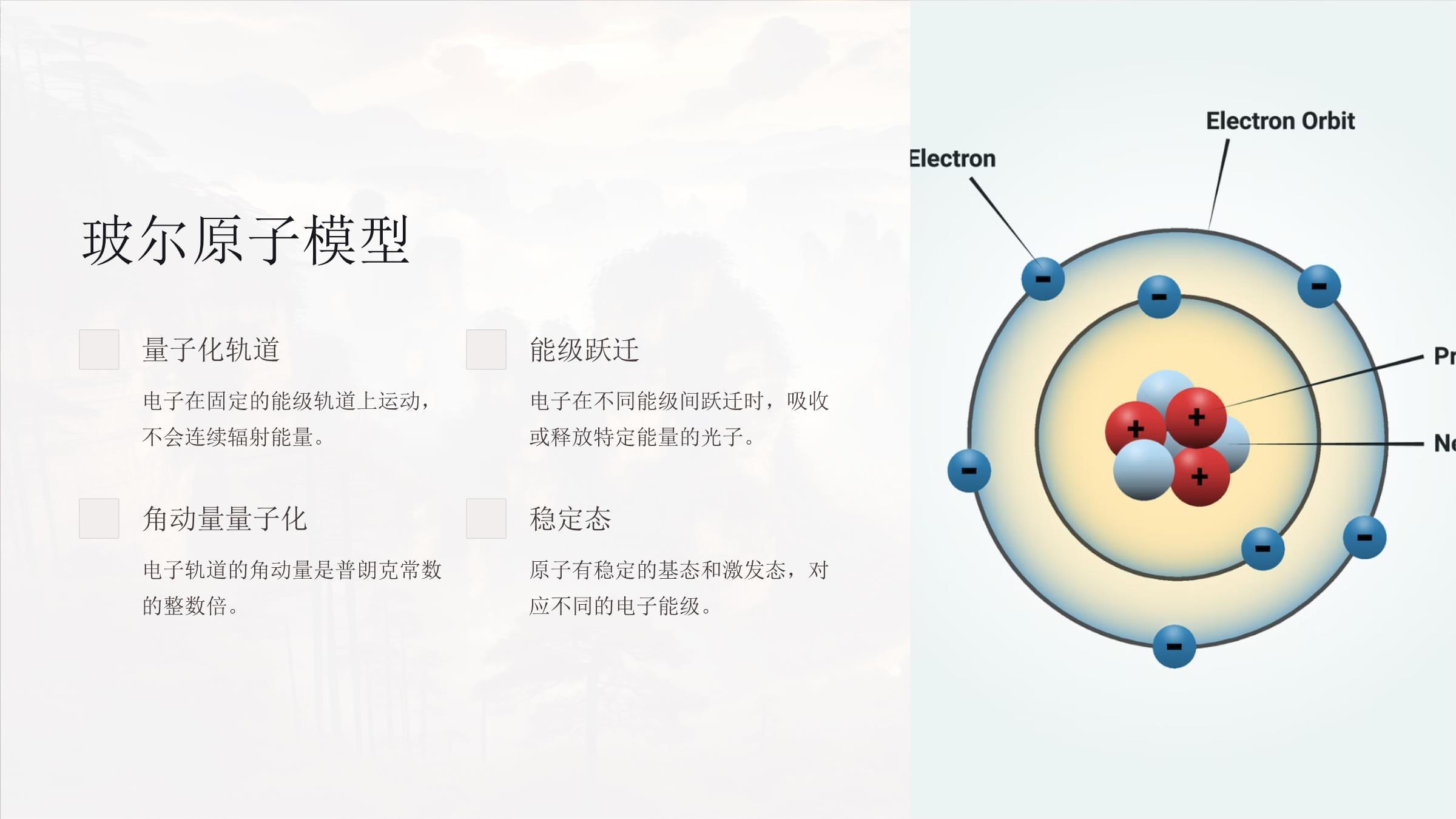
原子核外电子排布欢迎来到原子核外电子排布的深入探讨。本课程将带您揭示原子结构的奥秘,了解电子如何围绕原子核运动。我们将从原子模型的发展历程开始,逐步深入到量子力学的核心概念。让我们一起开启这段奇妙的原子之旅!原子模型的发展历程1道尔顿模型1808年,约翰·道尔顿提出原子是不可分割的实心球体。2汤姆森模型1897年,J.J.汤姆森提出"葡萄干布丁模型",认为原子是均匀带正电的球体。3卢瑟福模型1911年,卢瑟福提出"核式模型",认为原子由中心原子核和外围电子组成。4玻尔模型1913年,尼尔斯·玻尔提出量子化轨道模型,奠定了现代原子理论基础。玻尔原子模型量子化轨道电子在固定的能级轨道上运动,不会连续辐射能量。能级跃迁电子在不同能级间跃迁时,吸收或释放特定能量的光子。角动量量子化电子轨道的角动量是普朗克常数的整数倍。稳定态原子有稳定的基态和激发态,对应不同的电子能级。量子数主量子数(n)描述电子能级,决定电子轨道的大小和能量。n为正整数。角量子数(l)描述轨道角动量,决定轨道的形状。l的取值范围为0到n-1。磁量子数(ml)描述轨道磁矩,决定轨道的空间取向。ml的取值范围为-l到+l。自旋量子数(ms)描述电子自旋,只能取+1/2或-1/2两个值。电子的自旋自旋概念电子除了绕原子核运动外,还具有自旋运动。这种内禀角动量被称为自旋。自旋量子数电子自旋量子数ms只能取+1/2或-1/2,对应"自旋向上"和"自旋向下"两种状态。泡利不相容原理同一轨道中的两个电子必须具有相反的自旋,这是电子排布的重要原则。能级和轨道能级电子所处的不同能量状态,由主量子数n决定。轨道电子在原子中可能出现的空间区域,由n、l、ml共同决定。轨道形状s轨道球形,p轨道哑铃形,d和f轨道更复杂。能级和电子配置能级填充顺序电子按照能量从低到高依次填充各能级。电子层主量子数相同的电子组成一个电子层,用K、L、M、N等表示。电子亚层角量子数相同的轨道组成一个亚层,用s、p、d、f表示。电子配置用数字和字母表示电子在各亚层的分布,如1s²2s²2p⁶。电子排布规律1能量最低原理电子优先占据能量较低的轨道。2泡利不相容原理同一轨道最多容纳两个自旋相反的电子。3洪特规则同一亚层的轨道先单电子占据,自旋平行。能级占据原理11s最低能级,最先被占据。22s2p第二能级,2s先于2p被占据。33s3p第三能级,遵循相同顺序。44s3d4p4s能量低于3d,先被占据。电子跃迁与光谱基态和激发态基态是电子处于最低能级的状态。激发态是电子处于高能级的不稳定状态。电子跃迁电子从高能级跃迁到低能级时,释放特定波长的光子,形成发射光谱。吸收光谱电子吸收特定能量的光子,从低能级跃迁到高能级,形成吸收光谱。氢原子电子排布1最简单的原子氢原子只有一个质子和一个电子。2基态电子构型1s¹,电子位于最低能级的s轨道。3激发态电子可以跃迁到更高能级,如2s、2p等。4光谱系列莱曼系列、巴尔末系列等对应不同的电子跃迁。碱金属元素电子排布锂(Li)电子构型:1s²2s¹钠(Na)电子构型:[Ne]3s¹钾(K)电子构型:[Ar]4s¹碱金属元素的最外层都有一个单独的s电子,这决定了它们的化学性质。碱土金属元素电子排布铍(Be)电子构型:1s²2s²镁(Mg)电子构型:[Ne]3s²钙(Ca)电子构型:[Ar]4s²特点最外层有两个s电子,化学性质相似。过渡金属元素电子排布d区元素特点过渡金属的特征是d亚层逐渐填满。它们的电子构型通常以[惰性气体核]nd¹⁻¹⁰(n+1)s¹⁻²形式表示。例子钪(Sc):[Ar]3d¹4s²钛(Ti):[Ar]3d²4s²铬(Cr):[Ar]3d⁵4s¹(异常构型)铁族元素电子排布1铁(Fe)[Ar]3d⁶4s²2钴(Co)[Ar]3d⁷4s²3镍(Ni)[Ar]3d⁸4s²铁族元素的3d轨道逐渐填满,这影响了它们的磁性和催化性能。银铜组元素电子排布铜(Cu)电子构型:[Ar]3d¹⁰4s¹银(Ag)电子构型:[Kr]4d¹⁰5s¹金(Au)电子构型:[Xe]4f¹⁴5d¹⁰6s¹这些元素的d轨道已满,最外层有一个s电子,具有良好的导电性和延展性。卤素元素电子排布氟(F)电子构型:1s²2s²2p⁵氯(Cl)电子构型:[Ne]3s²3p⁵溴(Br)电子构型:[Ar]3d¹⁰4s²4p⁵碘(I)电子构型:[Kr]4d¹⁰5s²5p⁵卤素元素最外层都缺少一个电子,因此具有强烈的得电子倾向。气体元素电子排布氢(H)电子构型:1s¹最简单的原子,只有一个电子。氧(O)电子构型:1s²2s²2p⁴外层有6个电子,易形成共价键。氮(N)电子构型:1s²2s²2p³外层有5个电子,能形成多重键。稀有气体元素电子排布氦(He)电子构型:1s²氖(Ne)电子构型:1s²2s²2p⁶氩(Ar)电子构型:[Ne]3s²3p⁶特点最外层电子壳层填满,非常稳定。元素周期表的电子排布s区元素第1、2族元素,最外层为s轨道。p区元素第13-18族元素,最外层为p轨道。d区元素过渡金属,d轨道逐渐填满。f区元素镧系和锕系元素,f轨道逐渐填满。元素性质与电子排布的关系原子半径同一周期从左到右原子半径减小,主要由核电荷增加导致。电离能同一周期从左到右电离能增大,最外层电子受核吸引力增强。电负性与电离能趋势类似,非金属元素电负性较大。金属性与最外层电子数有关,金属倾向随族数增加而减弱。电子排布与元素化学性质价电子最外层电子决定元素的化学性质。碱金属易失去电子,卤素易得到电子。氧化还原性与价电子数有关。金属易失去电子被氧化,非金属易得到电子被还原。化合价由价电子数决定。过渡金属可表现多种化合价,与d电子有关。离子的电子排布阳离子失去外层电子,如Na⁺:1s²2s²2p⁶阴离子得到额外电子,如Cl⁻:1s²2s²2p⁶3s²3p⁶八电子规则大多数离子倾向于形成稳定的八电子结构。配位化合物中的电子排布1中心金属离子通常是过渡金属,具有未填满的d轨道。2配体提供孤对电子,与中心金属形成配位键。3晶体场理论解释配合物的颜色和磁性,基于d轨道分裂。418电子规则稳定的过渡金属配合物通常遵循18电子规则。电子云图与电子排布概念电子云图描述了电子在原子中可能出现的概率分布。它是量子力学对电子行为的直观表示。形状s轨道呈球形,p轨道呈哑铃形,d轨道更复杂。这些形状反映了电子的空间分布。多电子原子复杂原子的电子云是多个轨道的叠加,形成独特的电子密度分布。电子排布对生活的影响LED灯基于半导体的电子跃迁原理,实现高效照明。电池技术利用元素的氧化还原性,开发高性能电池。太阳能电池基于光电效应,将光能转化为电能。电子排布在科学研究中的应用材料科学设计新型材料,如超导体和纳米材料。化学反应预测和解释化学反应机理。光谱分析利用原子发射光谱进行元素分析。量子计算开发基于量子态的新型计算技术。电子排布知识总结1基本概念量子数、轨道、能级2排布规则能量最低原理、泡利不相容原理、洪特规则3元素特性周期性、化学性质、物理性质4应用材料设计、化学反应、能源技术思考问题与讨论1电子构型与化学键电子排布如何影响化学键的形成?2新元素预测如何利用电子排布规律预测新元素的性质?3量子计算电子排布理论在量子计算中
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2024年宠物营养职业教育现状试题及答案
- KPI设定与绩效管理试题及答案
- 二手车评估中的文化差异分析试题及答案
- 汽车系统故障排除的三步法则试题及答案
- 心血管患者的心理护理
- 室内设计风格试题及答案
- 汉语言文学小自考考点分析与试题答案
- 2024年小自考公共管理考试特色试题及答案
- 美容师考试考生近期动态解读试题及答案
- 护理成果改善报告
- 上海海洋大学《微生物学》2023-2024学年第二学期期末试卷
- 法院调解以物抵债协议范文5篇
- Unit 4 Healthy food Part A Let's learn(课件)-2024-2025学年人教PEP版英语三年级下册
- 二零二五年度研学旅行基地运营管理合同协议
- 2025重庆市安全员B证考试题库附答案
- 山东烟台历年中考语文文言文阅读试题22篇(含答案与翻译)(截至2023年)
- (八省联考)陕西省2025年高考综合改革适应性演练 生物试卷(含答案详解)
- DG-TJ 08-2336-2020 绿道建设技术标准
- 新建农副产品深加工项目立项申请报告
- 工商企业管理毕业论文范文 工商企业管理5000论文范文
- 国际金融学课件完整版

评论
0/150
提交评论