



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
2025高考化学二轮复习杂化类型与分子空间结构判断键角的大小比较必备知识1.利用价层电子对互斥模型推测分子的空间结构价层电子对互斥模型(VSEPR模型)反映价层电子对的空间结构,而分子的空间结构仅是成键电子对的空间结构,不包括孤电子对。(当中心原子无孤电子对时,分子或离子的空间结构与VSEPR模型一致;当有孤电子对时,分子或离子的空间结构为去掉孤电子对后剩余部分的空间结构,且孤电子对会对分子或离子的空间结构产生“挤压”效果,使键角变小。)2.杂化轨道理论(1)杂化轨道理论的要点当原子成键时,原子的价层电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间结构不同。杂化类型杂化轨道数目杂化轨道夹角空间结构实例sp2180°直线形BeCl2sp23120°平面三角形BF3sp34109°28'正四面体形CH4(2)中心原子的杂化轨道类型和分子或离子空间结构的相互判断分子组成(A为中心原子)价层电子对数(杂化轨道数)中心原子的孤电子对数中心原子的杂化方式分子空间结构实例AB220sp直线形CO2、BeCl231sp2V形SO2、SnCl2、PbCl242sp3V形H2O、H2SAB330sp2平面三角形BF3、SO341sp3三角锥形NH3、PH3AB440sp3正四面体形CH4、SO4CCl4、NH3.判断键角大小的思维流程
课堂练考点一杂化类型与分子空间结构判断例1[2024·河北卷]NH4ClO4是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:NH4ClO4+2CNH3↑+2CO2↑+HCl↑。下列有关化学用语或表述正确的是 ()A.HCl的形成过程可表示为H·+·Cl····:H+[:Cl··B.NH4ClO4中的阴、阳离子有相同的VSEPR模型和空间结构C.在C60、石墨、金刚石中,碳原子有sp、sp2和sp3三种杂化方式D.NH3和CO2都能作制冷剂是因为它们有相同类型的分子间作用力例2[2024·湖南卷]通过理论计算方法优化了P和Q的分子结构,P和Q呈平面六元并环结构,原子的连接方式如图所示,下列说法错误的是 ()A.P为非极性分子,Q为极性分子B.第一电离能:B<C<NC.1molP和1molQ所含电子数目相等D.P和Q分子中C、B和N均为sp2杂化例3(1)[2024·全国甲卷节选]一种光刻胶薄膜成分为聚甲基硅烷,其中电负性最大的元素是,硅原子的杂化轨道类型为。
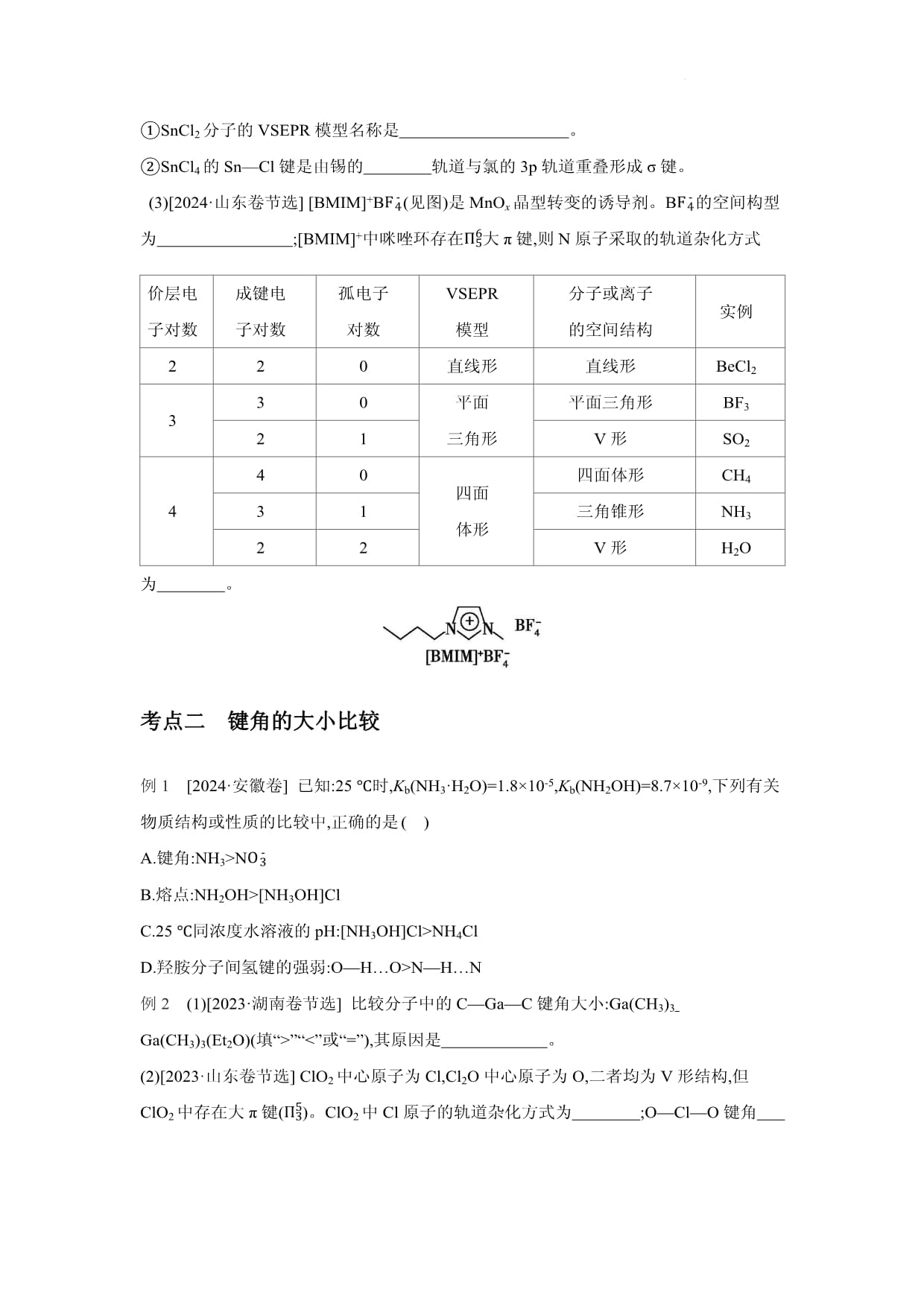
(2)[2024·北京卷节选]SnCl2和SnCl4是锡的常见氯化物,SnCl2可被氧化得到SnCl4。①SnCl2分子的VSEPR模型名称是。
②SnCl4的Sn—Cl键是由锡的轨道与氯的3p轨道重叠形成σ键。
价层电子对数成键电子对数孤电子对数VSEPR模型分子或离子的空间结构实例220直线形直线形BeCl2330平面三角形平面三角形BF321V形SO2440四面体形四面体形CH431三角锥形NH322V形H2O(3)[2024·山东卷节选][BMIM]+BF4-(见图)是MnOx晶型转变的诱导剂。BF4-的空间构型为;[BMIM]+中咪唑环存在考点二键角的大小比较例1[2024·安徽卷]已知:25℃时,Kb(NH3·H2O)=1.8×10-5,Kb(NH2OH)=8.7×10-9,下列有关物质结构或性质的比较中,正确的是 ()A.键角:NH3>NOB.熔点:NH2OH>[NH3OH]ClC.25℃同浓度水溶液的pH:[NH3OH]Cl>NH4ClD.羟胺分子间氢键的强弱:O—H…O>N—H…N例2(1)[2023·湖南卷节选]比较分子中的C—Ga—C键角大小:Ga(CH3)3
Ga(CH3)3(Et2O)(填“>”“<”或“=”),其原因是
。
(2)[2023·山东卷节选]ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键(Π35)。ClO2中Cl原子的轨道杂化方式为;O—Cl—O键角Cl—O—Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl—O的键长并说明原因:
课后练1.含氮化合物应用广泛,下列说法正确的是 ()A.NH3的价层电子对互斥模型为三角锥形B.NO3C.每个[Ag(NH3)2]+中有6个σ键D.(CH3)2NNH2中C、N的杂化方式不同2.烟道气中含有SO2,通过一系列反应可得重要的硫氮化合物S4N4,S4N4不溶于水,可溶于CS2。下列说法错误的是 ()A.SO(NH2)2、NH3均能与H2O形成氢键B.SOCl2的空间结构为三角锥形C.S2Cl2中S的杂化轨道类型为sp3D.硫氮化合物S4N4为非极性分子3.[2024·重庆渝西中学模拟]三氯氧磷(POCl3)可由如下两种方法制取:2PCl3+O22POCl3,P4O10+6PCl510POCl3,其中P4O10的结构如图所示。下列说法正确的是 ()A.P4O10中只含有σ键B.基态原子第一电离能:Cl>S>PC.PCl3的VSEPR模型为四面体形D.PCl3和POCl3中P原子的杂化类型不相同4.[2024·湖北重点高中联盟联考]卤族元素除F元素外,Cl、Br、I均可形成多种含氧酸。下列说法正确的是 ()A.键角:ClO2->IOB.AlF3、AlCl3都是平面三角形分子C.基态F原子核外电子的空间运动状态有9种D.ClO2-、IO35.[2024·湖北新高考联盟二模]联氨(NH2—NH2)是一种绿色无污染的还原剂,NH2—NH2分子可能有以下两种不同的构象,沿N—N键轴方向的投影如图所示。下列说法错误的是 ()A.NH2—NH2中N原子杂化方式为sp3B.实验测得NH2—NH2分子的极性很大,则其结构为构象bC.NH2—NH2的沸点高于CH3—CH3的沸点D.NH2—NH2中的键角∠N—N—H小于H2O2中的键角∠O—O—H6.(1)[2024·湖南衡阳二模]H2S、PH3、SiH4中键角从大到小的顺序是(用化学式表示),其原因是
。
(2)[2024·山东日照模拟]N2O和NO2中心原子都是N原子,都存在大π键(∏34),NO2是V形分子。N2O、NO2中N原子的轨道杂化方式分别为、;N—N—O键角(3)[2024·山东烟台一模]广谱杀虫剂硫酰氟(SO2F2)常温常压下为无色气体,S原子的轨道杂化方式为,其F—S—F键角(填“>”或“<”)硫酰氯(SO2Cl2)中的Cl—S—Cl键角,原因是
。
答案解析课堂练考点一杂化类型与分子空间结构判断例1B[解析]HCl是共价化合物,其电子式为H:Cl····:,HCl的形成过程可表示为,故A错误;NH4ClO4中NH4+的中心N原子上的孤电子对数为12×(5-1-4×1)=0,价层电子对数为4,ClO4-的中心Cl原子上的孤电子对数为12×(7+1-4×2)=0,价层电子对数为4,则二者的VSEPR模型和空间结构均为正四面体形,故B正确;C60、石墨、金刚石中碳原子的杂化方式分别为sp2、sp例2A[解析]由所给分子结构图可知,P和Q呈平面六元并环结构,正电中心与负电中心重合,都是非极性分子,A错误;同周期元素,从左到右第一电离能呈增大趋势,则第一电离能由小到大的顺序为B<C<N,故B正确;由所给分子结构可知,P分子式为C24H12,Q分子式为B12N12H12,1个P分子、1个Q分子均含156个电子,故1molP和1molQ所含电子数目相等,C正确;由所给分子结构可知,P和Q分子中C、B和N均与三个原子成键,P和Q分子呈平面六元并环结构,故P和Q分子中C、B和N均为sp2杂化,D正确。例3(1)Csp3(2)①平面三角形②sp3杂化(3)正四面体形sp2[解析](1)一种光刻胶薄膜成分为聚甲基硅烷,含C、Si、H三种元素,其电负性大小:C>H>Si,则电负性最大的元素是C,硅原子与周围的4个原子形成共价键,没有孤电子对,价层电子对数为4,则硅原子的杂化轨道类型为sp3。(2)①SnCl2的中心原子Sn的价层电子对数为2+4−2×12=3,有1个孤电子对,VSEPR模型是平面三角形。②SnCl4的中心原子Sn的价层电子对数为4+4−4×12=4,所以Sn采用sp3杂化方式,则SnCl4的Sn—Cl键是由锡的sp3杂化轨道与氯的3p轨道重叠形成σ键。(3)BF4-中B形成4个σ键(其中有1个配位键),为sp3杂化,BF4-考点二键角的大小比较例1D[解析]NH3中心N原子的价层电子对数=3+12×(5-3×1)=3+1=4,为sp3杂化,键角为107°,NO3-中心N原子的价层电子对数=3+12×(5+1-3×2)=3+0=3,为sp2杂化,键角为120°,故键角:NH3<NO3-,A项错误;NH2OH为分子晶体,[NH3OH]Cl为离子晶体,故熔点:NH2OH<[NH3OH]Cl,B项错误;由题目信息可知,25℃下,Kb(NH3·H2O)>Kb(NH2OH),故NH2OH的碱性比NH3·H2O弱,同浓度的水溶液中,[NH3OH]+的水解程度大于N例2(1)>Ga(CH3)3中Ga为sp2杂化,为平面结构,而Ga(CH3)3(Et2O)中Ga为sp3杂化,为四面体结构(2)sp2>ClO2分子中Cl—O键的键长小于Cl2O中Cl—O键的键长,ClO2分子中既存在σ键,又存在大π键,原子轨道重叠的程度较大,而Cl2O只存在σ键,因此ClO2中Cl—O的键长较小[解析](1)分子中的C—Ga—C键角:Ga(CH3)3>Ga(CH3)3(Et2O),其原因是Ga(CH3)3中Ga为sp2杂化,为平面结构,而Ga(CH3)3(Et2O)中Ga为sp3杂化,为四面体结构,sp3杂化轨道的夹角小于sp2杂化轨道。(2)由ClO2中存在Π35可以推断,其中Cl原子提供1对电子,有一个O原子提供1个电子,另一个O原子提供1对电子,这5个电子处于相互平行的p轨道中形成大π键,Cl原子提供孤电子对与其中一个O原子形成配位键,与另一个O原子形成的是普通的共价键(σ键,这个O原子只提供了一个电子参与形成大π键),则Cl原子还有1个孤电子对,Cl原子的价层电子对数为3,则Cl原子的轨道杂化方式为sp2;Cl2O中心原子为O,O原子的价层电子对数为2+6−2×12=4,有2个孤电子对,因此,O原子的杂化方式为sp3,根据价层电子对互斥模型可知,价层电子对数=4时,VSEPR模型为四面体形,价层电子对数=3时,VSEPR模型为平面三角形,sp2杂化的键角一定大于sp3的,因此,虽然ClO2和Cl2O均为V形结构,但O—Cl—O键角大于Cl—O—Cl键角,孤电子对对成键电子对的排斥作用也改变不了这个结论。ClO2分子中既存在σ键,又存在大π键,原子轨道重叠的程度较大,而Cl2课后练1.B[解析]NH3中心原子价层电子对数为3+12×(5-1×3)=3+1=4,其价层电子对互斥模型为四面体形,故A错误;NO3-中心原子价层电子对数为3+12×(5+1-2×3)=3+0=3,其空间结构为平面三角形,故B正确;配位键为σ键,因此每个[Ag(NH3)2]+中有8个σ键,故C错误;(CH3)2NNH2中C有四个价键,没有孤对电子,其杂化方式为sp2.B[解析]SO(NH2)2、NH3含有电负性较强的N,与H2O中的H可形成氢键,A正确;SOCl2的结构式为,S的价层电子对数为4,孤电子对数为1,则其空间结构为平面三角形,B错误;S2Cl2中S的价层电子对数为2+2=4,则S2Cl2中S的杂化轨道类型为sp3,C正确;硫氮化合物S4N4不溶于水,可溶于CS2,根据“相似相溶”规律,推测其为非极性分子,D正确。3.C[解析]P4O10结构中含有P—O、PO,既有σ键,又有π键,A错误;同周期元素从左到右第一电离能有增大的趋势,但P元素原子3p能级处于半充满状态,第一电离能高于同周期相邻元素,故基态原子第一电离能为Cl>P>S,B错误;PCl3中P原子的价层电子对数为3+12×(5-3×1)=4,VSEPR模型为四面体形,C正确;PCl3分子中磷原子价层电子对数为4,所以磷原子采取sp3杂化,POCl3的中心P原子上没有孤电子对,所以磷原子采取sp3杂化类型,杂化类型相同,D错误。4.D[解析]孤电子对数越多,排斥力越大,键角越小,ClO2-中Cl的孤电子对数为12×(7+1-2×2)=2,IO3-中I的孤电子对数为12×(7+1-3×2)=1,BrO4-中Br的孤电子对数为12×(7+1-4×2)=0,故键角:ClO2-<IO3-<BrO4-,A错误;AlF3是离子化合物,AlCl3为共价化合物,是平面三角形分子,B错误;基态F原子核外电子排布为1s22s22p55.D[解析]NH2—NH2中每个N原子周围均形成了3个σ键还有一个孤电子对,价层电子对数为4,故N的杂化方式为sp3杂化,A正确;构象a的正电中心与负电中心重合,为非极性分子,而构象b才为极性分子,B正
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 个人与银行2024年度借款合同3篇
- 专业吊车作业协议模板2024版
- 2024版产品标准化认证协议文件版B版
- 2024中美农产品加工与出口合作协议范文3篇
- 2024机器租赁协议书
- 抢占春节外卖市场
- 2024年度地产公司房地产广告效果评估与优化委托代理协议3篇
- 2024年股权质押担保协议标准格式版B版
- 解读现代小说奥秘
- 2024年货款分期偿还买卖约定
- 2024版城市绿化养护合同补充协议3篇
- GB/T 19799.2-2024无损检测超声检测试块第2部分:2号标准试块
- 2024-2025学年冀教新版八年级上册数学期末复习试卷(含详解)
- DB45T 1831-2018 汽车加油加气站防雷装置检测技术规范
- 水资源调配与优化-洞察分析
- 无人机职业生涯规划
- 2024-2025学年语文二年级上册 统编版期末测试卷(含答案)
- 2024-2025年江苏专转本英语历年真题(含答案)
- 红色中国风蛇年晚会竖版邀请函
- 电力线路迁改工程方案
- 第四届全省职业技能大赛技术文件-工业控制样题

评论
0/150
提交评论