



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
第五章物质结构与性质元素周期律第4讲化学键分子的空间结构目
录Contents01考点1化学键及物质构成02考点2分子的空间结构03热点帮关注热点专项突破04练习帮练透好题精准分层
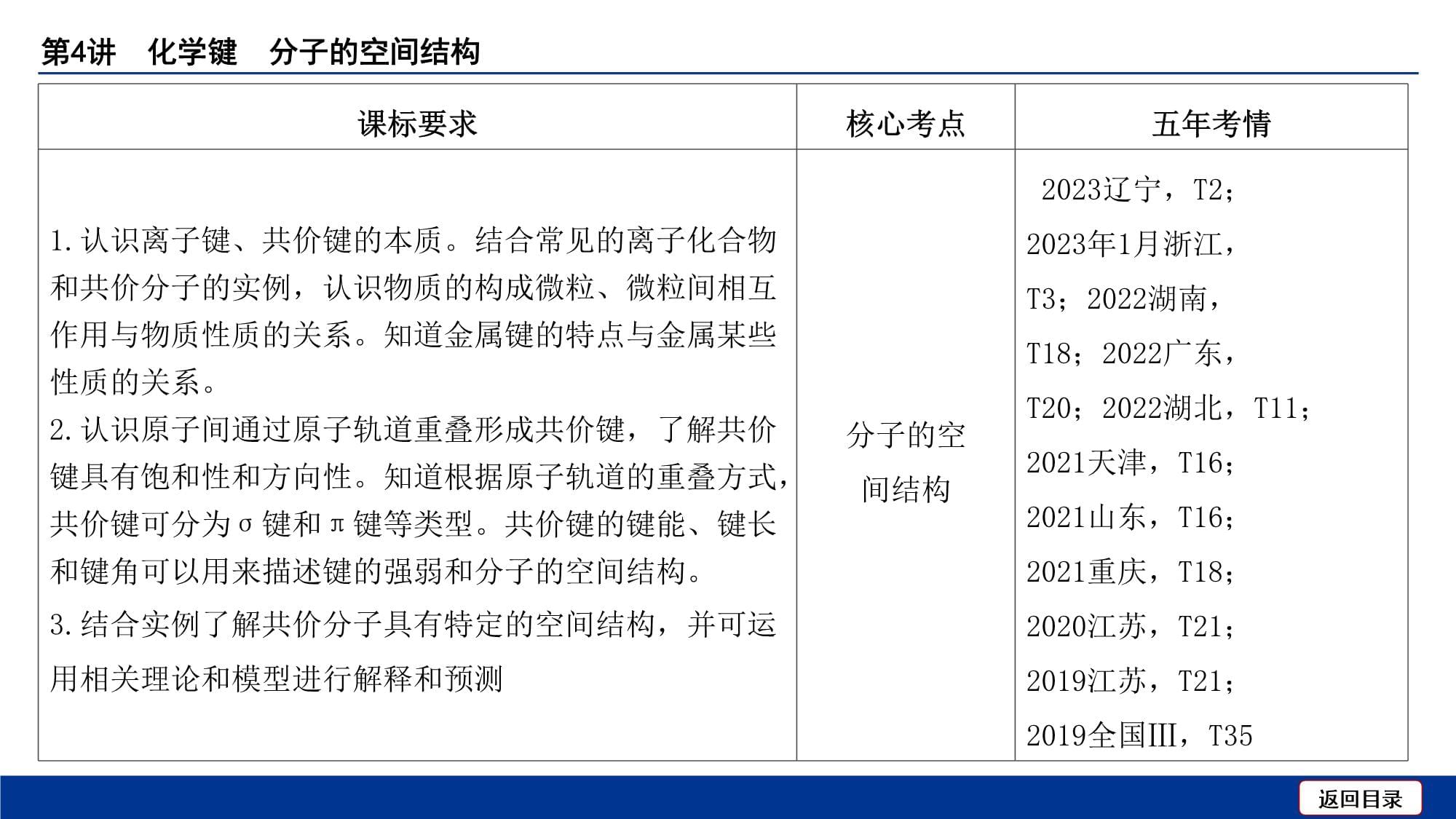
课标要求核心考点五年考情1.认识离子键、共价键的本质。结合常见的离子化合物和共价分子的实例,认识物质的构成微粒、微粒间相互作用与物质性质的关系。知道金属键的特点与金属某些性质的关系。2.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构。3.结合实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测化学键及
物质构成2023江苏,T5;2023湖北,T5;2022全国甲,T35;2022天津,T4;2022湖南,T18;2022广东,T20;2021福建,T14;2020山东,T7;2020江苏,T21;2019上海,T3课标要求核心考点五年考情1.认识离子键、共价键的本质。结合常见的离子化合物和共价分子的实例,认识物质的构成微粒、微粒间相互作用与物质性质的关系。知道金属键的特点与金属某些性质的关系。2.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。共价键的键能、键长和键角可以用来描述键的强弱和分子的空间结构。3.结合实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测分子的空
间结构2023辽宁,T2;
2023年1月浙江,
T3;2022湖南,
T18;2022广东,
T20;2022湖北,T11;
2021天津,T16;
2021山东,T16;
2021重庆,T18;
2020江苏,T21;
2019江苏,T21;
2019全国Ⅲ,T35核心素养对接1.宏观辨识与微观探析:能联系物质的组成和结构解释宏观现象;能从物质的微观结构说明同类物质的共性和不同类物质性质的差异及原因。2.证据推理与模型认知:能根据化学键的特点,解释和预测化合物的性质;能理解、描述VSEPR模型和杂化轨道理论模
型,并运用VSEPR模型和杂化轨道理论模型解释或推测物质的组成、结构、性质与变化
命题分析预测1.高考常考查化学键类型的判断、复杂离子或分子的空间结构、等电子体的判断等,其中氢键、大π键是近两年的考查热点,考查考生对微观粒子结构的认知能力。2.2025年高考可能会选择有社会价值或研究价值的新颖素材创设命题情境,考查化学键类型的判断、复杂离子或分子的空间结构等
1.
宏观与微观结合视角2.
模型化视角(1)用电子式、结构式表征化学键。(2)利用价层电子对互斥模型预测分子的空间结构。(3)利用杂化轨道理论解释分子的空间结构。
σπ极性非极性饱和方向稳定空间结构考点1化学键及物质构成
1.
化学键2.
共价键
共价键是原子间通过共用电子对所形成的相互作用,具有饱和性和方向性。(1)共价键的分类分类依据类型形成共价键的
原子轨道的重
叠方式σ键原子轨道[1]
重叠(s-sσ键、s-pσ键、p-
pσ键)π键原子轨道[2]
重叠(p-pπ键)形成共价键的
共用电子对是
否偏移极性键(A—B型)共用电子对[3]
偏移,一个原子呈正电性(δ
+),一个原子呈负电性(δ-)非极性键(A—A型)共用电子对[4]
偏移,成键原子呈电中性头碰头肩并肩发生不发生分类依据类型原子间共用电
子对的数目单键:原子间有[5]
对共用电子对。双键:原子间有[6]
对共用电子对。三键:原子间有[7]
对共用电子对提醒只有两原子的电负性相差不大时,才能形成共用电子对,形成共价键,当两
原子的电负性相差很大时,形成离子键。1
2
3
(2)键参数说明
(1)键能越大,键长越短,分子越稳定。(2)利用键能(
E
)计算Δ
H
的公式:Δ
H
=
E
(反应物)-
E
(生成物)。(3)分子晶体的熔、沸点与共价键的强弱无关,共价晶体的熔、沸点与共价键的强弱
有关。3.
离子键概念阴、阳离子通过[8]
形成的化学键形成过程
形成条件一般认为,当成键原子所属元素的电负性差值大于1.7时,原子间通常形
成离子键特征[9]
方向性和饱和性静电作用没有
概念金属中[10]
和[11]
之间存在的强烈的相互作用本质金属阳离子和自由电子之间的[12]
存在金属单质和合金特征[13]
方向性和饱和性,金属键中的电子在整个三维空间运动,属
于整块金属金属阳离子自由电子电性作用没有5.
化学键与物质类别的关系6.
电子式(1)电子式的书写类别电子式的表示方法注意事项举例原子元素符号周围标明
价电子,每个方向
不能超过2个电子价电子数少于4时以单
电子分布,多于4时多
出的部分以电子对分
布S:[14]
阳
离
子单原子离子符号右上方标明正电荷数Mg2+多原子元素符号紧邻排
列,周围标明电子
分布用“[
]”括起来,右
上方标明正电荷数
类别电子式的表示方法注意事项举例阴
离
子单原子元素符号周围合理
分布价电子及所获
电子用“[
]”括起来,右
上方标明负电荷数Cl-:[16]
多原子元素符号紧邻排
列,合理分布价电
子及所获电子相同原子不能合并,
用“[
]”括起来,右
上方标明负电荷数OH-:[17]
-
类别电子式的表示方法注意事项举例离子化合物由阳离子电子式和
阴离子电子式组成同性不相邻,离子合
理分布,相同离子不
能合并KF:[18]
共价化合物把共用电子对写在
两成键原子之间要标明未成键电子CH4:[19]
CO2:[20]
(2)用电子式表示化合物的形成过程①离子化合物,如NaCl:[21]
。②共价化合物,如HCl:[22]
。
1.
易错辨析。(1)化学键是相邻离子或原子间的强烈的作用力,既包括静电吸引力,又包括静电排
斥力。
(
√
)(2)所有物质中都存在化学键。
(
✕
)(3)所有的共价键都具有方向性。
(
✕
)(4)由金属元素与非金属元素形成的化学键都是离子键。
(
✕
)(5)非金属元素的两个原子之间形成的一定是共价键,但多个原子间也可能形成离子
键。
(
√
)(6)离子化合物中可能含有共价键,共价化合物中一定不含离子键。
(
√
)√✕✕✕√√(8)某物质熔融状态能导电,可以证明该物质内一定存在离子键。
(
✕
)(9)单质分子中一定含有非极性共价键。
(
✕
)(10)两个s轨道只能形成σ键,不能形成π键。
(
√
)(11)多原子分子中一定含有σ键,可能含有π键。
(
√
)(12)共价单键都是σ键。
(
√
)(13)共价三键中,一个是π键,另两个是σ键。
(
✕
)(14)C2H4与Cl2的加成反应只涉及π键断裂。
(
✕
)(15)N2分子中σ键与π键的数目比
n
(σ)∶
n
(π)为1∶2。
(
√
)✕✕√√√✕✕√(7)NaOH中含有离子键和共价键。
(
√
)√2.
请写出下列物质所含共价键的数目。(1)丙炔的结构简式为
,则丙炔分子中含有
个σ键和
个π键;(2)(CN)2为直线形分子,含有
个σ键和
个π键;(3)乙烷分子中含有
个σ键和
个π键;(4)乙醇分子中含有
个极性共价键,
个非极性共价键,
个σ
键,
个π键;(5)乙烯分子中含有
个σ键和
个π键。6
2
3
4
7
0
7
1
8
0
5
1
3.
F—F的键长比Cl—Cl的键长短,但F—F的键能却比Cl—Cl的键能小,原因是
。氟
原子的半径很小,两个氟原子在形成共价键时,原子核之间的距离很小,排斥力很
大4.
试从键能、键长角度解释乙烯、乙炔比乙烷活泼的原因
。
键断裂(π键的键能一般小于σ键的键能)
5.
[全国Ⅰ高考]Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间
难以形成双键或三键。从原子结构角度分析,原因是
。Ge原子半径大,原子间形成
的σ键较长,p轨道与p轨道“肩并肩”重叠程度很小或几乎不能重叠,难以形成π
键6.
下列物质中:①MgCl2;②Na2O2;③CS2;④NaOH;⑤H2;⑥Ne(1)只存在极性键的是
(填序号,下同)。(2)只存在非极性键的是
,只存在离子键的是
。(3)既存在离子键又存在极性共价键的是
,既存在离子键又存在非极性共价键
的是
。(4)不存在化学键的是
。(5)属于离子化合物的有
,其中含非极性键的离子化合物有
。③
⑤
①
④
②
⑥
①②④
②
7.
判断下列电子式书写的正误。
(4)用电子式表示MgCl2的形成过程:
(
✕
)✕✕√✕
命题点1
化学键与物质类别的关系1.
下列叙述正确的是(
D
)A.
[全国Ⅰ高考改编]KH为共价化合物B.
[全国Ⅱ高考改编]Na与N、O、Cl分别形成的化合物中只含有离子键C.
[浙江高考改编]KCl、HCl、KOH的水溶液都能导电,所以它们都属于离子化合
物D.
[浙江高考改编]N和Cl可形成共价化合物NCl3D12345[解析]
K+、H-构成KH,含离子键,属于离子化合物,A项错误。Na与N、O、Cl
分别形成的Na3N、Na2O、NaCl中只含离子键,形成的NaN3、Na2O2中既含离子键又
含共价键,B项错误。HCl属于共价化合物,C项错误。NCl3中只含共价键,属于共
价化合物,D项正确。12345命题拓展(1)下列物质中属于含有共价键的离子化合物的是(
A
)A.
Na2O2B.
H2SO4C.
CH2Cl2D.
SiCA
12345(2)下列分子中都存在极性键的一组物质是(
A
)A.
H2S、NH3、SO3B.
CO2、NH4Cl、Na2O2C.
N2、CS2、NOD.
CaO、H2O2、CH4A[解析]
H2S、NH3、SO3中都存在极性键,A项正确。Na2O2中存在离子键和非极性键,无极性键,B项错误。N2中只有非极性键,C项错误。CaO中无共价键,D项错误。12345命题点2
共价键类型的判断及共价键参数的应用2.
[2022北京]由键能数据大小,不能解释下列事实的是(
C
)化学键C—HSi—HC—OSi—OC—CSi—Si键能/(kJ·mol-1)411318799358452346222A.
稳定性:CH4>SiH4C.
熔点:CO2<SiO2D.
硬度:金刚石>晶体硅C123456[解析]键能越大越稳定,A项不符合题意;键长越短键能越大,B项不符合题意;
SiO2为共价晶体,熔点由共价键决定,CO2为分子晶体,熔点由范德华力决定,C项
符合题意;金刚石、晶体硅均为共价晶体,键能C—C>Si—Si,故硬度金刚石>晶
体硅,D项不符合题意。1234563.
(1)[2022全国甲]聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原
因
。(2)[2022湖南]富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所
示。富马酸分子中σ键与π键的数目比为
。氟的电负性较强,C—F键的键能比C—H键的键能大11∶3
[解析]
由富马酸分子的结构模型可确定其结构简式为
,由单键均为σ键,双键有1个σ键和1个π键,知该分子中σ键和π键的数目比为11∶3。123456(3)[2021河北]已知有关氮、磷的单键和三键的键能(kJ·mol-1)如下表:N—N
P—P
193946197489从能量角度看,氮以N2、而白磷以P4(结构式可表示为
)形式存在的原因是
。1个
N≡N键的键能大于3个N—N键的键能之和,而6个P—P键的键能之和大于2个P≡P键
的键能之和[解析]根据题给键能数据,知1个N≡N键的键能大于3个N—N键的键能之和,因此氮以N2的形式存在,而6个P—P键的键能之和大于2个P≡P键的键能之和,因此白磷以P4形式存在。123456命题点3
电子式的书写4.
(1)[2021上海]斜方硫和单斜硫都是常见单质,它们互为
,CS2的电
子式为
。(2)[浙江高考]CaC2是离子化合物,各原子均满足8电子稳定结构。写出CaC2的电子
式
。同素异形体
Ca2+[∶C︙︙C∶]2-
[解析]
CaC2是离子化合物,CaC2的电子式为Ca2+[∶C︙︙C∶]2-。123456(3)[浙江高考]CaCN2是离子化合物,各原子均满足8电子稳定结构,CaCN2的电子式
是
。
123456命题点4
离子键
金属键5.
(1)[2022海南]Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因
是
。(2)[2022浙江]金属氢化物是应用广泛的还原剂。KH的还原性比NaH的强,原因
是
。Cu、Zn等金属中金属键由金属阳离子和自由电子形成,自由电子在外电场作用
下可以定向移动Na+半径小于K+,Na+与H-的离子键作用强,H-更难失电子,还原性更弱
123456命题点5
大π键
②一氯乙烷(C2H5Cl)、一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长的顺
序是
,理由:C的
杂化轨道中s成分越多,形成的C—Cl键越强;
。
sp2
σ
一氯乙烷(C2H5Cl)>一氯乙烯(C2H3Cl)>一氯乙炔(C2HCl)
Cl参与形成的大π键越多,形成
的C—Cl键越强123456[解析]
①杂化轨道形成共价键时只形成σ键。②因为一氯乙烷(C2H5Cl)、一氯乙
烯(C2H3Cl)、一氯乙炔(C2HCl)分子中的碳原子的杂化方式分别是sp3、sp2、sp,由
“C的杂化轨道中s成分越多,形成的C—Cl键越强”,说明一氯乙烷(C2H5Cl)、
一氯乙烯(C2H3Cl)、一氯乙炔(C2HCl)分子中,C—Cl键长依次变短;一氯乙烯中Cl
的3p
z
轨道与C的2p
z
轨道形成3中心4电子的大π键,分析可知一氯乙炔中Cl的2个3p
轨道分别与C的2个2p轨道形成2个3中心4电子的大π键,一氯乙烷中不含大π键,因
此可推知Cl参与形成的大π键越多,形成的C—Cl键越强,对应的C—Cl键长越短。
123456
A.
2s轨道B.
2p轨道C.
sp杂化轨道D.
sp2杂化轨道D
123456考点2分子的空间结构
1.
分子的空间结构(1)价层电子对互斥模型(VSEPR模型)①价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对”(分
子中的中心原子与结合原子间的[1]
和中心原子上的[2]
)
相互排斥的结果。②中心原子的价层电子对之间尽可能远离,以使斥力最小,能量最低。
σ键电子对孤电子对③孤电子对斥力较大,孤电子对越多,斥力越强,键角越小。价层电子对之间的斥
力大小顺序:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电
子对。④价层电子对数的计算公式其中:
a
是中心原子的[3]
[阳离子要减去所带的电荷数、阴离子要加上
所带的电荷数(绝对值)];
x
为与中心原子结合的[4]
;
b
是与中心原子结
合的原子最多能接受的[5]
(氢为[6]
;其他原子为“[7]
”,如O、S、Se等氧族元素均为2;卤族元素均为1)。价电子数原子数电子数1
8减去该原
子的价电子数⑤利用价层电子对互斥模型判断分子或离子的空间结构
(2)杂化轨道理论杂化轨道理论是一种价键理论,可以解释分子的空间结构。基本要点①能量相近(同一能级组或相近能级组)的原子轨道才能参与杂化;②杂
化轨道形成σ键,形成的共价键比原有原子轨道形成的共价键更稳定;
③杂化后各轨道能量相同、方向不同;④杂化轨道总数等于参与杂化的
原子轨道数目之和,但改变了原子轨道的形状、方向,在成键时更有利
于轨道间重叠使用范围只用于形成σ键或用来容纳未参与成键的孤电子对类型
个
四面体形1个s轨道1个p轨道180°直线形1个s轨道2个p轨道120°平面三角形1个
s轨道3个p轨道109°28′正四面体形判断方法①AB
n
型分子或离子:杂化轨道数[20]
中心原子的价层电子对数
[21]
σ键电子对数[22]
中心原子上的孤电子对数。
=
=
+
spsp2sp3判断方
法②非AB
n
型分子或离子,根据杂化轨道的空间结构判断:杂化轨道的空
间结构为正四面体形,中心原子采用[26]
杂化;杂化轨道的空间
结构为平面三角形,中心原子采用[27]
杂化;杂化轨道的空间结
构为直线形,中心原子采用[28]
杂化。sp3
sp2
sp
判断方
法③根据中心原子有没有形成双键或三键判断:
sp3sp2sp(3)分子、离子的空间结构分析实例价层电子对数σ键电子对数孤电子对数中心原子杂化轨道类型VSEP
R模型分子(离
子)空间结
构CO2、BeCl2(AB2型)[32]
[33]
[34]
[35]
[36]
[37]
[38]
[39]
PbCl2、SnBr2(AB2型)[40]
[41]
[42]
[43]
2
2
0
sp
3
3
0
sp2
3
2
1
sp2
实例价层电子对数σ键电子对数孤电子对数中心原子杂化轨道类型VSEP
R模型分子(离
子)空间结
构[44]
[45]
[46]
[47]
[48]
[49]
[50]
[51]
H2O(B2A型)[52]
[53]
[54]
[55]
4
4
0
sp3
4
3
1
sp3
4
2
2
sp3
实例价层电子对数σ键电子对数孤电子对数中心原子杂化轨道类型VSEP
R模型分子(离
子)空间结
构PCl5(AB5型)[56]
[57]
[58]
sp3d
SF6(AB6型)[59]
[60]
[61]
sp3d2
5
5
0
6
6
0
2.
等电子体(1)等电子体:原子总数相等、价电子总数相等的粒子互称为等电子体。如N2与
CO、O3与SO2分别互为等电子体。等电子体具有相似的化学键特征,它们的许多性
质相近,例如CO和N2的熔、沸点等都非常相近。(2)等电子原理的应用
1.
易错辨析。(1)价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数。
(
√
)(2)价层电子对互斥模型能用来预测分子的空间结构。
(
√
)(3)杂化轨道理论能解释分子的空间结构。
(
√
)(4)杂化轨道只能用于形成σ键或容纳未参与成键的孤电子对。
(
√
)(5)sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化而成。
(
✕
)(6)分子的中心原子若通过sp3杂化轨道成键,则该分子一定为正四面体形。
(
✕
)√√√√✕✕(8)凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体形。
(
√
)(9)AB3型分子的空间结构必为平面三角形。
(
✕
)(10)H2O、CH4、CO2的键角依次减小。
(
✕
)(11)XeF2的中心原子的价层电子对数为5。
(
√
)(12)PhB(OH)2和
中B原子的价电子对数相等(—Ph代表苯基,—Pr代表异丙
基)。
(
✕
)(13)
为四角锥形结构,
中心原子I上没有孤电子对。
(
✕
)√✕✕√✕✕(7)中心原子为sp2杂化的分子,其空间结构一定为平面三角形。
(
✕
)✕2.
(1)PCl3分子中P原子的杂化轨道类型为
。(2)HOCH2CN分子中碳原子的杂化轨道类型为
。(3)丙烯腈分子(
)中碳原子的杂化轨道类型为
。(4)乙醛分子中碳原子的杂化轨道类型为
。sp3
sp3、sp
sp2、sp
sp3、sp2
3.
下列离子的VSEPR模型与离子的空间结构一致的是(
A
)
A4.
下列分子或离子的VSEPR模型为正四面体形而分子或离子的空间结构为角形的是
(
D
)B.
PH3C.
H3O+D.
OF2D5.
下列分子与O3分子的空间结构最相似的是(
C
)A.
H2OB.
CO2C.
SO2D.
BeCl2C6.
气态三氧化硫以单分子形式存在,其分子的空间结构为
形。[解析]气态SO3为单分子,分子中S原子上无孤电子对,价层电子对数为3,其分子
的空间结构为平面三角形。平面三角7.
AsCl3分子的空间结构为
,As的杂化轨道类型为
。
三角锥形sp3
8.
已知SCN-与CO2互为等电子体,则SCN-的空间结构是
,中心原子C
的杂化轨道类型是
。直线形sp
9.
Cl2O分子的空间结构为
,中心原子O的价层电子对数为
。
V形4
10.
用杂化轨道理论解释乙烯分子中的双键是不能旋转的,因而四个氢原子在一个
平面上:
。乙烯分子中的碳原子采取sp2杂化,杂化后的三个sp2杂化轨道呈平面三角
形,而剩下的未杂化的2p轨道垂直于由三个sp2杂化轨道构成的平面;每个碳原子用
两个sp2杂化轨道分别与两个氢原子的1s轨道重叠形成σ键,而每个碳原子又通过剩
下的一个sp2杂化轨道重叠形成σ键,未参与杂化的2p轨道互相重叠形成一个π键,这
种成键方式导致碳碳双键不能旋转,因为旋转会使碳原子间的p电子云不能有效重
叠,即π键被破坏,所以乙烯分子是平面形结构
命题点1
价层电子对互斥模型的应用1.
[2023湖北]价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的
是(
A
)A.
CH4和H2O的VSEPR模型均为四面体C.
CF4和SF4均为非极性分子D.
XeF2与XeO2的键角相等A1234
1234命题点2
杂化轨道类型及微粒空间结构的判断
sp2
sp3
1234(2)[2021全国甲]SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为
。
SiCl4可发生水解反应,机理如图所示。sp3
[解析]
SiCl4中Si形成4个σ键,不含孤电子对,采取sp3杂化;由题图知,中间体SiCl4(H2O)中Si共形成5个σ键,所以Si采取的杂化类型为sp3d。含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取
的杂化类型为
(填标号)。②
1234(3)[2021河北]已知KH2PO2是次磷酸的正盐,H3PO2的结构式为
,其中P采
取
杂化方式。sp3
[解析]
KH2PO2是次磷酸的正盐,则H3PO2为一元酸,H3PO2中含有1个羟基,其结构式为
或
,P形成4个σ键,无孤电子对,杂化轨道数为4,故杂化类型为sp3。1234(4)[全国Ⅲ高考]氨硼烷在催化剂作用下水解释放氢气:
sp3
sp2
12343.
[微粒空间结构的判断](1)[2023全国乙]SiCl4的空间结构为
。
正四面体形正四面体形[解析]
SiCl4分子中,1个Si与周围的4个Cl形成正四面体形结构。
1234(4)[山东高考]Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4
为无色液体,SnCl4空间结构为
。
正四面体形
(3)[全国Ⅰ高考]磷酸根离子的空间结构为
,其中P的价层电子对数
为
、杂化轨道类型为
。正四面体形4
sp3
1234命题点3
等电子体的判断及应用4.
(1)[全国Ⅲ高考]与NH3BH3原子总数相等的等电子体是
(写分子式)。
[解析]原子总数相同、价层电子总数相同的微粒互称为等电子体,与NH3BH3互
为等电子体的分子为C2H6。C2H6
CH4(或SiH4)
1234
(4)CS2分子中C原子的杂化轨道类型是
,分别写出1个与CS2具有相同空间结构
的分子和离子:
。
SiF4(或POF3)
sp
CO2、SCN-(或COS等合理答案均可)
1234技巧点拨寻找等电子体的方法方法具体阐释示例竖换
法把分子(或离子)中的某个原子换成与该原子同主族的其他元素原子
1234方法具体阐释示例横换法①把分子(或离子)中的某两个原子分别向前、向后换成相
邻主族元素原子;②把分子(或离子)中的某个原子换成相邻主族元素原子,
然后通过添加1个单位的正、负电荷使价电子总数相同
1234方法具体阐释示例综合
法把分子(或离子)中的某个原子换成其他主族元素原子,然
后通过添加正、负电荷使价电子总数相同;把电荷平均分
配给其他原子,相当于得到新的原子
1234
热点8大π键命题特点:大π键是π键概念的拓展,常以信息形式给出。大π键对应原子的杂化方
式→sp、sp2等;含大π键物质的结构特点→共面、共线。
3.
计算步骤(1)确定分子中价电子总数。(2)找出分子中的σ键以及不与π键p轨道平行的孤电子对的轨道。(3)用价电子总数减去这些σ键中的电子数和孤电子对中的电子数,剩余的就是填入
大π键的电子数。4.
示例
1.
写出下列物质含有的大π键类型。(1)C6H6(苯):
;
(4)O3:
;
123452.
吡啶(
)中含有与苯类似的大π键,可表示为
。
12345
12345
5
12345
sp2
sp2、sp3
12345
12345热点9键角大小比较命题特点:中心原子杂化类型为主,孤电子对排斥作用为辅。杂化方式→孤电子对
→结合电负性分析成键电子离中心原子的远近→不饱和键的排斥力。
1.
键角大小比较的思维模型(1)中心原子杂化方式不相同时,优先看杂化方式,键角:sp>sp2>sp3。答题模板:×××中心原子采取×××杂化,键角为×××,而×××中心原子采取×××
杂化,键角为×××。(2)中心原子杂化方式相同时,看电子对间的斥力。答题模板:
×××分子中无孤电子对,×××分子中含有
n
个孤电子对,孤电子对对
成键电子对的排斥作用较大,因而键角较小。2.
答题模板(3)空间结构相同时,看中心原子或配位原子的电负性。①中心原子不同,配位原子相同:如AC3与BC3,若电负性A>B>C,则键角AC3>
BC3。答题模板:电负性A>B>C,则AC3中成键电子对离中心原子较近,斥力较
大,键角也较大。②中心原子相同,配位原子不同:如AB3与AC3,若电负性:B>A>C,则键角AB3
<AC3。答题模板:电负性B>A>C,则AB3中成键电子对离中心原子较远,斥力
较小,因而键角较小。
1.
下列关于键角大小比较错误的是(
B
)A.
CH4>NH3>H2OB.
SO2>CO2C.
H2O>H2SB1234[解析]
A项,CH4分子中无孤电子对,NH3分子中含有1个孤电子对,H2O分子中含
有2个孤电子对,孤电子对对成键电子对的排斥作用逐渐增大,故键角逐渐减小,
正确。B项,SO2中S为sp2杂化,含1个孤电子对,SO2为V形,CO2中C为sp杂化,
CO2为直线形,故键角:SO2<CO2,错误。C项,H2O和H2S的中心原子均为sp3杂
化,孤电子对数均为2,但O的电负性大于S,成键电子对更偏向O,使得H2O中共价
键的键角大于H2S,正确。
1234
大于
采取sp3杂化,sp2杂化形成的键角大于sp3杂化1234
孤电子对有较大斥力,使H—O—H键角小于
O—S—O键角1234
[解析]
ClO2为V形结构,且存在3原子5电子的大π键,则Cl的杂化类型为sp2。sp2
>
ClO2分子中Cl—O键的键长小于Cl2O中Cl—O键的键长,其原因是
ClO2分子中既存在σ键,又存在大π键,原子轨道重叠的程度较大,因此其中Cl—O
键的键长较小,而Cl2O只存在普通的σ键12344.
NF3的键角
NH3的键角,理由是
。<
F的电负性比H大,NF3中成键电子对离中
心原子较远,斥力较小,因而键角也较小1234
1.
[2023江苏]下列说法正确的是(
A
)C.
H2O2分子中的化学键均为极性共价键D.
CaH2晶体中存在Ca与H2之间的强烈相互作用A12345
123452.
[2023浙江]下列化学用语表示正确的是(
C
)B.
碳的基态原子轨道表示式:
C.
BF3的空间结构:
(平面三角形)D.
HCl的形成过程:
C12345
123453.
[2021湖北]下列有关N、P及其化合物的说法错误的是(
A
)A.
N的电负性比P的大,可推断NCl3分子的极性比PCl3的大B.
N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高C.
NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大D.
HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低A12345[解析]
P和Cl的电负性差值比N和Cl的电负性差值大,因此PCl3分子的极性比NCl3
分子的极性大,A项错误;N与N的π键比P与P的强,故N≡N的稳定性比P≡P的高,B
项正确;N的电负性比P大,NH3中成键电子对距离N比PH3中成键电子对距离P近,
NH3中成键电子对间排斥力较大,因此NH3的键角比PH3的大,C项正确;相对分子
质量:HNO3<H3PO4,因此HNO3的分子间作用力比H3PO4的分子间作用力小,则
HNO3的熔点比H3PO4的低,D项正确。123454.
[2020山东]B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法
错误的是(
A
)A.
其熔点主要取决于所含化学键的键能B.
形成大π键的电子全部由N提供C.
分子中B和N的杂化方式相同D.
分子中所有原子共平面A12345[解析]
B3N3H6与苯的结构相似,属于分子晶体,分子晶体的熔点与分子间作用力
有关,与化学键的键能无关,A项错误;B3N3H6中每个N提供2个电子,B不提供电
子,因此形成大π键的电子全部由N提供,B项正确;由于B3N3H6和苯的结构类似,
则该分子中B和N均为sp2杂化,C项正确;由于B3N3H6和苯分子结构相似,则
B3N3H6分子中12个原子共面,D项正确。123455.
[2022湖南]铁和硒(Se)都是人体所必需的微量元素,且在医药、催化、材料等领域
有广泛应用。回答下列问题:(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:①基态Se原子的核外电子排布式为[Ar]
;②该新药分子中有
种不同化学环境的C原子;
3d104s24p4
8
>
前者中Se为sp2杂化、后者中Se为sp3杂化12345
12345
①产物中N原子的杂化轨道类型为
;
sp3
H2O
[解析]
①产物中N原子形成4个共价键,则其采取sp3杂化。12345
1.
[浙江高考]有共价键的离子化合物是(
A
)A.
Na2O2B.
H2SO4C.
CH2Cl2D.
SiC
A123456789101112132.
[2024模拟组合]下列说法错误的是(
B
)A.
[北京丰台区模拟]NH4Cl中含有离子键、共价键和配位键B.
[北京丰台区模拟]NH3和HCl中的共价键均是s-sσ键C.
[湖北宜昌联考]CH3COOH分子中σ键和π键的数目之比为7∶1D.
[吉林模拟]NaClO中既含有离子键又含有共价键B12345678910111213
123456789101112133.
[2024贵阳等模拟改编]下列有关化学用语表达正确的是(
C
)A.
氨的电子式:
B.
醛基的电子式:
C.
NH5的电子式:
C12345678910111213
123456789101112134.
[2024模拟组合]下列化学用语错误的是(
C
)B.
[贵阳摸底]H2O的VSEPR模型:
C.
[浙江名校联考]OF2分子的空间结构为直线形C12345678910111213
123456789101112135.
[2024南京六校联考]下列说法正确的是(
A
)A.
14N、15N都属于氮元素B.
NH3和H2O的中心原子轨道杂化类型均为sp2C.
N2H4分子中的化学键均为极性共价键D.
CaCl2晶体中存在Ca与Cl2之间强烈的相互作用[解析]
14N和15N是氮元素的不同核素,A正确;NH3和H2O的中心原子轨道杂化类
型均为sp3,B错误;N2H4分子中存在N—N非极性键,C错误;CaCl2由Ca2+和Cl-组
成,其晶体中存在的是Ca2+与Cl-之间的强烈相互作用,D错误。A123456789101112136.
[2023广东六校联考改编]由徐光宪院士发起院士学子同创的《分子共和国》科普
读物生动形象地戏说了BF3、NH3、O3、SOCl2等众多“分子共和国”中的明星。下
列说法正确的是(
A
)A.
BF3中心原子为sp2杂化B.
BF3和NH3都属于非极性分子C.
所有分子都只存在σ键,不存在π键D.
O3分子的空间结构为直线形A12345678910111213
123456789101112137.
[2023鄂东南省级示范高中联考]下列有关说法错误的是(
A
)A.
Fe(CO)5中O提供孤电子对与Fe的空轨道形成配位键B.
O的电负性大于S,可推断H2O的键角大于H2S的键角C.
因为存在分子间氢键,可以形成缔合分子(H2O)
n
、(HF)
n
D.
向Fe(SCN)3溶液中滴加NaF溶液,红色褪去,说明F-与Fe3+的结合能力更强A12345678910111213[解析]
O的电负性大于C,C对孤电子对的吸引力更小,CO中由C提供孤电子对与
Fe的空轨道形成配位键,A项错误;电负性O>S,使得H2O中成键电子对间的斥力
更大,键角更大,B项正确;分子间依靠氢键结合,不引起化学性质变化的现象叫
氢键缔合,H2O、HF分子间均存在氢键,可分别形成缔合分子(H2O)
n
、(HF)
n
,C项
正确;向Fe(SCN)3溶液中滴加NaF溶液,红色褪去,说明F-与Fe3+的结合能力更
强,D项正确。123456789101112138.
(1)CO2分子中的C原子采取
杂化,分子的结构式为
,空间结构
呈
。
(2)HCHO中的C原子采取
杂化,分子的结构式为
,空间结构
呈
。[解析]
HCHO中C原子与2个H原子形成2个σ键,与O原子形成1个σ键和1个π键,
无孤电子对,故中心原子的杂化轨道数为3,采取sp2杂化,分子的空间结构为平面
三角形。sp
直线形sp2
平面三角形12345678910111213(3)H2S分子中的S原子采取
杂化,分子的结构式为
,空间结构
呈
。
sp3
V形12345678910111213
Si原子比C原子半径大,
Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成稳定的π键12345678910111213化学键键能/(kJ·mol-1)F—F157Cl—Cl242.7Br—Br193.7请解释其中Br—Br键键能介于F—F键和Cl—Cl键键能之间的原因
。F—F键之间由于
F原子的半径小,成键时外层电子之间的斥力增加,使其键能下降,而Cl—Cl键键长
小于Br—Br键键长,故键能更大(2)[2023昆明模拟]键长越短,往往键能越大,表明共价键越稳定。卤素单质的键能
数据如表。12345678910111213(3)[2023湖南六校模拟]已知:[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 法院司法调解协议书范本
- 汉沽区劳务派遣合同范本
- 火锅店长期员工合同协议
- 职工交通事故死亡协议书
- 用木桩护坡施工合同范本
- 海城农村房屋继承协议书
- 物流服务运输合同协议书
- 锁具维修合同协议书模板
- 爆破工程联营合同协议书
- 私人租地建养殖合同范本
- 2025年智能安全帽项目规划申请报告
- 济南海川小升初数学试卷
- 2025年苏州昆山国创投资集团有限公司招聘考试试题(含答案)
- 电力调度员培训课件
- 超声诊断在主动脉夹层中的应用
- 2025年高考真题-生物(河南卷) 含解析
- 加油站消防安全知识培训
- 2025年中小学公开选拔校长笔试模拟试卷
- 垂钓大赛活动方案
- 5G-A通感一体测评方法白皮书 2025
- 中文版儿童睡眠习惯问卷CSHQ 含评分维度

评论
0/150
提交评论