



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
四川雅安市2020-2022三年高一化学下学期期末试题汇编
3-非选择题
1.(2020春•四川雅安•高一统考期末)由A、B、C、D四种金属按下表中装置进行实
验。
甲乙内
W0
装置HW眠[
稀或酸CuSO*幡硫赧
现象金属A不断溶解C的质量增加A上有气体产生
根据实验现象回答下列问题:
⑴装置甲中作正极的是(填"A"或"B")。
(2)装置乙溶液中C电极反应式为—o
⑶装置丙中金属A上电极反应属于(填"氧化反应"或"还原反应")。
⑷四种金属活动性由强到弱的顺序是—o
2.(2020春•四川雅安•高一统考期末)某同学要以"研究苯分子的结构”为题做探究活
动,下面是其活动记录,请你补全所缺内容(回答本题时有机物用结构简式表示)。
⑴理论推测:他根据苯的凯库勒式—,推测苯分子中有两种不同的碳碳键,即—
和—,因此它能使紫色的酸性KMnO4溶液褪色。
(2)实验验证:他取少量紫色的酸性KMno4溶液加入试管中,然后加入苯,充分振荡,
观察到的现象是一。
⑶实验结论:上述理论推测—(填"正确"或"错误")。
⑷查阅资料:苯分子中六个碳原子之间的键相同,是一种特殊的共价键,苯分子中的六
个碳原子和六个氢原子在同一个平面上,应该用—表示苯分子的结构更合理。
⑸发现问题:当他将苯加入溟水中时,充分振荡,发现澳水层颜色变浅,于是该同学认
为所查资料有误。你同意他的结论吗—(填"同意"或"不同意”)。理由是—。
⑹拓展:将苯、液溪和铁粉混合发生反应的化学方程式是—;反应类型是—。
3.(2020春•四川雅安・高一统考期末)煤是一种常用的燃料。由于煤燃烧产生的废气
中含有Se)2、Ne)2和Nc)等多种有害气体和烟尘会对环境造成污染,因此需要对煤
进行加工后再燃烧,或将废气净化后再排放。
⑴将生产的煤直接进行燃烧,造成环境污染之一是形成硝酸型酸雨。以下是对硝酸型酸
雨的评价,其中正确的是―(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生态系统
b.对电线、铁轨、桥梁、房屋等均会造成损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图:
【石膏(CaSo4-2%同
请回答下列问题。
①脱硫以后,在废气中含量明显增加的气体是—(写化学式),它对环境的负面影响是
②检验脱硫后废气中是否含有SO2的简单方法是一。
③写出在废气脱硫并形成副产物(CaSθ4∙2H2θ)的过程中所发生主要反应的化学方程式
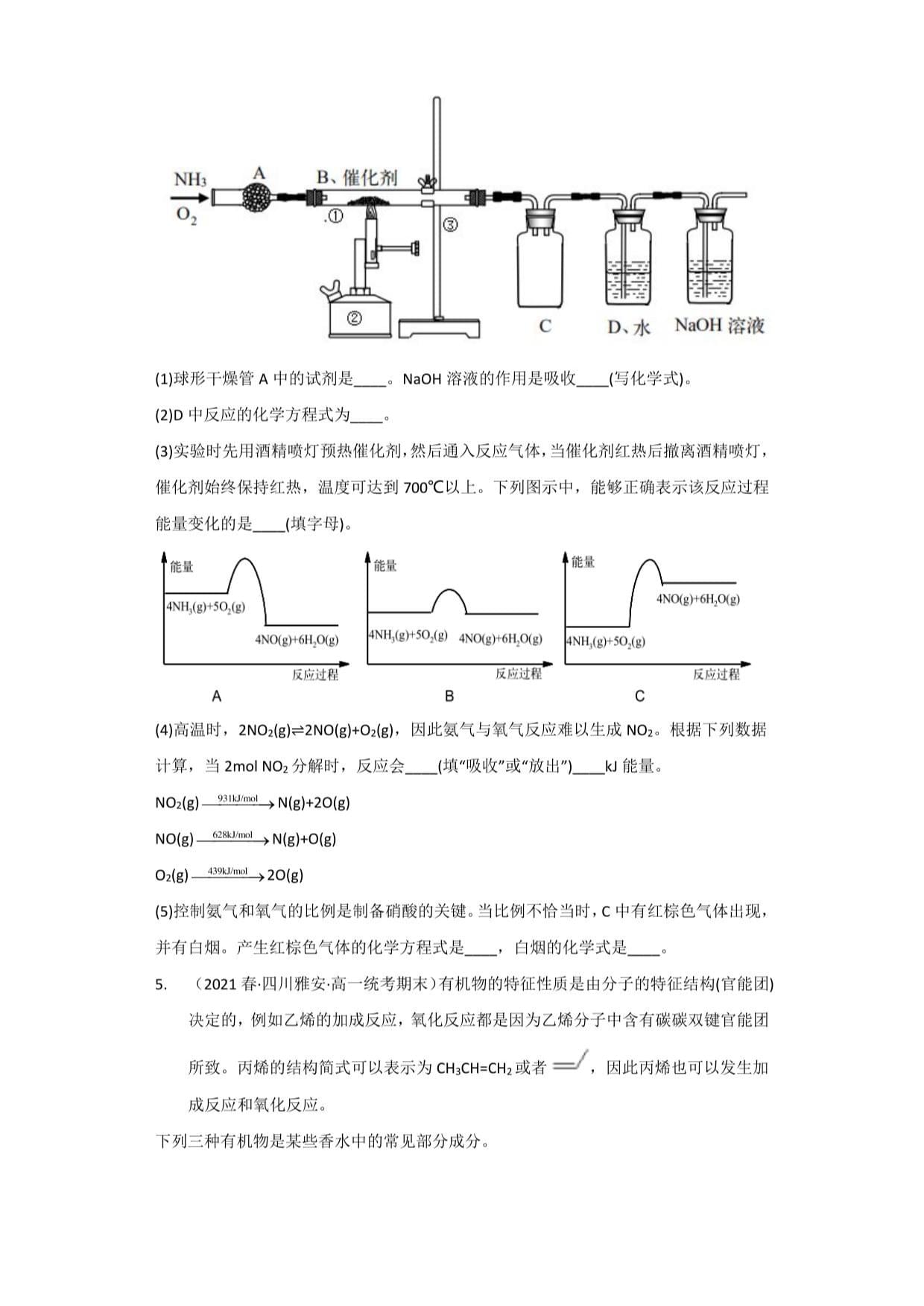
4.(2020春•四川雅安•高一统考期末)某探究学习小组利用如图装置模拟工业生产制
备少量硝酸。
⑴球形干燥管A中的试剂是一。NaOH溶液的作用是吸收—(写化学式)。
(2)D中反应的化学方程式为—o
⑶实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,
催化剂始终保持红热,温度可达到700°C以上。下列图示中,能够正确表示该反应过程
'能量
C
4NH,(g)+5O,(g)4NO(g)+6H,O(g)
反应过程
B
⑷高温时,2N02(g)=2N0(g)+02(g),因此氨气与氧气反应难以生成NO2。根据下列数据
计算,当2molN5分解时,反应会(填"吸收"或"放出")kJ能量。
NO2(g)—空出咧→N(g)+20(g)
NO(g)3⅛o∣>N(g)+O(g)
6(g)20(g)
(5)控制氨气和氧气的比例是制备硝酸的关键。当比例不恰当时,C中有红棕色气体出现,
并有白烟。产生红棕色气体的化学方程式是一,白烟的化学式是—。
5.(2021春•四川雅安•高一统考期末)有机物的特征性质是由分子的特征结构(官能团)
决定的,例如乙烯的加成反应,氧化反应都是因为乙烯分子中含有碳碳双键官能团
所致。丙烯的结构简式可以表示为CH3CH=CH2或者=/,因此丙烯也可以发生加
成反应和氧化反应。
下列三种有机物是某些香水中的常见部分成分。
月桂川柠0■百叶IS
⑴月桂烯的分子式是。Imol月桂烯最多能够跟molBr2发生加成反应。月
桂烯的一氯取代物有种。
(2)柠檬醛和香叶醇是否是同分异构体(填"是"或"否"),理由是。
⑶香叶醇含有的官能团是(填写官能团名称)。下列物质能与香叶醇发生反应
的是(填字母代号)。
A.酸性KMnO4溶液B.Br2∕CCI4C.NaD.NaOHE.NaHCO3
6.(2022春•四川雅安・高一统考期末)硫有多种化合物,如H?S、SO?等,它们对环
境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经
济效益。
⑴有学者提出利用Fe"、Fe?+等离子的作用,在常温下将S02氧化成SO:而实现SO泮q
回收利用,写出Fe3+将S0?氧化成SO:反应的离子方程式
⑵含有Fe?+、Fe“的硫酸盐混合溶液可用于吸收H?S回收硫单质,其转化关系如图所
示。其中反应①中作氧化剂的是(填离子符号或化学式),该图示中总反应
的化学方程式为。
⑶某企业利用下列流程综合处理工厂排放的含S0?的烟气,以减少其对环境造成的污
染。"SO?吸收塔"中发生反应的化学方程式为,该流程中可循环利用的物质
为(填化学式)。
用气达标排放(NHjsOM裱
.IJ]__
含SO?的尾气fS%吸收塔NHj吸收X-NH1
--------L⅝~
NHJHSO描液
⑷生产过程中的尾气需要测定SOz的含量符合标准才能排放。已知有VL(已换算成标准
状况)尾气,通入足量HQ?溶液吸收再加入足量BaCI2溶液充分反应后(不考虑尾气中其
它成分的反应),过滤,洗涤、干燥、称量得到bg沉淀。H2O2溶液的作用是;
尾气中S0?含量(体积分数)的计算式是(用含Kb的代数式表示)。
7.(2021春•四川雅安•高一统考期末)某实验小组用下列装置进行乙醇催化氧化的实
验。已知:乙醛可被氧化为乙酸。
⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式o
⑵在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化氧化反
应是(填"放热"或"吸热")反应。进一步研究表明,鼓入空气的速率与反应体系
的温度关系曲线如下图所示。试解释出现图中现象的原因。
⑶甲和乙两个水浴作用不相同。甲的作用是;乙的作用是o
⑷若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有
o要除去该物质,可在混合液中加入(填写字母)。
A.氯化钠溶液B.苯
C.碳酸氢钠溶液D.四氯化碳
然后,再通过(填实验操作名称)即可除去。
8.(2021春,四川雅安•高一统考期末)海带中含有丰富的碘,为了从海带中提取碘,
某研究性学习小组设计并进行了如图所示的实验:
请回答下列问题:
⑴实验时灼烧海带应在(填仪器名称)内进行。
(2)步骤④中反应的离子方程式是o
⑶步骤⑤中选用的溶剂X可以是(填试剂名称)。
⑷上述流程中的实验操作包括下列选项中(按操作顺序选填代号)。
A.过滤B.蒸发C.蒸馆D.分液
⑸请设计一个简单的实验方案,检验步骤⑤提取碘后的溶液中是否还含有单质碘
9.(2020春•四川雅安・高一统考期末)A、B、C、D、E是核电荷数依次增大的五种短
周期主族元素。A元素的原子核内只有1个质子;B元素的原子半径是其所在主族
中最小的,B的最高价氧化物对应的水化物的化学式为HBo3;C元素原子的最外层
电子数比次外层电子数多4个;C的阴离子与D的阳离子具有相同的电子排布,两
元素可形成化合物D2C;C、E元素同主族。
(I)B在元素周期表中的位置是一。
(2)E元素形成的最高价氧化物对应的水化物的化学式为—,由C、D、E三种元素形成
的离子化合物的化学式为—。
(3)C、D、E形成的简单离子的半径由大到小顺序是—(用离子符号表示)。
⑷用电子式表示化合物DzE的形成过程,化合物D2C2中的化学键类型是一。
⑸过量ECz与DCA溶液反应的离子方程式c
10.(2021春•四川雅安・高一统考期末)短周期中的A、B、C、D四种元素,原子序数
依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电
子层结构,两元素的单质在不同条件下反应生成一种淡黄色的固体E或白色固体F:
D元素的单质为黄绿色气体。
⑴元素D的原子结构示意图为;它在周期表中的位置是周期族。
(2)D元素的最高价氧化物对应的水化物与C的最高价氧化物对应水化物在水溶液中反应
的离子方程式为。
(3)F属于(离子、共价)化合物,F的电子式表示为。
⑷在E与水的反应中,反应物的总能量______生成物的总能量(填"高于"、"低于"、"等
于"),生成的化合物中的化学键含有(填"离子键"、"极性键"、"非极性键”),该反
应的化学方程式为o
⑸写出AB2分子的结构式,AB2与C的最高价氧化物对应水化物以物质的量之
比按1:1在溶液中进行反应的离子方程式为。
11.(2022春,四川雅安•高一统考期末)X、Y、Z、R为短周期主族元素,X为原子半径
最大的短周期元素,Y的气态氢化物与其最高价氧化物对应的水化物可反应生成离
子化合物,Z元素的单质为淡黄色固体,R与Z同周期,R的最低负价和最高正价
分别为-1,+7,另有元素W,其原子序数为34。
⑴元素W在周期表中位置为,原子结构示意图为。
(2)X、Y、Z、R元素形成的四种简单离子半径由大到小顺序为(用离子符号表
示)。
(3)Y的气态氢化物可与R的单质反应产生臼烟,该反应的化学方程式为,Y
的某种氢化物电子数目为18,该氢化物的电子式为o
⑷设计一个简单可行的实验方案验证Z与R的非金属性强弱o
12.(2021春•四川雅安•高一统考期末)含有不同价态硫元素的物质之间的转化在工业
生产中具有重要的应用。
⑴硫酸是重要的基础化工原料,可用于生产化肥、农药、炸药、染料和盐类等。工业生
产硫酸的流程图如下:
98%硫酸
含SO,的废气
①工业上常以黄铁矿(FeSz)为原料来制备SO2,配平该反应的化学方程式
高温
FeS2+。2==_____Fe2O3+SO2
②写出催化反应室中SO2被氧化为SO3的化学方程式。
③硫酸工业的尾气中含有少量S02,若直接排放会污染空气,并导致硫酸型酸雨。下列
物质中,能吸收SCh的有(填字母)。
A.氨水B.酸性KMnC)4溶液C.生石灰D.Na2CO3溶液
⑵石油加氢精制和天然气净化等过程产生有毒的H2S,直接排放会污染空气。工业上用
克劳斯工艺处理含HzS的尾气,并获得硫单质,流程如下:
含H2S的尾气、
空气
①反应炉中发生反应:2H2S+3O2≡2SO2+2H2O
②催化转化器中发生反应的化学方程式。
③为了提高WS转化为S的比例,理论上应控制反应炉中H2S的转化率为(填字母)。
K转化率=反应的"⑷/起始的n(A)l∖
A.V3B.1/2C.羽D.1
13.(2022春•四川雅安•高一统考期末)紫菜和海带都是富含生物碘的海洋植物,以下
为某兴趣小组模拟从紫菜提取碘单质的过程:
⑴为了充分浸取紫菜灰中的碘元素,可采用的方法是。(写两点)
(2)加入双氧水和稀硫酸后发生反应的离子方程式是。
⑶操作①的名称是,操作②应在(填仪器名称)中振荡、静置;
试剂A可选用下列物质中的(填正确K答案D标号)。
A.乙醇B.CCl4C.NaOHD.环己烯
⑷该方案采用常压蒸储并不合理,理由是。
14.(2022春•四川雅安•高一统考期末)有机物分子的结构表示有多种方式。例如丙烯
的结构简式可以表示为CHSH=CH?,键线式结构表示为_/0我国是薄荷的
种植大国,由薄荷生产的薄荷脑、薄荷油等在国际上享有盛誉,被称为"亚洲之香"。
薄荷中含多种化学成分,其中三种分子的键线式结构如下:
ABC
请回答下列问题:
⑴有机物A的分子式是。A的一漠代物有种。
⑵有机物B的官能团名称为,ImoIB最多能够跟molBr2/CCl4
溶液发生__________(填反应类型)。
⑶有机物C在硫酸作用下发生水解反应,该反应的化学方程式是O
⑷如果一个碳原子连接有四个不同的原子(原子团),则该碳原子称为"手性碳原子”,有
机物B分子中有个手性碳原子。
15.(2022春•四川雅安•高一统考期末)对化学反应原理的研究能让我们更加深刻地认
识化学反应,也是化学中最有魅力和挑战性的领域,依据所学的化学反应原理知识
和题干信息回答下列问题:
I面对气候变化,我国承诺二氧化碳排放力争2030年前达到峰值,力争2060年前实现
碳中和。"碳达峰、碳中和"目标下,必须加强对二氧化碳资源开发利用的研究。
⑴往容积为2L的恒容密闭容器中通入2mo∣CC>2和6mo∣H2,一定温度下发生反应:
2CO2(g)+6H2(g)CH,OCH,(g)+3H,θ(g),20min时达到化学平衡状态,测得水蒸
气的物质的量为2mol,前20min内,用H?表示该反应的平均反应速率为
mol∙I7'∙minl,Co?的平衡转化率α(CO?)=%(保留一位小
数)。K注:转化率等于反应物消耗的物质的量与反应物初始的物质的量之比。』
⑵一种CO?电化学制甲酸的装置如图所示,电极a为极(填"正"或"负"),写
Il.催化剂的研究是化学反应原理中一个重要领域,催化剂往往是化学工业过程和技术
改造更新的关键。化学反应中的活化能会显著影响化学反应速率,活化能越低,化学反
应速率越快。催化剂能加快化学反应速率是因为它能改变反应的路径,降低反应的活化
能。
⑶CO?与CH4经催化重整,制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g)o反应
中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如
下表:
积碳反应消碳反应
CH4(g)=C(s)+2H2(g)CO2(g)=C(s)+2CO(g)
催化
3391
剂
活性能X
/kJ∙moΓl
催化
4372
剂Y
由上表判断,催化剂XY(填“优于"或"劣于"),理由是。
⑷催化剂的存在会显著地加快HQ?的分解,某兴趣小组研究「催化分解HQ?历程如
下:
第一步:乩0?+1=。+凡0(慢反应)
第二步:(快反应)
反应的活化能较大的为第步(填"一"或"二"),第二步反应的离子方程式为
高中期末考试/复习精品试卷
一■■■■参*考*答*案■■■■—:
1.BCu2++2e^=Cu还原反应D>A>B>C
K祥解》根据构成原电池的条件和工作原理进行分析;
K详析11⑴图甲中金属A不断溶解,根据原电池工作原理,A应为负极,B应为正极;
(2)装置乙中C的质量增加,C为正极,B为负极,电极反应式为CM++2e=Cu;
⑶装置A上有气体产生,电极反应式为2H'+2e-=Hz个,A为正极,发生还原反应,则D为
负极;
⑷根据构成原电池的条件,一般金属性强的作负极,综上所述,金属性强弱顺序是D>A>B>Co
Kr点石成金D负极的判断,①根据电子流向,电子从负极流向正极;②电流的方向,电
流从正极流向负极;③一般负极失去电子,质量减少;④离子移动方向,阳离子向正极移
动,阴离子向负极移动;⑤化合价升高的一极为负极。
2.碳碳单键碳碳双键液体分层,溶液紫色不消失错
误◎不同意由于苯是一种有机溶剂且不溶于水,而滨单质在苯中的溶解度
比其在水中的大许多,故将苯与滨水混合振荡时,苯将溪单质从其水溶液中萃取出来,
从而使溟水褪色,与此同时,苯层颜色加深U,+BHFe/+HBr取
代反应
K详析》⑴苯的凯库勒式为'',可直观的得出苯中的化学键分两种,即碳碳单键和
碳碳双键,而如果含有碳碳双键,则能被紫色高锯酸钾溶液氧化而使高镐酸钾溶液褪色;
⑵在高锌酸钾溶液中加入苯,苯不能被高镒酸钾氧化,故发现高镒酸钾溶液不褪色,又因
为苯不溶于水,所以液体会分层;
⑶由于苯并不能使高锯酸钾褪色,说明苯中无碳碳双键,故不是单双键交替结构,故说明
上面的理论推测是错误的;
⑷苯中的键不是单双键交替的结构,而是介于单双键之间的特殊的键,故苯中的六条键完
全相同,故应该用∖Q∕表示苯的结构更合适;
⑸由于苯是一种有机溶剂且不溶于水,而澳单质在苯中的溶解度比其在水中的大许多,故
将苯与澳水混合振荡时,苯将溪单质从其水溶液中萃取出来,从而使滨水褪色,与此同时,
苯层颜色加深,因此将苯加入澳水中时会发生萃取导致溟水褪色;
高中期末考试/复习精品试卷
⑹将苯、液溟和铁粉混合发生反应的化学方程式是Fe+HBr;反应
类型是取代反应。
3.abd二氧化碳造成温室效应将待检测气体通入品红溶液(或将湿润的品红试
纸接近废气),若品红溶液褪色,则证明废气中含SO22SO2+2CaCO3+O2+
4H20=2CaS04∙2H20+2C02
K祥解Il(1)根据硝酸的酸性和强氧化性进行解答;
(2)脱硫过程是S02溶于水生成H2SO3,且酸性比碳酸强,故可以和CaCo3反应生成C02
和CaS03,CaSS在空气中不稳定,很容易转化为CaSO4,进而形成副产物石膏CaSo“2出。,
反应生成Cθ2,CO2会导致温室效应;SCh的检验可以利用品红的漂白原理解答。
K详析》(l)a∙硝酸是强酸,具有强氧化性,能杀死水中的浮游生物,减少鱼类食物的来
源,破坏水生生态系统,a正确;
b.硝酸具有酸性,电线,铁轨,桥梁,含有金属铁等,它们能和硝酸反应,房屋含有金属
和硅酸盐,它们也能和硝酸反应,b正确;
C.导致臭氧层空洞的是氟氯烧,不是硝酸,C错误;
d.硝酸中含有氮元素,硝酸与土壤中的矿物质发生作用转化为硝酸盐,可向植物提供氮肥,
d正确;
故K答案U为:abd;
(2)①由脱硫流程图可知,脱硫过程是S02溶于水生成WS03,且酸性比碳酸强,故可以
和CaCO3反应生成CS,故导致脱硫后的尾气中C02的含量明显增加,C02会导致温室效应,
故K答案》为:C5;使温室效应加剧:
②利用二氧化硫能使品红溶液褪色这一漂白性的特性,可以检验气体中有无S02,故K答
案》为:将待检测气体通入品红溶液(或将湿润的品红试纸接近废气),若品红溶液褪色,
则证明废气中含S6;
③由脱硫流程图可知,脱硫过程是S5溶于水生成H2SO3,且酸性比碳酸强,故可以和CaCO3
反应生成C02和CaSo3,CaSθ3在空气中不稳定,很容易转化为CaS。,,进而形成副产物石膏
CaSO4∙2H2O,根据氧化还原反应的规律可以写出该过程的总反应式为:2SO2+2CaCO3+O2+
4H20=2CaS04∙2H20+2C02.故K答案Il为:2SCh+2CaCCh+Ch+4H2θ=2CaSC>4∙2H2θ+2Cθ2°
4.碱石灰NO⅛NO23NO2+H2O=2HNO3+NOA吸
收113kJ2NO+O2=2NO2NH4NO3
高中期末考试/复习精品试卷
K祥解H工业生产制备少量硝酸原理:4NH+5O≈=4NO+6HO,2NO+O=2NO2,
32海温22
3NO2+H2O=2HNO3+NO;试管中发生氨的催化氧化生成NO,第一瓶试剂瓶中NO进一步被氧
气氧化生成二氧化氮,第二瓶试剂瓶中二氧化氮与水反应生成硝酸,第三瓶试剂瓶中用氢氧
化钠溶液吸收氮的氧化物,防止污染空气;
K详析2⑴氨气是碱性气体,可用碱石灰干燥,用氢氧化钠溶液吸收氮的氧化物,防止污
染空气,故K答案Il为:碱石灰;NC)和N5;
(2)D中装的是水,二氧化氮与水反应生成硝酸,反应的化学方程式为3NO2+H2O=2HNO3+NO,
故K答案H为:3NO2+H2O=2HNO3+NO;
⑶反应为放热反应,放出大量的热,反应物的总能量比生成物的总能量高,700°C时水是气
体,故K答案』为:A;
(4)∆H=反应物的键能和-生成物的键能和=93:LkJ∕mo∣χ2-628kJ∕mo∣χ2-493kJ∕mol=+113kJ∕mol,
故K答案H为:吸收;113kJ;
⑸产生红棕色气体是因为一氧化氮与氧气反应生成二氧化氮,化学方程式为:
2NO+O2=2NO2;二氧化氮与水反应生成硝酸,氨气和硝酸能反应生成硝酸镂,因而产生白烟,
白烟的化学式是NH4NO3,故K答案H为:2NO+O2=2NO2;NH4NO3O
5.C10Hi637否分子式不同羟基,碳碳双键ABC
K详析》⑴月桂烯的结构式为:,分子式是ClOHl6。ImOl月桂烯最多能够跟3molBr2
发生加成反应因为一分子月桂烯含有3个双键。月桂烯的一氯取代物有7种
⑵柠檬醛和香叶醇不是同分异构体,理由是分子式不同。
⑶香叶醇的结构式为:,含有的官能团是:羟基,碳碳双键。含有双键可以
使酸性KMno4溶液褪色,可以与澳加成,含有羟基可以与钠反应,故选ABC。
高中期末考试/复习精品试卷
3++
6.(1)2Fe+SO2+2H2O=2Fe"+SO:+4H
催化剂
3+
⑵Fe2H2S+O,2H20+2SΦ
(3)SO2+(NH4)ɔSO3+2H2O=2NH4HSO3(NH4)1SO3⅛NH4HSO3
(4)将SO2氧化为HzSO,Il岑XIoo%
K解析Il(I)Fe3+将S02氧化成,Fe3+被还原为Fe?+,根据电子守恒、电荷守和和质量守恒
3+2++
写出该反应的离子方程式为:2Fe+SO2+2H2O=2Fe+SO;+4H0
2+
(2)从图中可以看出,反应①中发生的是Fe?+和H2S的反应,在反应中,Fe?+被还原为Fe,
所以Fe3+做氧化剂;该图示中,反应物是KS和氧气,生成物是S和水,总反应的化学方程
催化剂I
式为:2H2S+O22H20+2SJ。
(3)用亚硫酸镂溶液吸收尾气中的S02,生成NH4HSC)3,化学方程式为:
SO2+(NH,I)2SO3+2H2O=2NH11HSO,o从流程图中可以看出,从吸收塔中出来的NH4HSO3
可以吸收氨气,吸收了氨气生成的(NH4降。3可以再次吸收二氧化硫,吸收了二氧化硫生成
的NH4HSO3可以再被用来吸收氨气,所以可以循环利用的物质为(NHjSo3和NHjHSO-
(4)二氧化硫和或。2反应生成硫酸,硫酸和BaCL反应生成硫酸钢沉淀,根据沉淀的质量
可以计算尾气中S5的含量,所以出。2的作用是将S02氧化为硫酸;BaSo4的质量为bg,物
质的量为言mol,根据硫元素守恒,S5的物质的量也是募mol,标况下的体积为
则尾气中so2的体积分数为Il笨XIOo%。
7.2CU+O2^→2CUO;CH3CH2OH+CuO^→CH3CHO+Cu+H2O放热流速过快的气
体将体系中的热量带走加热乙醉,便于乙醵的挥发冷却,便于乙醛的收集乙
酸C蒸储
"羊解1⑴乙醇的催化氧化反应实质是:金属铜被氧气氧化为氧化铜,氧化铜将乙醇氧化
为乙醛,金属铜起催化剂作用;
(2)反应放的热可以部分代替酒精灯加热,根据图示曲线的变化来分析;
⑶热水浴和冷水浴的作用是不同的;
高中期末考试/复习精品试卷
⑷能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应。
K详析H⑴乙醇的催化氧化反应实质是:金属铜被氧气氧化为氧化铜,反应方程式为:
2Cu+5J÷2CuO,氧化铜将乙爵氧化为乙醛,方程式为:
CH3CH2OH+CUO^→CH3CHO+CU+H2O;
(2)熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是放热反应,根据图示的曲线:
反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,
但是过量的气体会将体系中的热量带走,所以后阶段温度降低;
⑶甲和乙两个水浴作用不相同,甲是热水浴,作用是使乙醇平稳气化成乙醇蒸气,乙是冷
水浴,目的是将乙醛冷却下来,便于乙醛的收集;
⑷若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,
四个选择K答案》中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,故合
理选项是C;实现两种互溶物质的分离用蒸储法。
+
8.用蜗2Γ+H2O2+2K=I2+2H2O苯(或四氯化碳)ADC取少量溶液于试管中,
滴入2〜3滴淀粉溶液,如果溶液变蓝,说明溶液中还有碘;如果溶液不变蓝,说明溶
液中没有碘
K样解》将海带在生烟中灼烧得到海带灰,将海带灰溶解、过滤得到滤液,滤液中含有碘
离子,在酸性条件下,双氧水将碘离子氧化生成碘,然后用有机溶剂萃取碘,最后采用蒸储
方法得到有机溶剂和碘晶体,据此分析解题。
K详析2⑴根据仪器的作用选取合适的仪器,通过以上分析知,灼烧海带的仪器是生堪;
故K答案1为:坦蜗;
(2)步骤④是酸性条件下,双氧水能氧化碘离子生成碘,离子方程式为:2「+H25+2H+=l2
+2H2O;
+
故K答案』为:2Γ+H2O2+2H=I2+2H2O;
(3)骤⑤是在含碘单质的溶液中加入萃取剂萃取碘单质分液提取,溶剂X为萃取剂可以是苯
或四氯化碳:
故K答案』为:苯或四氯化碳;
⑷上述流程中涉及的实验操作有灼烧、溶解、过滤、萃取、蒸储,所以其操作顺序是ADC;
故K答案H为:ADC;
⑸碘遇淀粉试液变蓝色,可以用淀粉试液检验碘单质,其检验方法为取少量溶液于试管中,
滴入2〜3滴淀粉溶液,如果溶液变蓝,说明溶液中还有碘;如果溶液不变蓝,说明溶液中
高中期末考试/复习精品试卷
没有碘;
故K答案』为:取少量溶液于试管中,滴入2〜3滴淀粉溶液,如果溶液变蓝,说明溶液中
还有碘;如果溶液不变蓝,说明溶液中没有碘。
22
9.第二周期第VA族H2SO4Na2SO3>Na2SO4S>O>
Na+Na硒SGNa—*Na+[:Sj]2^Na+离子键、非极性键(或共价键)SO2+OH
=HS
K祥解XA、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内
只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最
高化合价为+5价,位于周期表第VA族,B元素的原子半径是其所在主族中最小的,应为N
元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,
应为。元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物DzC,则
D的化合价为+1价,D为Na元素;C、E主族,则E为S元素。
R详析IJ(I)B元素为N元素,位于元素周期表第二周期VA族:
(2)E为S元素,最高价为+6,最高价氧化物对应水化物为H2SO4;由C、D、E三种元素分别
为0、Na,S,形成的离子化合物的化学式为Na2SC>3∖Na2SO4;
(3)C、D、E形成的简单离子分别为。2-、Na∖S2-,同主族元素,从上到下离子半径依次增大,
电子层结构相同的离子,随核电荷数增大,离子半径依次减小,则离子半径的大小关系是
S2->O2>Na+,故K答案D为S*>02->Na+;
(4)D为Na元素,E为S元素,NazS为共价化合物,用电子式表示NazS的形成过程为
Na篇过GNafNa+[:S:]"Na+.l.,l,“1,14.._人士隹”
"•,化合物D2C2为Na2O2,Na2C)2为离子化合物,含有离子
键和非极性键(或共价键);
(5)EC2为Sθ2,DCA为NaOH,过量SOz与NaoH溶液反应的离子方程式为SO2+。H=HSO-
离子∣
3V∏AH÷+OH-H2Ott*∙NJr高于离
子键、极性键2Na2O2+2H2O=4NaOH+O2φO=C=OCO2+OH-HCO3
K祥解》短周期中的A、B、C、D四种元素,原子序数依次增大,B的阴离子和C的阳离
子具有相同的电子层结构,两元素的单质在不同条件下反应生成一种淡黄色的固体E或白色
高中期末考试/复习精品试卷
固体F,则B是。元素、C是Na元素;E是Na2O2,F是Na2O;D元素的单质为黄绿色气体,
D是Cl元素;A原子的最外层上有4个电子,A是C元素。
^17)2S7
7
K详析D⑴D是Cl元素,Cl原子核外有17个电子,原子结构示意图为‘√i它在周
期表中的位置是第3周期VIIA族。
(2)CI元素的最高价氧化物对应的水化物是HClO4,Na元素的最高价氧化物对应水化物是
+
NaOH,HCle)4、NaOH在水溶液中反应生成高氯酸钠和水,反应的离子方程式为H+0H=H20;
⑶F是Na2。属于离子化合物,NazO的电子式表示为.
⑷E是Na2O2,Na2O2与水反应生成氢氧化钠和氧气,反应放热,反应物的总能量高于生成
物的总能量,氢氧化钠是离子化合物,含有的化学键含有离子键、极性键,该反应的化学方
程式为2Na2O2+2H2O=4NaOH+O2个;
⑸AB2是C02,82分子的结构式是。=C=O,C02与Nac)H以物质的量之比按1:1反应生成
碳酸氢钠,反应的离子方程式为CC)2+0H-=HCoI,。
11.(1)第四周期VlA族
(2)S2^>CΓ>N,^>Na+
HH
(3)8NH3+3C1=N+6NHCl
224H:N:N:H
⑷取少量饱和H?S(或Na?S)溶液于试管中,通入CL,若有淡黄色沉淀生成,则说明非金属
性Cl强于S
K祥解XX、Y、Z、R为短周期主族元素,X为原子半径最大的短周期元素,则X为Na,Y
的气态氢化物与其最高价氧化物对应的水化物可反应生成离子化合物,则Y为N,Z元素的
单质为淡黄色固体,则Z为S,R与Z同周期,R的最低负价和最高正价分别为-1,+7,则R
为ɑ,另有元素W,其原子序数为34,则W为Se。
(1)元素W(Se)与氧同族,则Se在周期表中位置为第四周期VlA族,原子结构示意图为
(♦3028186(-34)2818C
eJ)')')'CJ)')')'
//;故K答案』为:第四周期VIA族;〃0
高中期末考试/复习精品试卷
(2)根据层多径大,同电子层结构核多径小原则,X、Y、Z、R元素形成的四种简单离子半
径由大到小顺序为S2->Cr>N3->Na+;故K答案X为:S2^>CΓ>N3^>Na+»
(3)Y的气态氢化物可与R的单质反应产生白烟即氨气与氯气反应生成氯化镂和氮气,该
反应的化学方程式为8N&+3C1z=N2+6NH4C1,Y的某种氢化物电子数目为18,则为N2H4,
HHHII
该氢化物的电子式为H5:&H;故K答案》为:8NH3+3C12=N2+6NH4CI;h∙^,^.h,
(4)验证非金属性强弱一般通过最高价氧化物对应水化物的酸性强弱进行比较,或则通过
对应单质的置换反应进行比较,因此比较Cl非金属性大于S主要是通过置换反应,其实验
方案是取少量饱和(或Na?S)溶液于试管中,通入Cl?,若有淡黄色沉淀生成,则说明非
金属性Cl强于S;故K答案》为:取少量饱和H2S(或Na?S)溶液于试管中,通入Cl2,若
有淡黄色沉淀生成,则说明非金属性Cl强于So
高温常压、高温
12.4FeS+110^=2Fe2O3+8SO22SO+O2SOABCDSθ2+2HS^=3S+2H
2222催化剂32
20A
K祥解Il⑴硫酸是重要的化工原料,据工业生产硫酸的流程图可知,把净化干燥后的二氧
化硫和氧气的混合气体通入到催化反应室,在常压、高温、催化剂的作用下,反应产生三氧
化硫,三氧化硫在吸收塔内被98%的硫酸吸收,含有二氧化硫的废气再进行循环利用;二氧
化硫气体具有酸性氧化物的性质、能够与碱、碱性溶液、碱性氧化物发生反应,二氧化硫具
有还原性,能够与强氧化剂发生反应;据以上分析解答。
⑵含有硫化氢的尾气在反应炉内燃烧生成二氧化硫,反应炉中发生反应:
高温
-
2H2S+3O22SO2+2H2O;在催化转化器中,硫化氢与二氧化硫在高温下反应生成单质硫,
高温
化学方程式为:SO2+2H2S-3S+2H2O;在冷凝器中,硫蒸气变为硫固体,据以上分析进行
解答。
K详析》⑴①假设FeSz中铁、硫元素的化合价依次为+2价、-1价,反应后价态分别升高
1、5价,氧气由。价降低到-2价;ImOlFeS2完全反应,共转移电子IlmOI,ImOl氧气完全
反应,转移电子4mol,根据电子得失守恒,FeSz的化学计量数4,。2的化学计量数11,根
高中期末考试/复习精品试卷
据原子守恒配平其它物质,所以该反应的化学方程式:4FeS2+1102-2Fe2O3+8SO2;
—常压、鬲时
②催化反应室中S5被氧化为S03的化学方程式:2SO2+O2他〃2SO,;
③二氧化硫属于酸性氧化物,能够与碱、碱性氧化物、显碱性的盐溶液发生反应,二氧化
硫具有还原性,能够被酸性高镭酸钾溶液氧化,所以能吸收SCh的有A.氨水,B.酸性KMnC)4
溶液,C.生石灰,D.Na2CC)3溶液,故选ABCD;
⑵②在克劳斯工艺中,催化转化器中二氧化硫将WS氧化为硫单质,反应的化学方程式:
I国温
SO2+2H2S=3S+2H2O;
③为了提高H2S转化为S的比例,催化转化器中硫化氢与二氧化硫应恰好完全反应;假设
催化转化器中参加反应的硫化氢的物质的量为为2mol,二氧化硫的物质的量为Imol,即反
应炉中需要生成ImOl二氧化硫,反应炉中参加反应的硫化氢的物质的量为ImOI,所以理论
上应控制反应炉中H2S的转化率为g;故选Ao
13.(1)加热煮沸、充分搅拌、延长浸取时间等合理K答案』
+
(2)2Γ+H2O2+2H=I2+2H,0
⑶过滤分液漏斗B
⑷碘单质易升华,会导致碘的损失
K样解U紫菜在用烟中焙烧变为紫菜灰,用水浸取,通过加热等可以提高浸取速率,得到
紫菜灰的悬浊液,再过滤得到滤液,向滤液中加入双氧水、稀硫酸氧化变为单质碘,用有机
溶剂萃取分液,再蒸储得到单质碘。
(1)为了充分浸取紫菜灰中的碘元素,可采用的方法是加热煮沸、充分搅拌、延长浸取时
间等合理K答案%故K答案D为:加热煮沸、充分搅拌、延长浸取时间等合理K答案
(2)加入双氧水和稀硫酸后,碘离子被氧化为单质碘,其反应的离子方程式是
++
2Γ+H2O2+2H=I2+2H2O;故K答案X为:2Γ+H2O2+2H=I2+2H2Oo
(3)紫菜灰浸取后形成悬浊液,通过过滤得到溶液,因此操作①的名称是过滤,加入双氧
水氧化得到单质碘,单质碘用苯或四氯化碳等有机溶剂萃取分液,因此操作②应在分液漏
斗中振荡、静置;试剂A是有机溶剂,乙醇与水互溶,NaC)H与单质碘反应,环己烯与单质
高中期末考试/复习精品试卷
碘加层反应,因此可选用下列物质中的B;故K答案Il为:过滤;分液漏斗;Bo
(4)单质碘易升华,因此该方案采用常压蒸储并不合理,理由是碘单质易升华,会导致碘
的损失;故K答案』为:碘单质易升华,会导致碘的损失。
14.(1)CIOH168
R解析2(1)查A中C、H的个数可知,A的分子式为:C10Hl6iA没有对称轴,所含有的
H的种类即为A的一氯代物的数目,共8种H,所以一氯代物有8种;
(2)有机物B含有碳碳双键和醇羟基,即K答案H为碳碳双键、羟基;能够跟BWCCL1溶
液发生加成反应的官能团为碳碳双键,ImOIB中含有2mol碳碳双键,所以消耗2molBr2,即
K答案H为:碳碳双键、羟基;2;加成反应;
(3)有机物C含有的官能团为酯基,在酸性条件下水解生成CKCOOH和Hoi),所以
l
化学方程式为:Oi人Ojjj^H2θ.≈=ftHOH+CWCOOH;
JOH
(4)有机物B分子中1个手性碳原子,如图:ʌ,故R答案』为1。
15.(1)0.166.7%
+
(2)负CO2+2H+2e-=HCOOH
⑶劣于相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳
反应活化能相对小,消碳反应速率大
(4)-",IO+HQ)=C),+1+凡。
高中期末考试/复习精品试卷
K解析Il(I)
根据已知条件,列该化学平衡的三段式:
2CO2(g)+6H2(g)CH3OCH3(g)+3H2θ(g)
初始量∕mol26OO
变化量2
∕mol3432
22
平衡量∕mol3232
ACAn4—
v(H,)=一=——=-----=0.1mol∕(L∙min);二氧化碳的转化率ɑ(eθ?)=工x100%=66.7%;
∆tV∆t2×202
(2)
由装置图物质转化关系可知,电极a发生氧化反应,为电池的负极,b电极发生还原反应,
为正极,右侧电极附近反应物为二氧化碳,生成物为甲酸,电池在工作过程中氢离子通过质
子交换膜进入右侧,所有右侧正极为酸性环境,故电极反应式为:
+
CO2+2H+2e^=HCOOH;
(3)
已知:反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。所以
较好的催化剂应该是有利于消碳反应,则需要该催化剂的活化能低,即催化剂Y的更好,另
外,该催化剂同时应该不利于积碳反应,即积碳反应的活化能高,由表可观察出,催化剂Y
的活化能高,两方面都说明催化剂Y更好,即催化剂X劣于催化剂Y;原因是相对于催化剂
X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反
应速率大;
(4)
活化能越大,化学反应速率越小,所以对于两步反应,慢反应对应的活化能大,即K答案』
为第一步;由于r为催化剂,第一步参与反应,第二步要生成「,同时消耗io-生成5,根
据原子守恒和电子守恒可知,故第二步的离子方程式为:IO+H2O2=O2+Γ+H,Oo
高中期末考试/复习精品试卷
jʌl
TfT元素周期表
⅛氨
IeEΞ2
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2026吉林省路桥工程(集团)有限公司项目部劳务派遣人员招聘114人笔试备考题库及答案解析
- 2026年江西工业职业技术学院单招综合素质考试备考试题含详细答案解析
- 2026上半年杭州市卫生健康委员会所属十家事业单位招聘116人笔试备考试题及答案解析
- 2026“才聚齐鲁成就未来”山东土地资本投资集团有限公司社会招聘11人笔试备考试题及答案解析
- 2026上海高等研究院光源科学中心博士后研究人员招收2人笔试备考题库及答案解析
- 2026江西事业单位联考吉安市事业单位招聘944人笔试备考试题及答案解析
- 2026云南昆明市西山区人才资源运营管理有限公司招募高校毕业见习人员6人笔试备考题库及答案解析
- 2026北京市海淀区实验小学教育集团招聘笔试备考题库及答案解析
- 2026江苏南京大学XZ2026-021海外教育学院行政主管招聘笔试备考题库及答案解析
- 2026山东菏泽学院计算机学院诚聘高层次人才笔试备考题库及答案解析
- 2026年新广西安全员a证考试试题及答案
- 合同法讲座课件
- 2026年及未来5年市场数据中国多旋翼无人机行业市场全景调研及投资规划建议报告
- 扁鹊凹凸脉法课件
- 足浴店入股合同协议书
- JJF(石化) 001-2023 漆膜耐洗刷试验仪校准规范
- 【百思特】华为手机品牌变革历程研究白皮书
- 2025年湖南铁路科技职业技术学院单招职业技能测试题库及答案1套
- 加气站气瓶充装质量保证体系手册2024版
- Rexroth (博世力士乐)VFC 3610系列变频器使用说明书
- 全麻苏醒期躁动

评论
0/150
提交评论