



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
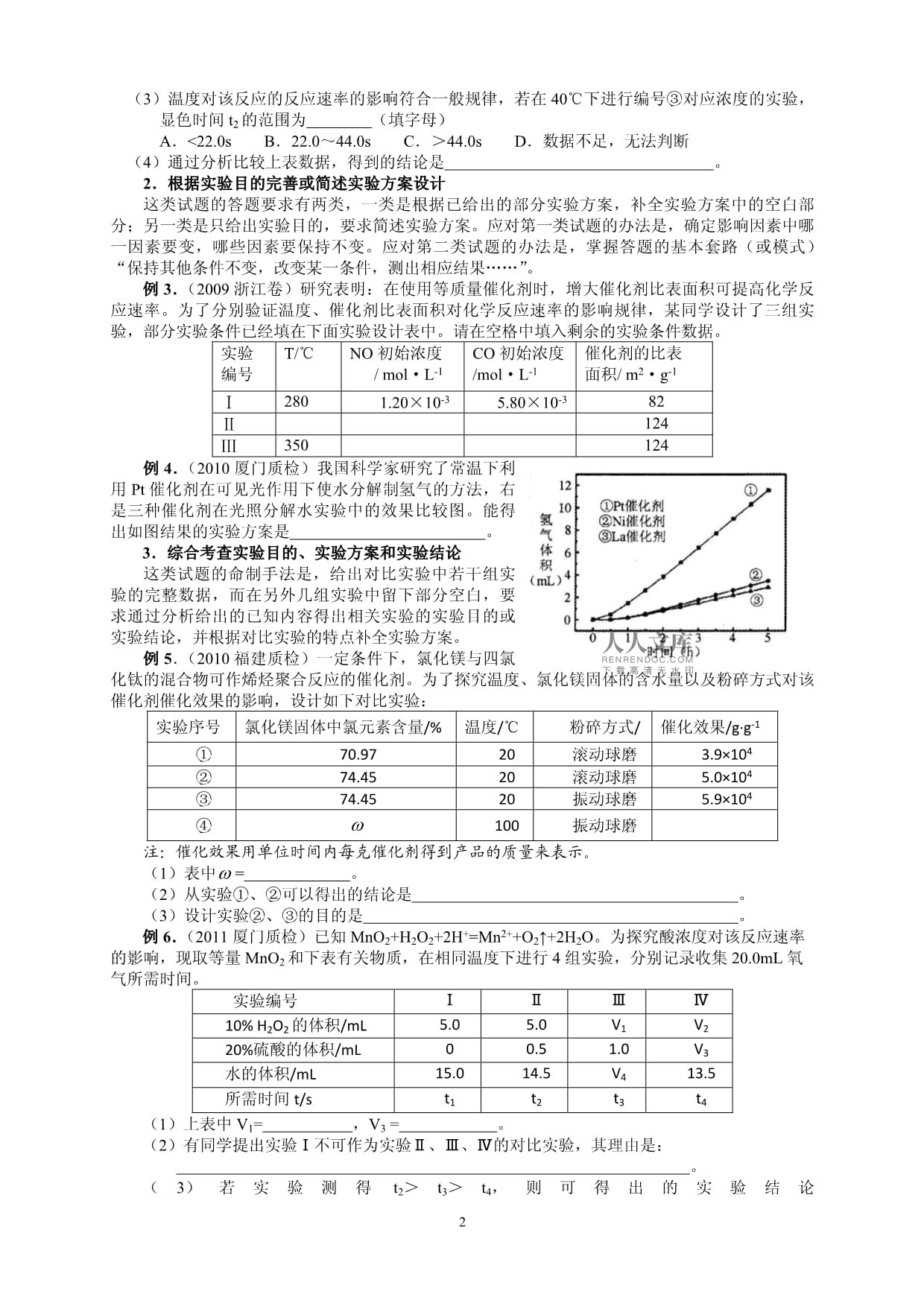
PAGEPAGE5化学实验专题化学实验与数据处理班级座号姓名变量控制法:变量控制法就是在有多个因素(变量)同时起作用的过程中,通过控制实验条件,逐个研究单个因素(同时控制其他因素不变)的影响,然后加以综合的研究方法。一般可采用以下步骤:观察现象———提出问题———猜想与假设———小组讨论———控制变量(进行实验)———总结规律。一、常见的考查方式实验条件控制与对比实验设计试题有三种常见的考查方式:1、给出完整的实验方案及实验数据,要求从中得出实验目的、实验结论,或确定与某实验目的相对应的实验序号。2、是给出部分实验方案,要求根据实验目的完善实验方案的设计,或根据某一实验目的简述实验方案。3、是通过在实验方案中巧布信息点,综合考查实验目的、实验方案设计和实验结论。二、通用的解题思路实验条件控制与对比实验的方案由想要研究的影响因素(自变量)、其他影响因素(不变量)和影响结果(因变量)三部分组成。分析实验目的、实验方案和实验结论三者之间的内在逻辑关系,不难得出解答这类试题的一般思路(见下图)。三、典型试题1.根据实验方案得出实验目的或实验结论这类试题有选择题和填空题两种呈现方式,解题的关键是找准实验方案中的自变量和因变量,“研究自变量对因变量的影响”即为实验目的,“随自变量xx变化因变量xx变化”即为实验结论。例1.(2009福建卷)某探究小组利用丙酮的溴代反应(CH3COCH3+Br2=CH3COCH2Br++HBr)来研究反应物浓度与反应速率的关系。反应速率υ(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:实验序号初始浓度c/mol·L-1溴颜色消失所需时间t/sCH3COCH3HClBr2①0.800.200.0010290②1.600.200.0010145③0.800.400.0010145④0.800.200.0020580分析实验数据所得出的结论不正确的是()A.增大[CH3COCH3],υ(Br2)增大B.实验②和③的υ(Br2)相等C.增大[HCl],υ(Br2)增大D.增大[Br2],υ(Br2)增大例2.(2007广东卷)“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃实验编号①②③④⑤c(I-)/mol·L-10.0400.0800.0800.1600.120c(S2O82-)/mol·L-10.0400.0400.0800.0200.040t/s88.044.022.044.0t2(1)该实验的目的是。(2)显色时间t2=。(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为A.<22.0sB.22.0~44.0sC.>44.0sD.数据不足,无法判断(4)通过分析比较上表数据,得到的结论是。2.根据实验目的完善或简述实验方案设计这类试题的答题要求有两类,一类是根据已给出的部分实验方案,补全实验方案中的空白部分;另一类是只给出实验目的,要求简述实验方案。应对第一类试题的办法是,确定影响因素中哪一因素要变,哪些因素要保持不变。应对第二类试题的办法是,掌握答题的基本套路(或模式)“保持其他条件不变,改变某一条件,测出相应结果……”。例3.(2009浙江卷)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。实验编号T/℃NO初始浓度/mol·L-1CO初始浓度/mol·L-1催化剂的比表面积/m2·g-1Ⅰ2801.20×10-35.80×10-382Ⅱ124Ⅲ350124例4.(2010厦门质检)我国科学家研究了常温下利用Pt催化剂在可见光作用下使水分解制氢气的方法,右是三种催化剂在光照分解水实验中的效果比较图。能得出如图结果的实验方案是。3.综合考查实验目的、实验方案和实验结论这类试题的命制手法是,给出对比实验中若干组实验的完整数据,而在另外几组实验中留下部分空白,要求通过分析给出的已知内容得出相关实验的实验目的或实验结论,并根据对比实验的特点补全实验方案。例5.(2010福建质检)一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:实验序号氯化镁固体中氯元素含量/%温度/℃粉碎方式/催化效果/g·g-1①70.9720滚动球磨3.9×104②74.4520滚动球磨5.0×104③74.4520振动球磨5.9×104④100振动球磨注:催化效果用单位时间内每克催化剂得到产品的质量来表示。(1)表中=。(2)从实验①、②可以得出的结论是。(3)设计实验②、③的目的是。例6.(2011厦门质检)已知MnO2+H2O2+2H+=Mn2++O2↑+2H2O。为探究酸浓度对该反应速率的影响,现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间。实验编号ⅠⅡⅢⅣ10%H2O2的体积/mL5.05.0V1V220%硫酸的体积/mL00.51.0V3水的体积/mL15.014.5V413.5所需时间t/st1t2t3t4(1)上表中V1=,V3=。(2)有同学提出实验Ⅰ不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是:。(3)若实验测得t2>t3>t4,则可得出的实验结论是。【巩固练习】1、(09宁夏卷改编)某化学兴趣小组同学,利用硫代硫酸钠溶液与稀硫酸的反应探究温度、反应物浓度对化学反应速率的影响。(Na2S2O3+H2SO4==Na2SO4+SO2↑+S↓+H2O)实验序号反应温度/℃Na2S2O3溶液稀H2SO4H2OV/mLc/(mol·L-1)V/mLc/(mol·L-1)V/mL①2550.1100.15②2550.2V10.2V2③35V30.2100.1V4(1)①、②的实验目的是,其中V1=,V2=。(2)①、③的实验目的是,其中V3=,V4=。2.某校化学实验小组为探究外界条件对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率,进行了如下实验探究:实验原理:(NH4)2S2O8与KI反应离子方程式为S2O82-+2I-=2SO42-+I2(I)(反应很慢!),平均反应速率的计算式用:v=K[S2O82-]m[I-]n(I)表示,其中K为常数,只与温度有关。实验时,向Na2S2O3、KI和淀粉指示剂的混合溶液中加入(NH4)2S2O8溶液,不断搅拌。在反应(I)进行的同时,发生反应:2S2O32-+I2=S4O62-+2I-(II)(反应很快!),反应(I)生成的I2立即与硫代硫酸钠反应,生成无色物质。当S2O32-耗尽时,反应(I)继续生成的I2才能与淀粉作用呈蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为∆t。实验内容实验小组设计的实验记录表和数据记录如下:(1)实验研究发现,亚铁离子对反应(I)有催化作用:①现有亚铁盐X,可能是硫酸亚铁、氯化亚铁、硝酸亚铁、溴化亚铁中一种,你认为X最合适的亚铁盐的化学式___________________。用离子方程式表示催化反应(I)的机理:_____________________________________________________________________________________________________________________________________________________________。②某同学设计如下探究方案(请填空):(2)根据上述数据推知v=K[S2O82-]m[I-]n中m、n值近似为:m=_______,n=_______。(3)根据上述数据分析,可以得出的结论有(写出一条):______________________________________________________________________________________3.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。(1)请完成此实验设计,其中:V1=__________,V6=__________,V9=__________;(2)反应一段时间后,实验A中的金属呈_______色,实验E中的金属呈__________色;(3)该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因____________________________________________________________________________________。4.地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。实验前:①先用0.1mol/L硫酸溶液洗涤Fe粉,其目的是________________________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入__________________(写化学式)。下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式_________________________________________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是___________________________________________________________________________________________。(3)该课题组对影响脱氮速率的因素提出如下假设,请你完成:假设一:溶液的pH;假设二:__________________________________________________________;假设三:__________________________________________________________;·····(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知溶液中的NO3-浓度可用离子色谱仪测定)________________________________________________________________________________________________________________________________________________________________________________________________________________________________化学实验与数据处理【参考答案】例1.解析:选项A的自变量是[CH3COCH3],因此[HCl]和[Br2]应为不变量,分析上表数据可知实验①和②为该选项的对比实验,又[CH3COCH3]实验②大于实验①,因变量(t)实验②小于实验①,可见增大[CH3COCH3],υ(Br2)增大,选项A正确。同理,可推出选项C也正确。实验②和实验③的[Br2]相等,t也相等,可见实验②和实验③的υ(Br2)相等,选项B正确。选项D的自变量为[Br2],因此不变量为[CH3COCH3]和[HCl],分析上表数据可知实验①和实验④为该选项的对比较实验,[Br2]实验④是实验①的2倍,t实验④也是实验①的2倍,可见υ(Br2)不受[Br2]的影响,选项D不正确。答案:D例2.解析:(1)从表中给出的物理量可知c(I-)、c(S2O82-)为自变量,t(用来度量反应速率)为因变量,因此该实验的目的是研究反应物I-与S2O82-的浓度对反应速率的影响。(2)实验⑤中c(S2O82-)与实验①、实验②相同。比较实验①、实验②可知,c(I-)变为原来的2倍时,反应所需时间变为原来的1/2,实验⑤中c(S2O82-)为实验①的3倍,其反应所需时间应实验①的1/3,因此t2=88.0/3≈29.3。(3)在其他条件保持不变的情况下,温度升高反应速率增大,因此实验③在40℃下进行实验时所需时间比20℃少。(4)设反应速率与浓度关系为υ=kcm(I-)cn(S2O82-),实验①和实验②中c(S2O82-)相等,比较这两个实验可知c(I-)变为原来的2倍时,反应速率也变为原来的2倍,因此m=1;实验②和实验③中c(I-)相等,比较这两个实验可知c(S2O82-)变为原来的2倍时,反应速率也变为原来的2倍,因此n=1。综上可知υ=kc(I-)c(S2O82-),即反应速率与反应物起始浓度乘积成正比。答案:(1)研究反应物I-与S2O82-的浓度对反应速率的影响(2)29.3s(3)A(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)例3.解析:实验Ⅰ、实验Ⅱ的自变量为催化剂的比表面积,只有保持其他条件不变才能得出有说服力的结论,因此实验Ⅱ中的T、NO初始浓度、CO初始浓度都应与实验Ⅰ相同。实验Ⅲ与实验Ⅱ的催化剂的比表面积相等,T不等,可见实验Ⅱ和实验Ⅲ的自变量为T,实验Ⅲ的NO初始浓度、CO初始浓度都应与实验Ⅱ相同。答案:Ⅱ:280、1.20×10-3、5.80×10-2;Ⅲ:1.20×10-3、5.80×10-2例4.解析:题中给出的是对比实验的实验结果图,可见要设计的实验为对比实验。从右图可看出,催化剂的种类是自变量,其他因素(水的量、催化剂的质量、光照强度等)为不变量,每隔半小时分解所得氢气的体积为因变量。因此,实验方案要体现三个要点:一是其他条件不变(指明不变量);二是使用Pt、Ni、La三种不同的催化剂(指明自变量);三是每隔半小时测出分解生成的氢气体积(指明因变量)。答案:控制其它条件不变,每半小时测定一次不同催化剂分解水产生氢气的体积,记录数据,作图分析。例5.解析:该实验要探究温度、氯化镁固体的含水量以及粉碎方式三个因素对催化剂催化效果的影响。要探究其中一个因素对催化剂催化效果的影响时,另两个因素必须保持不变。比较实验①②③④,发现实验④中100℃这一条件与实验①②③不同,可见实验④的目的是研究温度对催化剂催化效果的影响,故除温度不同外,其他条件都要相同;再看另外两个因素,其中实验③的粉碎方式与实验④相同,故实验④中氯化镁固体中氯元素含量也要与③相同,即=74.45。实验①②的变量是“氯化镁固体中氯元素含量”,比较实验①②的催化效果,可知氯化镁固体中氯元素含量越高(即含水量越低)催化效果越好。实验②③的变量是“粉碎方式”,故实验②③的实验目的是探究粉碎方式对催化效果的影响。答案:(1)74.45(2)氯化镁固体含水量越高,催化剂催化效果越差(3)探究粉碎方式对催化效果的影响例6.解析:(1)该实验的目的是“探究酸浓度对该反应速率的影响”,因此除酸浓度外的其他量都要保持不变。据4组实验中H2O2的浓度应保持不变,可知V1=V2=5.0;据4组实验溶液的总体积应相等(都为20.0mL),可知V3=1.
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 初中体育立定跳远动作的踝关节力量训练与跳跃高度突破课题报告教学研究课题报告
- 高中生研究金属离子催化对果蔬维生素C滴定测定结果的影响课题报告教学研究课题报告
- 初中生物实验中生态缸制作与维护的实践研究课题报告教学研究课题报告
- 2026湖南常德市柳叶湖旅游度假区开发公益性岗位备考题库含答案详解(黄金题型)
- 2026辽宁省妇幼保健院招聘高层次和急需紧缺人才10人备考题库附参考答案详解(预热题)
- 2026甘肃武威凉州区五和镇选聘专业化管理村文书招聘1人备考题库含答案详解(研优卷)
- 2026浙江丽水学院招聘3人备考题库带答案详解(新)
- 2026湖北事业单位联考黄冈市团风县招聘100人备考题库带答案详解(能力提升)
- 2026福建泉州市凌霄中学春季顶岗合同教师招聘2人备考题库及答案详解一套
- 2026湖北事业单位联考天门市招聘248人备考题库含答案详解(培优a卷)
- 中国人身保险业经验生命表2025
- 农业合作社管理与运营实操指南
- 外伤性脑出血病例分析与管理流程
- 大类资产配置量化模型研究系列之五:不同协方差矩阵估计方法对比分析
- 产前筛查设备管理制度
- 木工机械日常点检表
- (完整word)长沙胡博士工作室公益发布新加坡SM2考试物理全真模拟试卷(附答案解析)
- GB/T 4108-2004镁粉和铝镁合金粉粒度组成的测定干筛分法
- GB/T 12805-2011实验室玻璃仪器滴定管
- 优秀QC小组活动成果发布模板教学文案
- 规划环评资料清单

评论
0/150
提交评论