



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
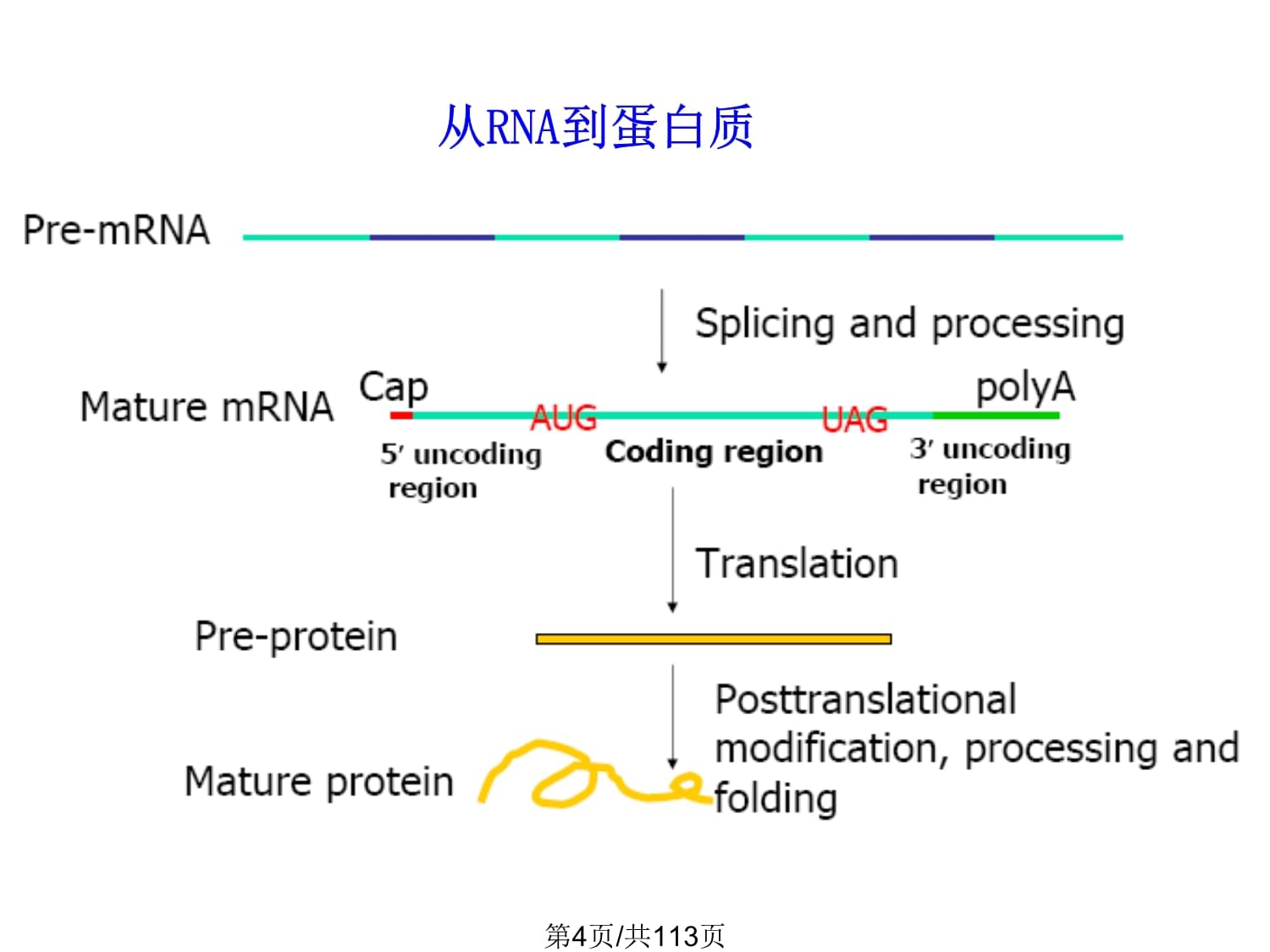
导学1、掌握遗传密码的基本规律2、掌握蛋白质合成的体系。3、掌握蛋白质生物合成的基本过程。4、掌握蛋白质合成后加工的主要方式。了解蛋白质合成后的输送。第1页/共113页16.1遗传密码16.2蛋白质合成体系16.3蛋白质的合成过程16.4蛋白质合成后的加工修饰16.5蛋白质的定向运输第2页/共113页将mRNA分子中由碱基序列组成的遗传信息,通过遗传密码破译的方式转变成为蛋白质中的氨基酸排列顺序,因而称为翻译(translation)。第3页/共113页从RNA到蛋白质第4页/共113页16.1
遗传密码密码子(codon):mRNA中的核苷酸序列与多肽链中氨基酸序列之间的对应关系。mRNA上每三个连续核苷酸对应一个氨基酸,这三个连续的核苷酸就称为一个密码子,或三联体密码(tripletcodons)。16.1.1遗传密码和密码单位苯丙氨酸组氨酸苏氨酸第5页/共113页遗传密码(geneticcodon):密码子的总和。mRNA——4种碱基
1个碱基作为密码——4个密码子(41)
2个碱基作为密码——16个密码子(42)
3个碱基作为密码——64个密码子(43)64个密码子:其中61个代表20种氨基酸,3个代表终止密码子。第6页/共113页
保温蛋白质合成停止polyU,ATP,GTP,氨基酸多聚苯丙氨酸(UUU是Phe的密码子)同样方法证明:CCC是Pro的密码子,
AAA是Lys的密码子.......提取液(DNA、mRNA、tRNA、核糖体、酶等)遗传密码的破译第7页/共113页1968年诺贝尔生理医学奖第8页/共113页遗传密码字表第9页/共113页起始密码(startcodon
):AUG(编码甲硫氨酸、甲酰甲硫氨酸),少数情况
GUG;终止密码(stopcodon
):无义密码子(nonsensecodons),不编码氨基酸的密码子,它们单个或串联在一起用于多肽链翻译的结束,没有相应的tRNA存在,有UAA、UAG、UGA。同义密码(synonymouscodon):编码相同氨基酸的不同密码子。第10页/共113页第11页/共113页遗传密码的基本特征方向性连续性不重叠性简并性摆动性通用性第12页/共113页
重叠密码非重叠连续的密码不连续的密码方向性(directional)
:5’→3’,AUG。
连续性(continuity)不重叠性(nonoverlapping)第13页/共113页基因损伤引起mRNA阅读框架内的碱基发生插入或缺失,可能导致移码突变。第14页/共113页简并性(degeneracy):
多个密码子编码同一种氨基酸的现象。在遗传密码中,除色氨酸和甲硫氨酸仅有一个密码子外,其余氨基酸有2~4个或多至6个密码子。密码的简并性往往表现在密码子的第三位碱基上。密码的偏爱性:在不同生物中使用同义密码子的频率是不相同的。意义:减少有害突变,维持物种稳定。第15页/共113页摆动性(wobble)tRNA上反密码子的第1位碱基与mRNA密码子的第3位碱基配对时,并不严格遵循碱基配对规律,可以在一定范围内变动的现象,又称变偶性。其它两个碱基要严格配对。第16页/共113页反密码子第1位碱基IUGAC密码子第3位碱基U,C,AA,GU,CUG密码子的表示法:密码子的专一性基本取决于前两位碱基,第三位碱基起的作用有限(有较大灵活性)。第17页/共113页通用性(universal):
指各种低等和高等生物,包括病毒、细菌及真核生物基本上共用一套遗传密码。密码的变异性:目前已知线粒体DNA(mtDNA)和叶绿体的编码方式与通用遗传密码子有所不同,如在一些线粒体中UGA不是终止密码子,而是色氨酸的密码子。密码的通用性进一步证明各种生物进化自同一祖先。
第18页/共113页密码的防错系统:
密码子的碱基顺序与其相应AA的物理化学性质之间存在巧妙的关系。中间是U,AA是非极性、疏水性的;中间是C,AA是非极性的或具有不带电荷的极性侧链;中间是A或G,AA是亲水性的;第一位是A或G,第二位是A或G,AA具有可解离的亲水侧链并具碱性;前二位是AG,AA具酸性亲水侧链。
第19页/共113页16.1.2阅读框一个蛋白质的氨基酸序列是由连续的三联体密码子的线性顺序决定的,这个序列的第一个密码子建立了一种阅读框(readingframe)。从mRNA5’端起始密码子AUG到3’端终止密码子之间的核苷酸序列,称为开放阅读框架(openreadingframe,ORF)。第20页/共113页16.2蛋白质合成体系第21页/共113页20种氨基酸作为原料酶及蛋白因子,如IF、eIF、EF、RF等
ATP、GTP、无机离子参与蛋白质生物合成的物质包括:
三种RNAmRNA
rRNA(核糖体)
tRNA第22页/共113页翻译的直接模板。mRNA是遗传信息的携带者。编码序列(codonsequence,CDS):一条多肽链对应的mRNA序列,即位于起始密码子和终止密码子之间的核苷酸序列。16.2.1mRNA5’CTGTCATAAAGATGTCACGGCCGAGACTTATAGTCGCT…………….……………………….……………….……………….….CATGAAAGCCGCTCTGGGGCTGAAATAAAACCGCGCCCGG3’第23页/共113页原核生物mRNAS-D序列:mRNA起始密码AUG上游约8~13个核苷酸处,有4~9个核苷酸组成的富含嘌呤的一段序列,以…AGGA…为核心,因发现者是Shine-Dalgamo而得名为S-D序列,又称为核糖体结合位点(ribosomalbindingsite,RBS)。
第24页/共113页真核生物mRNA帽子结构:结合核糖体,增加稳定性;poly(A)尾:增加稳定性,提高翻译效率。第25页/共113页第26页/共113页16.2.2核糖体(ribosome)由rRNA和多种蛋白质结合而成的一种较大的核糖核蛋白颗粒(核糖体),是蛋白质生物合成的场所(装置)。第27页/共113页原核生物真核生物
核蛋白体原核生物真核生物蛋白质S值rRNA蛋白质S值rRNA小亚基21种30S16S33种40S18S大亚基34种50S23S5S49种60S28S5.8S5S核糖体70S80S第28页/共113页第29页/共113页核糖体的功能部位A位:氨酰-tRNA结合位点(aminoacyl-tRNAbindingsite,受位);P位:肽酰基-tRNA结合位点(peptidyl-tRNAbindingsite,给位);
E位:空位(exitsite),专供tRNA离开(真核生物没有);mRNA结合位点:核糖体小亚基;P位和A位紧密连接,各占一个密码子的距离。第30页/共113页转肽酶部位:形成肽键,位于核糖体大亚基。第31页/共113页核糖体在细胞内的存在形态:核糖体亚基、单核糖体和多核糖体。多核糖体:一定数目的单个核糖体与一个mRNA分子结合而成的念珠状结构;大约每隔40个核苷酸结合一个核糖体。每个核糖体独立完成一条肽链的合成,在多核糖体上可同时进行多条肽链的合成,提高翻译效率。第32页/共113页16.2.3tRNA氨基酸的搬运工具,tRNA在翻译过程中起接合体(adaptor)作用。第33页/共113页tRNA的关键部位:3’端CCA接受氨基酸,形成氨酰-tRNA;反密码子部位与mRNA结合(tRNA接头作用);氨酰tRNA合成酶的识别位点;核糖体识别位点。翻译精确性的保证:
密码子--反密码子--氨基酸tRNA的表示方法:第34页/共113页tRNA的种类起始tRNA:真核生物tRNAMet,原核生物tRNAfMet(N-甲酰甲硫氨酰tRNA)。同工tRNA:携带相同氨基酸而反密码子不同的一组tRNA。校正tRNA:生物体发生突变后,校正机制之一是通过校正基因合成一类tRNA,经过其反密码子上发生某种突变,以“代偿”或校正原有突变所产生的不良后果,以维持翻译作用译码的相对正确性,从而翻译出正常蛋白质,这类tRNA称为校正tRNA。可有多种校正tRNA携带同一种氨基酸。第35页/共113页16.2.4氨酰-tRNA合成酶(aminoacyl-tRNAsynthetase)氨基酸+tRNA氨酰-tRNAATP
AMP+PPi氨酰-tRNA合成酶共分两步反应。第36页/共113页反应机理第一步反应:氨基酸+ATP氨基酰-AMP+AMP+PPi
消耗两个高能键~PPi第37页/共113页第二步反应:氨基酰-AMP+tRNA氨基酰-tRNA+AMP氨基酸活化部位为α-羧基;氨基酸与tRNA连接方式为酯键,为高能键。α-羧基第38页/共113页第39页/共113页tRNA与酶的结合模型第40页/共113页氨酰-tRNA合成酶的特点专一性对氨基酸有极高的专一性,每种氨基酸都有专一的酶;只作用于L-氨基酸,不作用于D-氨基酸;消耗2个高能磷酸键。(20种氨酰-tRNA合成酶)
对tRNA具有极高专一性(第二遗传密码系统),能识别与此氨基酸相对应的一个或多个tRNA分子。校对作用:氨酰-tRNA合成酶的水解部位可以水解错误活化的氨基酸。翻译过程的错误频率<10-4。第41页/共113页
氨基酸的活化形式:氨基酰-tRNA
氨基酸的活化部位:α-羧基
氨基酸与tRNA连接方式:酯键
氨基酸活化耗能:2个~Pi第42页/共113页起始氨基酰-tRNA真核生物:Met-tRNAiMet(i-initiation)原核生物:fMet-tRNAifMetMet-tRNAfMet甲硫氨酰-tRNAfMet-tRNAfMetN-甲酰-甲硫氨酰-tRNA甲酰四氢叶酸第43页/共113页20种氨基酸作为原料酶及蛋白因子,如IF、eIF、EF、RF等
ATP、GTP、无机离子参与蛋白质生物合成的物质包括:
三种RNAmRNA
rRNA(核糖体)tRNA(氨酰-tRNA合成酶)
第44页/共113页16.3蛋白质的合成过程方向:
mRNA模板的方向:5′→3′;蛋白质的合成方向:N端→C端;
翻译过程从阅读框架的5´-AUG开始,按mRNA模板三联体密码的顺序延长肽链,直至终止密码出现。第45页/共113页翻译的起始(initiation)翻译的延长(elongation)翻译的终止(termination)整个翻译过程可分为:第46页/共113页16.3.1翻译的起始(initiation)指mRNA和起始氨酰-tRNA分别与核糖体结合而形成翻译起始复合物
(translationalinitiationcomplex)。起始氨酰-tRNA——真核生物:Met-tRNAiMet原核生物:fMet-tRNAifMet第47页/共113页参与起始过程的蛋白质因子称起始因子(initiationfactor,IF)。原核生物的起始因子:IF1、IF2和IF3。IF-1:占据A位防止结合其他tRNA。IF-2:促进fMet-tRNAi与小亚基结合。IF-3:促进大小亚基分离,提高P位对结合起始tRNA敏感性。第48页/共113页真核生物各种起始因子的生物功能(eukaryoticinitiationfactor,eIF)
起始因子生物功能eIF-2促进起始tRNA与小亚基结合eIF-2B,eIF-3促进大小亚基分离eIF-4AeIF-4F复合物成分,有解螺旋酶活性,促进mRNA结合小亚基eIF-4B促进mRNA扫描定位起始AUGeIF-4EeIF-4F复合物成分,结合mRNA5’帽子eIF-4GeIF-4F复合物成分,结合eIF-4E和PABeIF-5促进各种起始因子从小亚基解离,进而结合大亚基eIF-6促进核糖体分离成大小亚基第49页/共113页16.3.1.1原核生物翻译起始复合物形成1、核糖体大小亚基分离;2、mRNA在小亚基定位结合;3、起始氨基酰-tRNA的结合;4、核糖体大亚基结合。第50页/共113页IF-3IF-11、核糖体大小亚基分离第51页/共113页AUG5'3'IF-3IF-12、mRNA在小亚基定位结合mRNA的S-D序列第52页/共113页IF-3IF-1IF-2GTPAUG5'3'3、起始氨基酰tRNA与小亚基结合fMet-tRNAifMet是唯一一个结合到P位的氨酰-tRNA,其他的都是先与A位结合。第53页/共113页IF-3IF-1IF-2GTPGDPPiAUG5'3'4、核糖体大亚基结合第54页/共113页IF-3IF-1AUG5'3'IF-2GTPIF-2-GTPGDPPi起始过程消耗1个GTP。第55页/共113页16.3.1.2真核生物翻译起始复合物形成基本过程同原核生物翻译的起始过程,也分4个步骤。1、核糖体大小亚基分离;2、mRNA在小亚基定位结合;3、起始氨基酰-tRNA的结合;4、核糖体大亚基结合。第56页/共113页Met40SMetMet40S60SmRNAeIF-2B、eIF-3、
eIF-6
①elF-3②GDP+Pi各种elF释放elF-5④ATPADP+PielF4E,elF4G,elF4A,elF4B,PAB③真核生物翻译起始复合物形成过程Met-tRNAiMet-elF-2
-GTPMet60S第57页/共113页
核糖体是80S;起始因子种类多;起始tRNA的Met不需甲酰化;mRNA的5’帽子和3’polyA尾结构与mRNA在核糖体就位有关;起始tRNA先与核糖体小亚基结合,然后mRNA再结合上来。
真核生物翻译起始的特点第58页/共113页16.3.2翻译的延长(elongation)指按照mRNA密码序列的指导,依次添加氨基酸从N端向C端延伸肽链,直到合成终止的过程。第59页/共113页肽链的延长是在核糖体上连续性循环式进行,又称为核糖体循环(ribosomalcycle),每次循环增加一个氨基酸,分为以下三步:1、进位(entrance)2、成肽(peptidebondformation)3、转位(translocation)第60页/共113页原核延长因子生物功能对应真核延长因子EF-Tu促进氨基酰-tRNA进入A位,结合分解GTPEF-1-αEF-Ts调节亚基EF-1-βγEF-G有转位酶活性,促进mRNA-肽酰-tRNA由A位前移到P位,促进卸载tRNA释放EF-2肽链合成的延长因子第61页/共113页1、进位指根据mRNA下一组遗传密码指导,使相应氨基酰-tRNA进入核糖体A位。
第62页/共113页延长因子EF-T催化进位(原核生物)
消耗1个GTP第63页/共113页TuTsGTPGDPAUG5'3'TuTsGTP第64页/共113页2、成肽由转肽酶(transpeptidase)催化的肽键形成过程。第65页/共113页3、转位延长因子EF-G有转位酶(translocase)活性,促进核糖体向mRNA的3’侧移动。第66页/共113页
消耗1个GTP第67页/共113页fMetAUG5'3'fMetTuGTP第68页/共113页重复进行,直至肽链延长到一定长度为止。进位成肽转位第69页/共113页真核生物肽链合成的延长过程与原核基本相似,但有不同的反应体系和延长因子。另外,真核细胞核糖体没有E位,转位时卸载的tRNA直接从P位脱落。真核生物延长过程第70页/共113页16.3.3翻译的终止(termination)当mRNA上终止密码出现后,多肽链合成停止,肽链从肽酰-tRNA中释出,mRNA、核糖体等分离,这些过程称为肽链合成终止。
第71页/共113页释放因子(releasefactor,RF)终止相关的蛋白因子。识别终止密码,如RF-1特异识别UAA、UAG;而RF-2可识别UAA、UGA;诱导转肽酶改变为酯酶活性,相当于催化肽酰基转移到水分子-OH上,使肽链从核糖体上释放。释放因子的功能原核生物释放因子:RF-1,RF-2,RF-3;真核生物释放因子:eRF第72页/共113页原核肽链合成终止过程GTPGTPGDP消耗1个GTP第73页/共113页UAG5'3'RFCOO-第74页/共113页
生成氨酰-tRNA:1个 ATP(2个~Pi)
起始: 1个 GTP
延长: 2个 GTP
终止: 1个 GTP
结论:每合成一个肽键至少消耗4个~P。原核生物蛋白质合成的能量计算第75页/共113页起始复合物形成所参与的因子不同原核:IF1、IF2、IF3、70S核糖体;真核:9种起始因子参与[eIF1,eIF2,eIF3,EIF4(a、b、c、d、e、f)eIF5,eEIF6]和80S核糖体。起始复合物形成的次序差异原核:30S+mRNA+fMet-tRNAifMet+50S,最终形成70S起始复合物;真核:40S+Met-tRNAiMet+mRNA+60S,最终形成80S起始复合物。真核生物与原核生物蛋白质合成的差异第76页/共113页延长和终止的差异过程基本相似,但参与因子不同;原核:EF-Tu、EF-Ts、EF-G;RF1、RF2、RF3。真核:EF1α、EF1βγ、EF2;RF。起始氨基酸:fMet、Met合成速度:原核快,10-15个肽键/核糖体/秒;真核慢,1-3个肽键/核糖体/秒。第77页/共113页抗生素作用点作用原理四环素族(金霉素新霉素、土霉素)链霉素、卡那霉素、新霉素氯霉素、林可霉素红霉素梭链孢酸
放线菌酮嘌呤霉素原核核糖体小亚基原核核糖体小亚基原核核糖体大亚基原核核糖体大亚基原核核糖体大亚基真核核糖体大亚基真核、原核核糖体抑制氨基酰-tRNA与小亚基结合改变构象引起读码错误、抑制起始抑制转肽酶、阻断延长抑制转肽酶、妨碍转位与EFG-GTP结合,抑制肽链延长抑制转肽酶、阻断延长氨基酰-tRNA类似物,进位后引起未成熟肽链脱落16.3.4蛋白质生物合成的抑制剂第78页/共113页四环素族氯霉素链霉素和卡那霉素嘌呤霉素放线菌酮第79页/共113页16.4蛋白质合成后的加工修饰肽链从核糖体释放后,经过细胞内各种加工修饰处理,成为有活性的成熟蛋白质的过程。加工修饰类型一级结构的修饰高级结构的修饰多肽链折叠第80页/共113页16.4.1蛋白质前体的加工一级结构的加工修饰氨基端和羧基端的修饰:N端甲酰甲硫氨酸的甲酰基经酶水解而除去;某些蛋白质分子氨基端要进行乙酰化,羧基端也要进行修饰。二硫键的形成:真核细胞合成的某些蛋白质,往往能自发地折叠形成其天然构像,分子内的半胱氨酸的巯基之间形成共价键(二硫键)。二硫键在稳定蛋白质空间构型中起着重要作用。第81页/共113页第82页/共113页蛋白质自我剪接:切除蛋白内含肽的过程。第83页/共113页氨基酸的修饰:磷酸化修饰:某些蛋白质分子中的丝氨酸、苏氨酸、酪氨酸残基在酶催化下被ATP磷酸化;糖基化修饰:糖蛋白的糖链是蛋白质合成之后,在通过高尔基体时,经过糖化而形成的;羟基化反应:胶原蛋白中的脯氨酸与赖氨酸的羟基化,由相应的羟基化酶催化完成;甲基化反应:某些蛋白质中的赖氨酸残基需要甲基化,某些谷氨酸残基的羧基也要甲基化,以除去负电荷。第84页/共113页高级结构的修饰:亚基聚合;辅基连接;疏水脂链的共价连接等。第85页/共113页16.4.2蛋白质的折叠第86页/共113页蛋白质折叠过程中存在中间体第87页/共113页大多数蛋白质的折叠都需要其他酶和蛋白质的辅助。新生肽链的体内折叠合成后折叠边合成边折叠第88页/共113页几种有促进蛋白折叠功能的大分子1、分子伴侣(molecularchaperon)2、蛋白二硫键异构酶(proteindisulfideisomerase,PDI)3、肽-脯氨酰顺反异构酶(peptideprolylcis-transisomerase,PPI)第89页/共113页1、分子伴侣(molecularchaperon):
细胞内一类保守蛋白质,可识别肽链的非天然构象,促进各功能结构域和整体蛋白质的正确折叠。热休克蛋白(heatshockprotein,HSP):HSP70、HSP40和GreE家族;
伴侣素(chaperonins):
包括GroEL/GroES家族,为非自发性折叠蛋白质提供能折叠形成天然空间构象的微环境。第90页/共113页热休克蛋白促进蛋白质折叠的基本作用:与待折叠的多肽链结合,诱发多肽链折叠成正确构象,防止多肽链间相互聚合或错误折叠。HSP40结合待折叠多肽片段HSP70-ATP复合物HSP40-HSP70-ADP-多肽复合物ATP水解GrpEATPADP复合物解离,释出多肽链片段进行正确折叠第91页/共113页伴侣素的主要作用:为非自发性折叠蛋白质提供能折叠形成天然空间构象的微环境。第92页/共113页伴侣素GroEL/GroES系统促进蛋白质折叠过程第93页/共113页2、蛋白二硫键异构酶(proteindisulfideisomerase,PDI)
二硫键异构酶在内质网腔活性很高,可在较大区段肽链中催化错配二硫键断裂并形成正确二硫键连接,最终使蛋白质形成热力学最稳定的天然构象。第94页/共113页3、肽-脯氨酰顺反异构酶(peptideprolylcis-transisomerase,PPI)多肽链中肽酰-脯氨酸间形成的肽键有顺反两种异构体,空间构象明显差别。肽酰-脯氨酰顺反异构酶可促进上述顺反两种异构体之间的转换。肽酰-脯氨酰顺反异构酶是蛋白质三维构象形成的限速酶,在肽链合成需形成顺式构型时,可使多肽在各脯氨酸弯折处形成准确折叠。第95页/共113页16.5蛋白质的定向运输靶向输送(proteintargeting)
蛋白质在合成以后,定向到达其执行功能的目标地点的过程。第96页/共113页细胞质基质细胞核溶酶体
高尔基体
内质网
线粒体过氧化物酶体分泌颗粒内体细胞表面核糖体膜结合核糖体游离核糖体第97页/共113页所有靶向输送的蛋白质结构中存在分选信号,主要为N末端特异氨基酸序列,可引导蛋白质转移到细胞的适当靶部位,这一序列称为信号序列。信号序列(signalsequence)第98页/共113页靶向输送蛋白信号序列或成分分泌蛋白信号肽内质网腔蛋白信号肽,C端-Lys-Asp-Glu-Leu-COO-(KDEL序列)线粒体蛋白N端靶向序列(20~35氨基酸残基)核蛋白核定位序列(-Pro-Pro-Lys-Lys-Lys-Arg-Lys-Val-,SV40T抗原)过氧化体蛋白-Ser-Lys-Leu-(PST序列)溶酶体蛋白Man-6-P(甘露糖-6-磷酸)靶向输送蛋白的信号序列或成分第99页/共113页细胞内蛋白质的运输方式细胞核
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 2025年蔬菜糕项目可行性研究报告
- 2025年缓蚀抑雾剂项目可行性研究报告
- 组胚世鄂课件上皮组织(2015级)学习资料
- 2025年玻璃水果盘项目可行性研究报告
- 2025年潜油电机定子测量仪项目可行性研究报告
- 流域生态修复与可持续发展路径探讨
- 2025年油性321色卡项目可行性研究报告
- 2024-2025新版车间安全培训考试试题(典型题)
- 25年公司管理人员安全培训考试试题答案达标题
- 课题开题报告:租赁产品对消费者行为的双刃剑影响、机理及应对策略-心理所有权缺失和负担双视角
- 足球裁判规则PPT
- 利润分配专项审计
- 探索性数据分析简介课件
- PPT肾癌诊疗指南CSCO课件
- 螺纹的标注-PPT课件
- 勇者斗恶龙之怪兽仙境图表资料合集(合成表技能)
- 履带式液压挖掘机挖掘机构设计
- 原材料进厂检验管理制度及检验规程
- 川崎病诊治指南最新ppt课件
- 聚苯胺的结构和形貌表征分析结果
- (最新)四星级酒店标准

评论
0/150
提交评论