



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
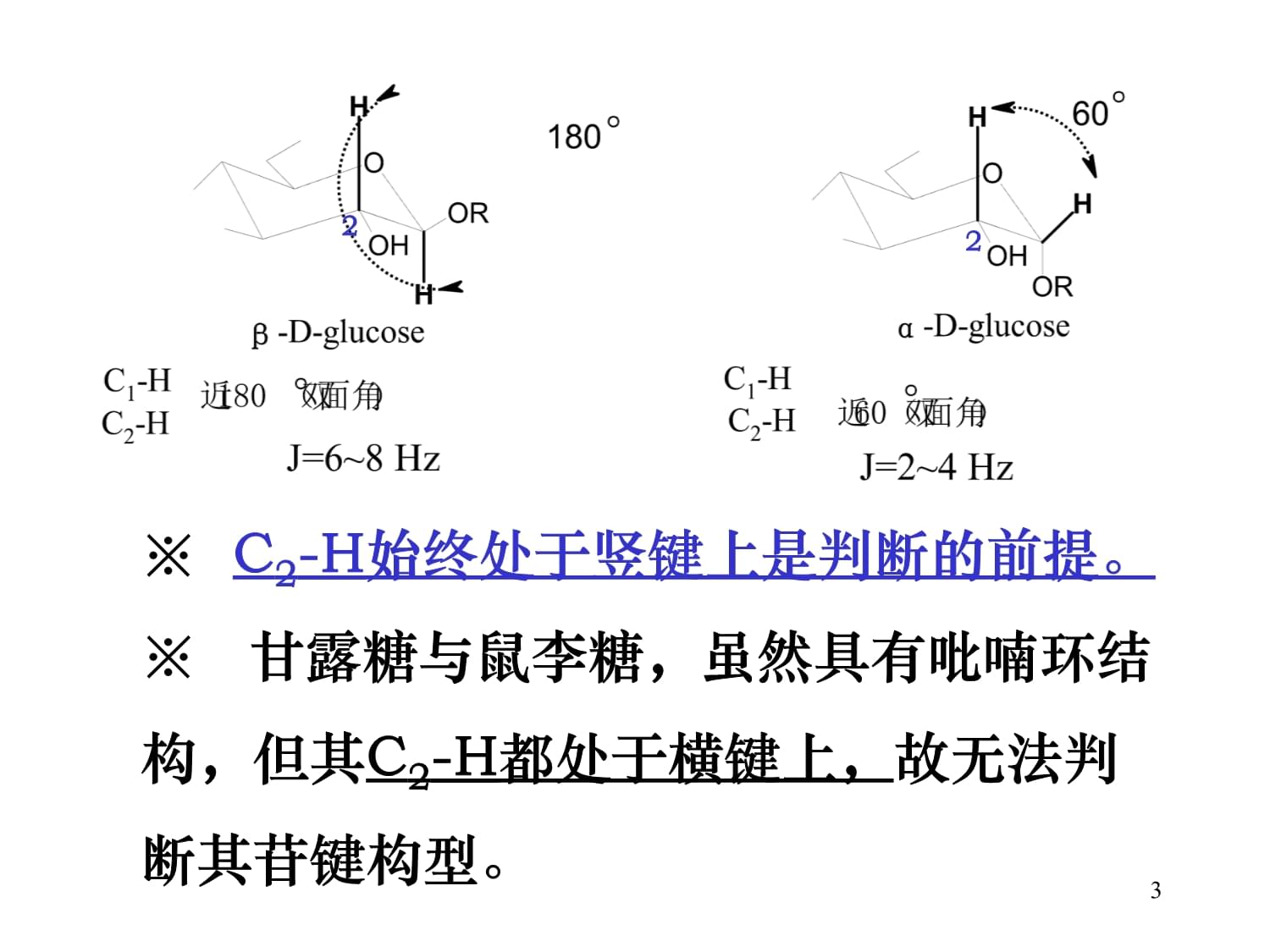
第五节糖的核磁共振性质一、糖的1HNMR性质1、糖的端基质子信号在δ5.0ppm附近,多数呈现特征性的双峰,少数呈现宽单峰。2、糖环质子信号在δ3.5—δ4.5ppm之间。3、甲基五碳糖(如鼠李糖)的甲基质子信号在δ1.0ppm附近.第五节糖的核磁共振性质一、糖的1HNMR性质14、糖的C1-H与C2-H的偶合常数,广泛应用于吡喃糖环端基碳原子构型的判断。※原理:绝大多数的D-吡喃糖(如葡萄糖),当C1-OH处于横键上(代表β-苷键),C1-H与C2-H的偶合常数J=6-8Hz;当C1-OH处于竖键上(代表α-苷键),C1-H与C2-H的偶合常数J=2-4Hz。※原因:质子间的偶合常数与两面角有关。4、糖的C1-H与C2-H的偶合常数,广泛应用于2※C2-H始终处于竖键上是判断的前提。※甘露糖与鼠李糖,虽然具有吡喃环结构,但其C2-H都处于横键上,故无法判断其苷键构型。22※C2-H始终处于竖键上是判断的前提。223
◆鼠李糖优势构象是1C式1212112233◆鼠李糖优势构象是1C式12121122334α-L-鼠李糖苷β-L-鼠李糖苷φ=600φ=600C1α-L-鼠李糖苷β-L-鼠李糖苷φ=600φ=600C15二、糖的13CNMR性质(一)化学位移与偶合常数1、D-吡喃糖的化学位移值C1:α-型97~101ppmβ-型103~106ppmCH-OH(C2、C3、C4)70~78ppmCH2-OH(C6)62ppm左右CH3(糖的甲基C)18ppm左右二、糖的13CNMR性质6※一般在13C-NMR谱中2、D-呋喃糖的化学位移值CH2-OH(C1)64ppm左右CH-OH(C3、C5)>80ppm(偏大)※一般在13C-NMR谱中2、D-呋喃糖的化学位移值73、13C谱化学位移数据的应用①依据97~106ppm区域13C信号的个数可判断低聚糖及其苷中所含糖基的个数.②如果端基13C信号出现在大于100ppm的区域,则苷键构型为β-D或α-L;如果端基13C信号出现在小于100ppm的区域,则苷键构型为α-D或β-L。3、13C谱化学位移数据的应用8③依据13C谱数据尚可判断氧环的大小。◆对于呋喃氧环CH-OH(C3、C5)>80ppm◆对于吡喃氧环CH-OH(C3、C5)<78ppm③依据13C谱数据尚可判断氧环的大小。94、吡喃糖中端基碳的C-H偶合常数(1JC1-H1)可用于苷键构型的确定.①
对于D-吡喃糖甲苷:α-苷键JC1-H1≈165~170Hzβ-苷键JC1-H1≈155~160Hz例如:α-D-甘露糖甲苷1JC1-H1=166ppm;β-D-甘露糖甲苷1JC1-H1=156ppm。
4、吡喃糖中端基碳的C-H偶合常数(1JC1-H1)10②
对于L-鼠李糖甲苷:α-苷键JC1-H1≈165~170Hzβ-苷键JC1-H1≈155~160Hz例如:α-L-鼠李糖甲苷1JC1-H1=168ppm;β-L-鼠李糖甲苷1JC1-H1=158ppm。5、呋喃型糖苷无法用端基碳与端基质子的偶合常数来判断其苷键构型。②
对于L-鼠李糖甲苷:11(二)苷化位移(glycosydationshift)1、概念:糖成苷后,糖的端基碳和苷元α-C、β-C的化学位移值均发生改变,这种苷化前后化学位移的变化现象,称为苷化位移。端基碳苷元碳(二)苷化位移(glycosydationshift)端基122、苷化位移一般规律①端基碳、苷元α-碳的化学位移值向低场方向移动5~6ppm(+5~+6)单位;②苷元β-碳的化学位移值向高场方向移动3~4ppm(-3~-4)单位;③糖分子其他碳原子化学位移值变化不大。④苷元β-位有取代基时的苷化位移规律:2、苷化位移一般规律13◆苷元α-碳和糖端基碳绝对构型都为R(或S)时,苷化位移规律同①、②。端基碳α-碳β-碳◆苷元α-碳和糖端基碳绝对构型都为R端基碳α-碳β-碳14
◆苷元α-碳和糖端基碳绝对构型不同时,端基碳和α-碳的苷化位移值比苷元β-位无取代基者大约高3.5ppm单位。端基碳α-碳◆苷元α-碳和糖端基碳绝对构型不同时,端基碳α-碳153、酯苷、酚苷的苷化位移规律:
苷化位移值较特殊,端基碳与羰基碳(即苷元α-碳)均向高场方向位移,β-C向低场方向位移。例如:齐墩果酸在成苷后,其分子结构中既含醇苷、也有酯苷结构。可用于对比有关碳原子化学位移值的变化情况。3、酯苷、酚苷的苷化位移规律:16端基碳端基碳α-Cα-Cβ-Cβ-C端基碳端基碳α-Cα-Cβ-Cβ-C17α-Cβ-Cβ-Cα-Cα-Cβ-Cβ-Cα-C184、苷化位移有关说明:①苷化位移值与苷元的结构有关,与糖的种类无关。β-D-葡萄吡喃甲苷13C1=104.0ppmβ-D-甘露吡喃甲苷13C1=104.5ppm4、苷化位移有关说明:β-D-葡萄吡喃甲苷β-D-甘露吡喃甲19②如果苷元为链状结构,则糖端基碳的苷化位移值随着苷元为伯、仲、叔基而递减。例如:与糖的甲苷化学位移比较,苷元分别为伯、仲、叔基时,糖端基碳的苷化位移值的变化情况如下,②如果苷元为链状结构,则糖端基碳的苷化20端基碳化学位移值下降-2-4-7端基碳化学位移值下降-2-4-721③在被苷化的糖分子结构中,通常与端基碳直接相连的α-C的化学位移变化较大些,β-C稍受影响,其他碳原子受到的影响则较少。④在确定了苷中糖的种类以后,将苷的13C谱数据与相应单糖的13C谱数据进行比较,利用苷化位移规律可确定苷中糖的连接位置。③在被苷化的糖分子结构中,通常与端基碳直接相连的α-C的化22例如:判断双糖苷中两单糖的连接位置◆将双糖苷的13C谱数据与相应单糖的13C谱数据进行比较;◆如果内侧糖的某个碳原子的化学位移向低场方向移动了(通常是4~7ppm),而与其相邻的两个碳原子之化学位移值又略向高场方向移动(约1~2ppm),则内侧糖的这个碳原子就是糖的连接位置。例如:判断双糖苷中两单糖的连接位置23三、红外光谱IR1.3700~3100cm-1间有明显O-H吸收峰。2.如糖分子中含羧基、酰基等,则相应官能团的IR吸收峰可见。3.多糖在1500~960cm-1有许多吸收峰,其中970~730cm-1间的峰可用作端基碳构型判断。例如:840cm-1吸收峰——α-L-吡喃糖苷890cm-1吸收峰——β-D-吡喃糖苷三、红外光谱IR1.3700~3100cm-1间有明显O-24四、质谱1、糖类难挥发,且热不稳定,需要制成挥发性的衍生物才能进行质谱分析。2、糖的立体异构体往往出现几乎相同的质谱,仅在碎片丰度上稍有区别(不能用质谱来区别糖的构型!)。3、糖和苷的分子量:可用CI(化学电离),FD-MS、FAB-MS等方法获得分子离子峰后测出。四、质谱1、糖类难挥发,且热不稳定,需要制成挥发254、软电离方式得到的碎片峰很少,但有可能获得从分子离子峰按顺序失去一个个糖基后的碎片离子峰。如果事先测定了多糖的组成,则可根据质谱的碎片离子峰信息来推断原糖链的连接顺序。4、软电离方式得到的碎片峰很少,但有可能获得从分子离子峰按顺26第六节糖链的结构测定※主要解决四个问题①单糖的组成;②糖的氧环大小;③糖与糖之间的连接位置和顺序;④苷键构型。第六节糖链的结构测定※主要解决四个问题27(一)纯度测定方法1、高压电泳法※原理:由于中性多糖导电性差、分子量大、在电场中的移动速度慢,常将其制成硼酸络合物进行高压电泳。※电泳支持体:玻璃纤维丝、纯丝绸布等。※缓冲液:pH=9-12的硼砂溶液。※电压:30-50V/cm(一)纯度测定方法28※
时间:30-120min※
显色剂:p-甲氧基苯胺-硫酸。※注意:必须使用冷却系统,将温度维持在0℃,以免烧坏支持体。※本法常用2、超离心法※原理:由于微粒在离心力场中移动的速度与微粒的密度、大小与形状有关,故将多糖※
时间:30-120min29溶液进行密度梯度超离心时,如果是组成均一的多糖,则应呈现单峰。※具体做法:将多糖样品制成1%-5%的氯化钠或tris-盐溶液,接着进行密度梯度超离心,待转速达到恒定后(6000转/min),采用间隔照明法检测其是否为单峰。溶液进行密度梯度超离心时,如果是组成均一303、旋光光度法在多糖水溶液中加入乙醇使其浓度达到10%左右,离心得沉淀。上清液再用乙醇使其浓度达到20%-25%左右,离心得到第二次沉淀。比较两次沉淀的比旋光度,如果比旋光度相同则为纯品,否则为混合物。4、其他方法如凝胶柱色谱、官能团摩尔比恒定法等。3、旋光光度法31(二)分子量测定1、测定多糖分子量物理方法:沉降法、光散射法、黏度法和渗透压法等。2、凝胶过滤法简介:在凝胶柱上不同分子量的多糖与洗脱体积成一定的关系。采用一系列结构相似的已知分子量的多糖做标准曲线,进而测定样品多糖的分子量。◆该法用量小、操作较简便。(二)分子量测定323、单糖、低聚糖及其苷分子量的测定※最常用FD-MS、FAB-MS与电喷雾-MS4、多糖分子量的测定方法①基质辅助激光解析电离质谱(MALDI-MS)②基质辅助激光解析飞行时间质谱(MALDI-TOF-MS).3、单糖、低聚糖及其苷分子量的测定33(三)单糖的鉴定
1.纸层析①展开系统:常用水饱和的有机溶剂如:正丁醇:醋酸:水(4:1:5上层)BAW正丁醇:乙醇:水(4:1:2.2)BEW②展开方式:上行、下行等③显色剂:可利用糖的还原性或形成糠醛后引起的一些呈色反应。例如,(三)单糖的鉴定34※邻苯二甲酸苯胺※硝酸银试剂(使还原糖显棕黑色)※三苯四氮唑盐试剂(单糖和还原性低聚糖呈红色)※3,5-二羟基甲苯-盐酸试剂(酮糖呈红色)※过碘酸-联苯胺(糖、苷和多元醇中有邻二-OH结构显兰底白斑)。※邻苯二甲酸苯胺352.薄层层析①采用(硼酸液/无机盐)+硅胶→制板②吸附剂:硅胶③显色剂:除纸层析应用以外,还有H2SO4/H2O或乙醇液、茴香醛-硫酸试剂、苯胺-二苯胺磷酸试剂等。2.薄层层析363.气相层析①将糖制备成三甲基硅醚②醛糖用NaBH4还原成多元醇,制成乙酰化物或三氟乙酰化物。4.离子交换层析①原理:糖的硼酸络合物可进行离子交换层析3.气相层析37②优点:不必制成衍生物,而直接用水溶液进行分离(与气相比较)③需要仪器—糖自动分析仪5.液相色谱①填充材料——化学修饰的硅胶②优点:不必制备成衍生物。适合分析对热不稳定的、不挥发的低聚糖和多糖。③缺点:灵敏度不及气相层析高。②优点:不必制成衍生物,而直接用水溶液38◆多糖组成的鉴定1、必要性:低聚糖、多糖的结构分析,首先要了解由哪些单糖所组成、各种单糖之间的比例等。2、多糖组成鉴定过程:将苷键全水解,用PC检出单糖的种类,经显色后用薄层扫描仪求得各种糖的分子比(也可用GC或HPLC对各单糖定性定量分析)。◆多糖组成的鉴定39(四)糖连接位置的测定1、化学方法:多采用甲基化法①过程:将糖链全甲基化,然后水解所有的苷键,用气相色谱法对水解产物—甲基化单糖—进行定性和定量分析。②甲基化过程:常用箱守法(Hakomori)③水解过程:通常先用90%甲酸全水解,然后用0.05mol/LH2SO4或三氟乙酸水解。(四)糖连接位置的测定40④气相色谱法定性和定量分析:选择各种单糖的标准品,分别与水解后得到的各种甲基化单糖进行比较,具有游离-OH的部位就是糖的连接位置,而全甲基化的单糖即为末端糖。⑤计算过程:算出所得各甲基化产物相互之间的比例,据此可推测出糖链重复单位中各种单糖的数目。④气相色谱法定性和定量分析:41①全甲基化②水解游离羟基游离羟基①全甲基化游离羟基游离羟基422、NMR谱法(了解内容)
①13CNMR谱法:目前用来确定糖的连接位置的常用方法※该法是在归属各碳信号的基础上,以游离苷元和甲基糖苷作为参考化合物,确定产生苷化位移的碳,然后利用苷化位移规则,即可方便地获知各单糖的连接位置。2、NMR谱法(了解内容)43②1HNMR谱法:※先使糖与苷乙酰化,再比较不同类型质子的化学位移。
例如:CHOAc中CH质子的化学位移为4.75~5.4ppm;而CH2OAc、CH2OR中质子在3.0~4.3ppm;端基质子介于这两者之间。※通过2D-NMR判定质子的归属,从而得出糖的连接位点。②1HNMR谱法:44第五节糖的核磁共振性质一、糖的1HNMR性质1、糖的端基质子信号在δ5.0ppm附近,多数呈现特征性的双峰,少数呈现宽单峰。2、糖环质子信号在δ3.5—δ4.5ppm之间。3、甲基五碳糖(如鼠李糖)的甲基质子信号在δ1.0ppm附近.第五节糖的核磁共振性质一、糖的1HNMR性质454、糖的C1-H与C2-H的偶合常数,广泛应用于吡喃糖环端基碳原子构型的判断。※原理:绝大多数的D-吡喃糖(如葡萄糖),当C1-OH处于横键上(代表β-苷键),C1-H与C2-H的偶合常数J=6-8Hz;当C1-OH处于竖键上(代表α-苷键),C1-H与C2-H的偶合常数J=2-4Hz。※原因:质子间的偶合常数与两面角有关。4、糖的C1-H与C2-H的偶合常数,广泛应用于46※C2-H始终处于竖键上是判断的前提。※甘露糖与鼠李糖,虽然具有吡喃环结构,但其C2-H都处于横键上,故无法判断其苷键构型。22※C2-H始终处于竖键上是判断的前提。2247
◆鼠李糖优势构象是1C式1212112233◆鼠李糖优势构象是1C式121211223348α-L-鼠李糖苷β-L-鼠李糖苷φ=600φ=600C1α-L-鼠李糖苷β-L-鼠李糖苷φ=600φ=600C149二、糖的13CNMR性质(一)化学位移与偶合常数1、D-吡喃糖的化学位移值C1:α-型97~101ppmβ-型103~106ppmCH-OH(C2、C3、C4)70~78ppmCH2-OH(C6)62ppm左右CH3(糖的甲基C)18ppm左右二、糖的13CNMR性质50※一般在13C-NMR谱中2、D-呋喃糖的化学位移值CH2-OH(C1)64ppm左右CH-OH(C3、C5)>80ppm(偏大)※一般在13C-NMR谱中2、D-呋喃糖的化学位移值513、13C谱化学位移数据的应用①依据97~106ppm区域13C信号的个数可判断低聚糖及其苷中所含糖基的个数.②如果端基13C信号出现在大于100ppm的区域,则苷键构型为β-D或α-L;如果端基13C信号出现在小于100ppm的区域,则苷键构型为α-D或β-L。3、13C谱化学位移数据的应用52③依据13C谱数据尚可判断氧环的大小。◆对于呋喃氧环CH-OH(C3、C5)>80ppm◆对于吡喃氧环CH-OH(C3、C5)<78ppm③依据13C谱数据尚可判断氧环的大小。534、吡喃糖中端基碳的C-H偶合常数(1JC1-H1)可用于苷键构型的确定.①
对于D-吡喃糖甲苷:α-苷键JC1-H1≈165~170Hzβ-苷键JC1-H1≈155~160Hz例如:α-D-甘露糖甲苷1JC1-H1=166ppm;β-D-甘露糖甲苷1JC1-H1=156ppm。
4、吡喃糖中端基碳的C-H偶合常数(1JC1-H1)54②
对于L-鼠李糖甲苷:α-苷键JC1-H1≈165~170Hzβ-苷键JC1-H1≈155~160Hz例如:α-L-鼠李糖甲苷1JC1-H1=168ppm;β-L-鼠李糖甲苷1JC1-H1=158ppm。5、呋喃型糖苷无法用端基碳与端基质子的偶合常数来判断其苷键构型。②
对于L-鼠李糖甲苷:55(二)苷化位移(glycosydationshift)1、概念:糖成苷后,糖的端基碳和苷元α-C、β-C的化学位移值均发生改变,这种苷化前后化学位移的变化现象,称为苷化位移。端基碳苷元碳(二)苷化位移(glycosydationshift)端基562、苷化位移一般规律①端基碳、苷元α-碳的化学位移值向低场方向移动5~6ppm(+5~+6)单位;②苷元β-碳的化学位移值向高场方向移动3~4ppm(-3~-4)单位;③糖分子其他碳原子化学位移值变化不大。④苷元β-位有取代基时的苷化位移规律:2、苷化位移一般规律57◆苷元α-碳和糖端基碳绝对构型都为R(或S)时,苷化位移规律同①、②。端基碳α-碳β-碳◆苷元α-碳和糖端基碳绝对构型都为R端基碳α-碳β-碳58
◆苷元α-碳和糖端基碳绝对构型不同时,端基碳和α-碳的苷化位移值比苷元β-位无取代基者大约高3.5ppm单位。端基碳α-碳◆苷元α-碳和糖端基碳绝对构型不同时,端基碳α-碳593、酯苷、酚苷的苷化位移规律:
苷化位移值较特殊,端基碳与羰基碳(即苷元α-碳)均向高场方向位移,β-C向低场方向位移。例如:齐墩果酸在成苷后,其分子结构中既含醇苷、也有酯苷结构。可用于对比有关碳原子化学位移值的变化情况。3、酯苷、酚苷的苷化位移规律:60端基碳端基碳α-Cα-Cβ-Cβ-C端基碳端基碳α-Cα-Cβ-Cβ-C61α-Cβ-Cβ-Cα-Cα-Cβ-Cβ-Cα-C624、苷化位移有关说明:①苷化位移值与苷元的结构有关,与糖的种类无关。β-D-葡萄吡喃甲苷13C1=104.0ppmβ-D-甘露吡喃甲苷13C1=104.5ppm4、苷化位移有关说明:β-D-葡萄吡喃甲苷β-D-甘露吡喃甲63②如果苷元为链状结构,则糖端基碳的苷化位移值随着苷元为伯、仲、叔基而递减。例如:与糖的甲苷化学位移比较,苷元分别为伯、仲、叔基时,糖端基碳的苷化位移值的变化情况如下,②如果苷元为链状结构,则糖端基碳的苷化64端基碳化学位移值下降-2-4-7端基碳化学位移值下降-2-4-765③在被苷化的糖分子结构中,通常与端基碳直接相连的α-C的化学位移变化较大些,β-C稍受影响,其他碳原子受到的影响则较少。④在确定了苷中糖的种类以后,将苷的13C谱数据与相应单糖的13C谱数据进行比较,利用苷化位移规律可确定苷中糖的连接位置。③在被苷化的糖分子结构中,通常与端基碳直接相连的α-C的化66例如:判断双糖苷中两单糖的连接位置◆将双糖苷的13C谱数据与相应单糖的13C谱数据进行比较;◆如果内侧糖的某个碳原子的化学位移向低场方向移动了(通常是4~7ppm),而与其相邻的两个碳原子之化学位移值又略向高场方向移动(约1~2ppm),则内侧糖的这个碳原子就是糖的连接位置。例如:判断双糖苷中两单糖的连接位置67三、红外光谱IR1.3700~3100cm-1间有明显O-H吸收峰。2.如糖分子中含羧基、酰基等,则相应官能团的IR吸收峰可见。3.多糖在1500~960cm-1有许多吸收峰,其中970~730cm-1间的峰可用作端基碳构型判断。例如:840cm-1吸收峰——α-L-吡喃糖苷890cm-1吸收峰——β-D-吡喃糖苷三、红外光谱IR1.3700~3100cm-1间有明显O-68四、质谱1、糖类难挥发,且热不稳定,需要制成挥发性的衍生物才能进行质谱分析。2、糖的立体异构体往往出现几乎相同的质谱,仅在碎片丰度上稍有区别(不能用质谱来区别糖的构型!)。3、糖和苷的分子量:可用CI(化学电离),FD-MS、FAB-MS等方法获得分子离子峰后测出。四、质谱1、糖类难挥发,且热不稳定,需要制成挥发694、软电离方式得到的碎片峰很少,但有可能获得从分子离子峰按顺序失去一个个糖基后的碎片离子峰。如果事先测定了多糖的组成,则可根据质谱的碎片离子峰信息来推断原糖链的连接顺序。4、软电离方式得到的碎片峰很少,但有可能获得从分子离子峰按顺70第六节糖链的结构测定※主要解决四个问题①单糖的组成;②糖的氧环大小;③糖与糖之间的连接位置和顺序;④苷键构型。第六节糖链的结构测定※主要解决四个问题71(一)纯度测定方法1、高压电泳法※原理:由于中性多糖导电性差、分子量大、在电场中的移动速度慢,常将其制成硼酸络合物进行高压电泳。※电泳支持体:玻璃纤维丝、纯丝绸布等。※缓冲液:pH=9-12的硼砂溶液。※电压:30-50V/cm(一)纯度测定方法72※
时间:30-120min※
显色剂:p-甲氧基苯胺-硫酸。※注意:必须使用冷却系统,将温度维持在0℃,以免烧坏支持体。※本法常用2、超离心法※原理:由于微粒在离心力场中移动的速度与微粒的密度、大小与形状有关,故将多糖※
时间:30-120min73溶液进行密度梯度超离心时,如果是组成均一的多糖,则应呈现单峰。※具体做法:将多糖样品制成1%-5%的氯化钠或tris-盐溶液,接着进行密度梯度超离心,待转速达到恒定后(6000转/min),采用间隔照明法检测其是否为单峰。溶液进行密度梯度超离心时,如果是组成均一743、旋光光度法在多糖水溶液中加入乙醇使其浓度达到10%左右,离心得沉淀。上清液再用乙醇使其浓度达到20%-25%左右,离心得到第二次沉淀。比较两次沉淀的比旋光度,如果比旋光度相同则为纯品,否则为混合物。4、其他方法如凝胶柱色谱、官能团摩尔比恒定法等。3、旋光光度法75(二)分子量测定1、测定多糖分子量物理方法:沉降法、光散射法、黏度法和渗透压法等。2、凝胶过滤法简介:在凝胶柱上不同分子量的多糖与洗脱体积成一定的关系。采用一系列结构相似的已知分子量的多糖做标准曲线,进而测定样品多糖的分子量。◆该法用量小、操作较简便。(二)分子量测定763、单糖、低聚糖及其苷分子量的测定※最常用FD-MS、FAB-MS与电喷雾-MS4、多糖分子量的测定方法①基质辅助激光解析电离质谱(MALDI-MS)②基质辅助激光解析飞行时间质谱(MALDI-TOF-MS).3、单糖、低聚糖及其苷分子量的测定77(三)单糖的鉴定
1.纸层析①展开系统:常用水饱和的有机溶剂如:正丁醇:醋酸:水(4:1:5上层)BAW正丁醇:乙醇:水(4:1:2.2)BEW②展开方式:上行、下行等③显色剂:可利用糖的还原性或形成糠醛后引起的一些呈色反应。例如,(三)单糖的鉴定78※邻苯二甲酸苯胺※硝酸银试剂(使还原糖显棕黑色)※三苯四氮唑盐试剂(单糖和还原性低聚糖呈红色)※3,5-二羟基甲苯-盐酸试剂(酮糖呈红色)※过碘酸-联苯胺(糖、苷和多元醇中有邻二-OH结构显兰底白斑)。※邻苯二甲酸
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 养老院医疗设施管理制度
- 养老院工作人员培训考核评价制度
- 企业员工培训与职业发展目标路径素质制度
- 企业成本控制制度
- 2026湖北省定向哈尔滨工业大学选调生招录备考题库附答案
- 2026福建省面向兰州大学选调生选拔工作参考题库附答案
- 会议风险评估与应对措施制度
- 2026贵州黔东南州特种设备检验所招聘备考题库附答案
- 2026重庆奉节县石岗乡委员会公开选聘村(社区)后备干部25人参考题库附答案
- 2026陕西省面向中央民族大学招录选调生备考题库附答案
- 剪刀车专项施工方案
- 授信合同与借款合同(标准版)
- 2024-2025学年四川省绵阳市七年级(上)期末数学试卷
- SF-36评估量表简介
- 道路清扫保洁、垃圾收运及绿化服务方案投标文件(技术标)
- 合成药物催化技术
- 河南省三门峡市2024-2025学年高二上学期期末调研考试英语试卷(含答案无听力音频及听力原文)
- 【语文】福建省福州市乌山小学小学三年级上册期末试题(含答案)
- 建立乡镇卫生院孕情第一时间发现制度或流程
- 睡眠科普课课件
- 2025年中级卫生职称-主治医师-放射医学(中级)代码:344历年参考题库含答案解析(5卷)

评论
0/150
提交评论