



版权说明:本文档由用户提供并上传,收益归属内容提供方,若内容存在侵权,请进行举报或认领
文档简介
1、第一章 稀溶液的依数性Colligative properties of dilute solution第一章 稀溶液的依数性 蒸气压下降蒸气压下降 (vapor pressure lowering) 沸点升高沸点升高 (boiling point elevation) 凝固点降低凝固点降低 (freezing point depression) 渗透压渗透压 (osmotic pressure) 稀溶液的这类只与溶质、溶剂微粒数的比值稀溶液的这类只与溶质、溶剂微粒数的比值有关,而与溶质的本性无关的性质,称为稀溶液有关,而与溶质的本性无关的性质,称为稀溶液(bB0.2 molkg 1)的)的依
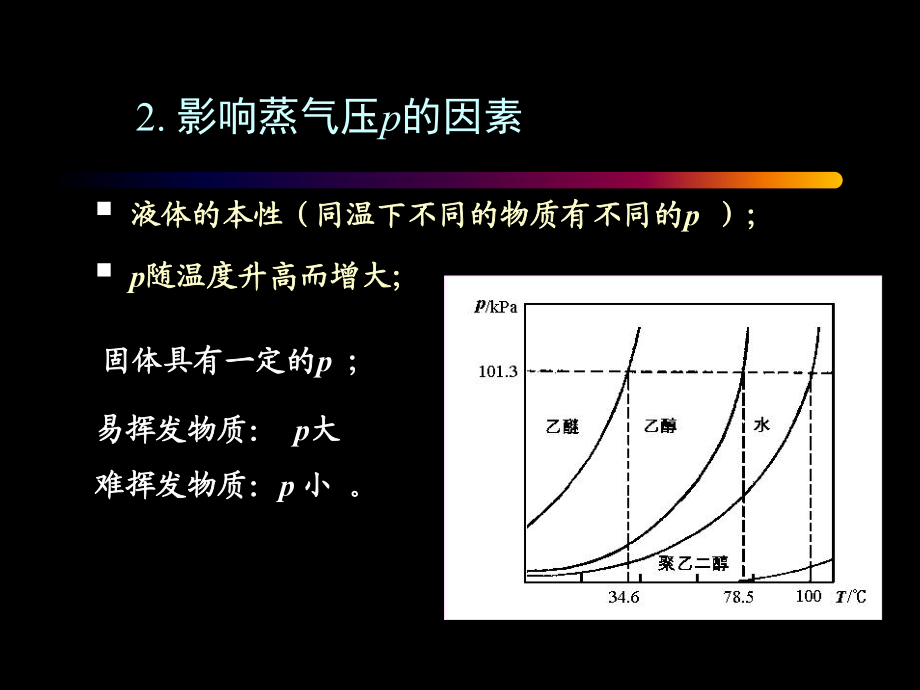
2、数性依数性。第一节 溶液的蒸气压下降一、一、蒸气压蒸气压 p(vapour pressure ) 1. 水(水(l)水(水(g)蒸发蒸发凝结凝结 在一定温度下,在一定温度下,当当v蒸发蒸发= v凝结凝结时,气液相达到平衡,这种时,气液相达到平衡,这种与液相处于与液相处于动态平衡的气体动态平衡的气体叫做叫做饱和蒸气饱和蒸气,产生的,产生的压力称为压力称为该温度下的该温度下的饱和蒸气压饱和蒸气压。简称。简称蒸气压蒸气压。符号为符号为p p ,单位单位为为Pa(帕)或(帕)或 kPa(千(千帕)。帕)。 (与气液相数量无关)(与气液相数量无关)2. 影响蒸气压p的因素 液体的本性(同温下不同的物质有
3、不同的液体的本性(同温下不同的物质有不同的p );); p随温度升高而增大;随温度升高而增大; 固体具有一定的固体具有一定的p ; 易挥发物质:易挥发物质: p大大难难挥发物质:挥发物质:p 小小 。二、溶液的蒸气压下降(p)1. 原因:原因:加入一种难挥发性溶质加入一种难挥发性溶质2. 拉乌尔定律:拉乌尔定律:溶液的蒸气压:溶液的蒸气压: p = p* xA (p * 为纯溶剂的蒸气压)为纯溶剂的蒸气压)p = p* - p = p* - p* xA(一种溶质)(一种溶质) = p* xB2. 拉乌尔定律 内容内容:温度一定时,:温度一定时,难挥发性非电解质稀难挥发性非电解质稀溶液溶液的蒸气
4、压下降的蒸气压下降p与溶质的质量摩尔浓与溶质的质量摩尔浓度度bB成正比。成正比。 表达式表达式:p = K bB = K nB / mA(溶剂溶剂) 表明表明:蒸气压下降只与一定量溶剂中所含的:蒸气压下降只与一定量溶剂中所含的溶质的微粒数有关,而与溶质的种类无关。溶质的微粒数有关,而与溶质的种类无关。K = p* MA第二节 溶液的沸点升高和凝固点降低 一、溶液的沸点升高一、溶液的沸点升高(boiling point elevation)1.沸点沸点Tb:p液液=p外外时的温度(沸腾)。时的温度(沸腾)。 液体的正常沸点是指外压为液体的正常沸点是指外压为101.3kPa时的沸点。时的沸点。没有
5、专门注明压力条件的沸点通常都是指正常沸点。没有专门注明压力条件的沸点通常都是指正常沸点。 2. 溶液的沸点升高原因 原因:原因:p溶液溶液 p溶剂溶剂 Tb = Tb - Tb* 101.3P (kPa)373 (Tb*) T (K)纯水纯水水溶液水溶液TbTb3. 溶液的沸点升高值的计算公式 Tb = Tb - Tb* = Kb bBKb为溶剂的质量摩尔为溶剂的质量摩尔沸点升高常数沸点升高常数表明表明:难挥发性的非电解质稀溶液的沸点升高与:难挥发性的非电解质稀溶液的沸点升高与溶质的本性无关。溶质的本性无关。 2. 溶液的凝固点降低原因水水冰冰溶液溶液AB0.61273 (Tf *) A :冰
6、:冰-水共存水共存TfP (kPa)T (K)B :冰:冰-溶液共存溶液共存 Tf 原因:原因:p溶液溶液 p溶剂溶剂 Tf = Tf * - Tf1.凝固点凝固点 Tf: p液液=p固固时的温度。时的温度。 二、溶液的凝固点Tf降低(freezing point lowing)3. 溶液的凝固点降低值的计算公式 Tf = Tf * - Tf = Kf bBKf为溶剂的质量摩尔为溶剂的质量摩尔凝固点降低常数凝固点降低常数水的水的Kf为为1.86Kkgmol-1, Kb为为0.512Kkgmol-1应用一:测定溶质的相对分子质量 例例 取取0.749g谷氨酸溶于谷氨酸溶于50.0g水中,测得凝固
7、水中,测得凝固点为点为-0.188,试求谷氨酸的摩尔质量。,试求谷氨酸的摩尔质量。 解:解: Tf = Kf bB= Kf =nBmAKf mBmA MB则则MB= = =148(g mol -1)Kf mBmA Tf 1.86 0.749 0.050 0.188 测定溶质的相对分子质量说明:说明:利用溶液的沸点升高和凝固点降低都可以测利用溶液的沸点升高和凝固点降低都可以测定溶质的相对分子质量,但是在医学和生物科学实定溶质的相对分子质量,但是在医学和生物科学实验中验中凝固点降低法的应用更为广泛凝固点降低法的应用更为广泛。 Tb法会因温度高而引起溶剂挥发,使溶液变浓法会因温度高而引起溶剂挥发,使
8、溶液变浓而引起误差而引起误差 ; 大多大多数数溶溶剂剂的的Kf值值Kb值值,因此同一溶液的,因此同一溶液的 TfTb,因而,因而灵灵敏度高、敏度高、实验误实验误差小差小; 某些生物样品不耐高温,在沸点易变性或破坏。某些生物样品不耐高温,在沸点易变性或破坏。 应用二:制作防冻剂和冷却剂 盐和冰的混合物可用作冷却剂。冰的表面总盐和冰的混合物可用作冷却剂。冰的表面总附有少量水,当撒上盐后,盐溶解在水中成溶液,附有少量水,当撒上盐后,盐溶解在水中成溶液,此时溶液的蒸气压下降,当它低于冰的蒸气压时,此时溶液的蒸气压下降,当它低于冰的蒸气压时,冰就会融化。冰融化时将吸收大量的热,于是冰冰就会融化。冰融化时
9、将吸收大量的热,于是冰盐混合物的温度就会降低。盐混合物的温度就会降低。 采用采用NaCl和冰,温度可降到和冰,温度可降到-22,用,用CaCl22H2O和冰,可降到和冰,可降到-55。在水产事业和食。在水产事业和食品贮藏及运输中,广泛使用食盐和冰混合而成的品贮藏及运输中,广泛使用食盐和冰混合而成的冷却剂。冷却剂。 水中加入乙二醇可使水的凝固点降低,水中加入乙二醇可使水的凝固点降低,从而达到抗冻的目的。从而达到抗冻的目的。第三节:溶液的渗透压力一、渗透现象和渗透压力一、渗透现象和渗透压力二、溶液的渗透压力与浓度及温度的关系二、溶液的渗透压力与浓度及温度的关系 三、渗透压力在医学上的意义三、渗透压
10、力在医学上的意义 一一、渗透现象和渗透压力渗透现象和渗透压力 渗透现象渗透现象渗透现象渗透现象: :溶剂透过半透膜进入溶液的自发过程。溶剂透过半透膜进入溶液的自发过程。结果:结果:溶液一侧的液面升高。溶液一侧的液面升高。原因:原因:单位时间内由纯溶剂进入溶液中的溶剂单位时间内由纯溶剂进入溶液中的溶剂分分子数子数要比由溶液进入纯溶剂的多。要比由溶液进入纯溶剂的多。理想半透膜理想半透膜:只允许溶剂只允许溶剂(水水)分子通过不允许溶质分子通过不允许溶质(蔗糖蔗糖)分子透过的薄膜。分子透过的薄膜。 当液面不再变化,就达到了当液面不再变化,就达到了渗透平衡渗透平衡。渗透方向1. 1. 溶剂分子从纯溶剂一
11、方往溶液一方渗透;溶剂分子从纯溶剂一方往溶液一方渗透;2. 2. 溶剂分子溶剂分子从稀溶液一方从稀溶液一方往浓溶液往浓溶液一方渗透。一方渗透。产生渗透现象必须具备的两个条件一是有半透膜的存在;一是有半透膜的存在;二是半透二是半透膜两侧单位体积内溶剂分子数不相等膜两侧单位体积内溶剂分子数不相等。(存在渗透浓度差(存在渗透浓度差)渗透压力(osmotic pressure) 定义定义 为维持只允许溶剂通过的膜所隔开的溶液与为维持只允许溶剂通过的膜所隔开的溶液与溶剂之间的渗透平衡而需要的超额压力。溶剂之间的渗透平衡而需要的超额压力。 符号符号 单位单位 Pa 或或 kPa二、溶液的渗透压力与浓度及温
12、度的关系1. 范托霍夫(范托霍夫(Vant Hoff)定律:)定律:单位:单位:R=8.314 JK-1mol-1( 或或 kPa L K-1mol-1 )V = nBRT = cBRT稀溶液稀溶液 (cBbB) bB RT表明表明: 非电解质稀溶液的非电解质稀溶液的大小仅与单位体积溶液中大小仅与单位体积溶液中溶质质点数的多少有关,而与溶质的本性无关。溶质质点数的多少有关,而与溶质的本性无关。cB (mol L-1 )则则 (kPa)T (K ) = 273+t同温同浓度的蔗糖溶液与葡萄糖溶液的渗透压相等同温同浓度的蔗糖溶液与葡萄糖溶液的渗透压相等渗透压力的计算 c(C12H22O11) =
13、= = 0.117 (molL-1) = cB RT = 0.117 8.314 310 =302( kPa) nV2.00342 0.050例例 将将2.00g蔗糖(蔗糖(C12H22O11)溶于水,配成)溶于水,配成50.0ml溶液,求溶液在溶液,求溶液在37时的渗透压。时的渗透压。解解 C12H22O11的摩尔质量为的摩尔质量为342 gmol-1渗透压力的间接测定 例例 测得泪水的凝固点为测得泪水的凝固点为-0.52,求泪水在体,求泪水在体温温37时的渗透压力。时的渗透压力。 Tf = Kf bB = bB RT = Tf RTKf0.528.314(273+37)1.86=解解bB
14、=Tf / Kf= 721 ( kPa)渗透压力法测定相对分子质量例例 将将1.00 g牛血红蛋白溶于适量纯水中,配置成牛血红蛋白溶于适量纯水中,配置成100 ml溶液,在溶液,在20时测得溶液的渗透压力为时测得溶液的渗透压力为0.366 kPa,求求血红素的相对分子质量。血红素的相对分子质量。 V = n RT = mB RTMB解解【归纳】牛血红蛋白的浓度仅为牛血红蛋白的浓度仅为1.5010-4 molL-1,凝固点下,凝固点下降仅为降仅为2.7910-4,故很难测定。但此溶液的渗透压力相当,故很难测定。但此溶液的渗透压力相当于于37.3 mmH2O柱,因此完全可以准确测定。因此,柱,因此
15、完全可以准确测定。因此,渗透压力渗透压力法是测定法是测定蛋白质等蛋白质等高分子化合物的相对分子质量的最好方法高分子化合物的相对分子质量的最好方法。 = = 6.66104(g mol -1)1.00 8.314(273+20)0.3660.100MB =mB RT V 总结:总结:非电解质溶液非电解质溶液Tf = Kf bBTb = Kb bB = = cBRT bBRT三、渗透压力在医学上的意义1.电解质溶液的依数性 弱电解质的依数性计算可近似等同于非电解质。弱电解质的依数性计算可近似等同于非电解质。Tb =i Kb bB Tf = i Kf bB = = icBRT i bBRT校正因子校
16、正因子i :一:一“分子分子”电解质解离出的粒子个数。电解质解离出的粒子个数。 A-B2或或A2-B型强电解质如型强电解质如(MgCl2、Na2SO4等等),i=3 A-B型强电解质型强电解质(如如KCl、CaSO4、NaHCO3等等),i= 2混合溶液依数性的计算思考:一溶液含思考:一溶液含0.01molL-1蔗糖、蔗糖、 0.02molL-1葡葡萄糖和萄糖和0.01molL-1MgCl2,如何求溶液的依数性,如何求溶液的依数性(如(如Tf或在或在37时的渗透压)。时的渗透压)。三、渗透压力在医学上的意义 2.2.渗透浓度渗透浓度(osmolarity)溶液中产生渗透效应的溶质粒子(分子、溶
17、液中产生渗透效应的溶质粒子(分子、离子)统称为离子)统称为渗透活性物质。渗透活性物质。单位单位 mmolL-1定义定义 渗透活性物质的物质的量除以溶液的体积。渗透活性物质的物质的量除以溶液的体积。符号符号 cos粒子总浓度粒子总浓度 =cosRT 可用可用渗透浓度衡量渗透压渗透浓度衡量渗透压 含含0.01molL-1MgCl2 ,0.02molL-1NaCl ,0.01molL-1 C6H12O6的溶液的的溶液的Cos?80mmolL-1例例 计算医院补液用的计算医院补液用的50.0 gL-1葡萄糖溶液(葡萄糖溶液(C6H12O6)和生理盐水的渗透浓度。和生理盐水的渗透浓度。 解解 C6H12
18、O6是非电解质,是非电解质,NaCl是是i = 2的强电解质的强电解质 C6H12O6 和和NaCl的摩尔质量分别为的摩尔质量分别为180 和和58.5 (gmol-1) C6H12O6:cos= =278 mmolL-150.0 1000180NaCl :cos= 2=308 mmolL-19 100058.53.等渗、高渗和低渗溶液(1) 正常人血浆的渗透浓度为正常人血浆的渗透浓度为303.7 mmolL-1 常用的等渗溶液有常用的等渗溶液有生理盐水、生理盐水、50.0 gL-1葡葡萄糖溶液萄糖溶液、12.5 gL-1的的NaHCO3 溶液。溶液。(2)临床上规定临床上规定: 等渗溶液等渗
19、溶液: :cos在在280-320 mmolL-1的溶液的溶液; 高渗溶液高渗溶液: :cos320 mmolL-1的溶液;的溶液; 低渗溶液低渗溶液: :cos280 mmolL-1的溶液的溶液 等渗、高渗和低渗溶液在医学上的应用 a. 等渗溶液等渗溶液 ( (生理盐水生理盐水): “维持原状维持原状 ”b. 高渗溶液高渗溶液( ( 15 gL-1NaCl ) :c. 低渗溶液低渗溶液( ( 4 gL-1NaCl ):“皱缩皱缩”“溶血溶血”基本原则基本原则:大量补液时应大量补液时应用等渗溶液。用等渗溶液。4.晶体渗透压和胶体渗透压血浆渗透压血浆渗透压晶体渗透压晶体渗透压: :胶体渗透压胶体渗透压: :维持细胞内外水的相对平衡维持细胞内外水的相对平衡维持血容量和毛细血管内外维持
温馨提示
- 1. 本站所有资源如无特殊说明,都需要本地电脑安装OFFICE2007和PDF阅读器。图纸软件为CAD,CAXA,PROE,UG,SolidWorks等.压缩文件请下载最新的WinRAR软件解压。
- 2. 本站的文档不包含任何第三方提供的附件图纸等,如果需要附件,请联系上传者。文件的所有权益归上传用户所有。
- 3. 本站RAR压缩包中若带图纸,网页内容里面会有图纸预览,若没有图纸预览就没有图纸。
- 4. 未经权益所有人同意不得将文件中的内容挪作商业或盈利用途。
- 5. 人人文库网仅提供信息存储空间,仅对用户上传内容的表现方式做保护处理,对用户上传分享的文档内容本身不做任何修改或编辑,并不能对任何下载内容负责。
- 6. 下载文件中如有侵权或不适当内容,请与我们联系,我们立即纠正。
- 7. 本站不保证下载资源的准确性、安全性和完整性, 同时也不承担用户因使用这些下载资源对自己和他人造成任何形式的伤害或损失。
最新文档
- 大数据在客户忠诚度分析中的应用-全面剖析
- 2024年度北京市护师类之妇产护理主管护师题库练习试卷B卷附答案
- 人教版小学一年级家庭作业管理计划
- 小学信息技术课外拓展计划
- 新部编版一年级语文上阅读推广计划
- 人教版数学上册教育资源整合计划
- 部编版二年级语文下册作业安排计划
- IT支持团队工作职责及工作流程
- 传统节日故事新编范文
- 小学信息技术游戏化教学计划
- 《人间词话》ppt课件(PPT 50页)
- 生物质循环流化床锅炉最终版.ppt
- 红头文件模板
- 固定收益部绩效考核办法
- 光纤端面清洗操作规范方案和判定标准
- Power---PowerVM安装配置手册
- 小型液压机液压系统设计
- 1 ultrafleXtreme质谱仪
- 六类网线检测报告(共9页)
- 高中三年成绩单模板(新留学)
- 2020急诊科护士分层培训计划

评论
0/150
提交评论